藻蓝蛋白介导光动力疗法在乳腺癌治疗中的机制研究
2011-02-27褚现明高美华徐颖婕
李 冰,褚现明,高美华,徐颖婕
(青岛大学医学院1.生物学教研室,山东 青岛 266021;2.附属医院心内科,山东 青岛 266101;3.免疫学教研室,山东青岛 266021)
光动力学疗法是一种微创性治疗手段[1-2]。随着光敏物质、光激活装置和导光系统的发展和进步,该疗法已逐步成为肿瘤的基本治疗手段之一。光动力学疗法的治癌机制主要是由于癌细胞能特异性摄取一种叫光敏剂的物质。光敏剂被癌细胞摄取后,能较长时间留在癌细胞内。光敏剂经一种特殊波长的光(常用630nm的激光)照射后,产生一种具有毒性作用的活性态氧离子,从而破坏癌细胞。所以光敏剂的选择至关重要,目前选择开发安全无毒的新型光敏剂成为研究的重点[3-4]。
藻蓝蛋白(C-phycocyanin,C-PC)是一种存在于钝顶螺旋藻细胞内的光合色素,能高效捕获光能。由肽链上共价结合1个开链的四吡咯环辅基构成,类似动物红细胞的血红素结构。因其水溶性、安全无毒、清亮且着色力强等优点,藻蓝蛋白被广泛用于食品着色剂和化妆品的添加剂。另外藻蓝蛋白具有一定的医疗价值,具有改善血脂代谢、抗衰老、抗氧化、抗辐射、抗疲劳、抑制肿瘤和提高机体免疫力等作用[5]。蔡心涵等[6]用螺旋藻藻蓝蛋白对 S180移植瘤和人大肠癌细胞进行体内外激光治癌实验,但对作用机制研究甚少,本研究选择藻蓝蛋白作为光敏剂,对其介导的光动力学疗法治疗小鼠乳腺癌的免疫和凋亡机制进行探讨。
1 材料
1.1 实验动物BALB/C纯系小鼠40只,♀♂各半,体质量20~22 g,购自北京大学医学部动物房。
1.2 细胞MCF-7细胞(本实验室保种)。
1.3 激光器HNZSQ-型氦氖激光照射器(上海医用激光仪器厂)
1.4 光敏剂藻蓝蛋白。由本实验室从钝顶螺旋藻粉中提取纯化,纯度为A620/A280=4.71。
1.5 其它试剂4%多聚甲醛(PFA)、3%柠檬酸、2×SSC、DMEM培养液(美国Gibco公司);胰酶(购自Amersco公司);Poly-L-Lysine、DEPC、CD44 原位杂交试剂盒、Fas免疫组化试剂盒、兔抗人P53/NFkB单克隆抗体(武汉博士德生物工程有限公司)。
2 方法
2.1 动物模型建立和分组小鼠在左侧肋缘皮下脾区接种MCF-7细胞0.2 ml(约1×105个细胞),24 h后随机分成3组:(1)对照组:15只小鼠,植瘤后不照激光不加藻蓝蛋白;(2)激光照射组:15只小鼠,植瘤24 h后进行He-Ne激光照射;(3)藻蓝蛋白处理组:15只小鼠,注入2ml藻蓝蛋白液(320 g·L-1);(4)藻蓝蛋白+激光照射组:15只小鼠,注射2ml藻蓝蛋白液(320 g·L-1),2 h后给予激光照射。
照射时需固定小鼠,去毛并充分暴露瘤体,采用24 mW He-Ne激光照射器照射瘤区,激光光纤输出电流10 mA,光纤头距离瘤体中心50 cm,光斑直径2 cm,每天照射10 min,照射10 d为一疗程。
2.2 组织的采集、石蜡包埋和切片的制作
2.2.1 组织的收集和处理 4~5 d长出肿块,实验d11乙醚麻醉小鼠后断颈处死,置于75%乙醇溶液中消毒5 min。剖开小鼠腹腔取出胸腺和脾脏,并分离皮内瘤块,将以上组织去除包膜,称瘤块重量并计算每组小鼠的肿瘤形成率(成瘤率/%=每组中有肿瘤形成的小鼠数量/每组小鼠的数量×100%)。
取肿瘤组织切成0.5 cm×0.5 cm×0.5 cm大小,分别置于盛有10%甲醛(DEPC处理)的小瓶中,4℃固定。余下组织经针栓研磨,200目筛绢过滤,制成细胞悬液。
2.2.2 载玻片、器皿和仪器的处理 配制1∶10的多聚赖氨酸于塑料容器中,每批载玻片泡5 min。所有载玻片、器皿和仪器均需浸泡在DEPC中做除RNA酶处理。
2.2.3 常规石蜡切片的制备
2.3 免疫细胞免疫活性的监测
2.3.1 各组中NK细胞活性的比较 取脾细胞5×106作为效应细胞(NK细胞),K562细胞5×105(靶细胞),效 ∶靶为10 ∶1。取效、靶细胞各100 μl加入96 孔板,各孔加 MTT 10 μl(5 g·L-1),置 37℃5%CO2培养箱孵育 4 h,离心 1500 r·min-1,吸去上清,每孔加入二甲基亚砜150 μl,振荡10 min,570 nm波长测OD值。NK活性/%=[实验孔(效靶)OD值-效应细胞孔OD值]/靶细胞对照孔OD值×100%。
2.3.2 各组中T细胞增殖活性比较 采用MTT还原分析法。将胸腺制成细胞悬液,用RPMI 1640营养液洗3 次,将细胞配成5 ×109·L-1,取100 μl(含5×105/细胞)细胞加入96孔培养板中,每孔加入ConA 20 μl(浓度 25 mg·L-1),37℃ 5%CO2培养箱中培养48 h,收获前 5 h 参入 MTT 50 μg·孔-1,培养结束时,低温离心1 000 r·min-1,弃上清,加入二甲亚砜150 μl,振荡10 min,490 nm 处测 OD 值,作为T细胞的增殖活性。
2.4 免疫组化法检测各组中肿瘤细胞表面Fas、NF-κB、p53蛋白表达的比较实验步骤按试剂说明书。切片常规脱蜡至水,灭活内源性过氧化物酶,热修复抗原,DAB显色,苏木精轻度复染,脱水、透明,中性树胶封片。免疫组化染色胞质或(和)胞膜棕黄色为阳性结果。参照Frormowitz的方法,随机选取5个高倍视野(×400),首先根据阳性细胞所占的百分比记分,阳性细胞数<5%为0分,5% ~25%为1分,26% ~50%为2分,51% ~75%为3分,76% ~100%为4分。再根据阳性细胞显色强度记分:无着色为0分,轻度色为1分,中度染色为2分,重度染色为3分,两者得分之和即为阳性蛋白表达,其中0~1分为阴性(-),2~3分为弱阳性(+),4~5分为中等阳性(),6~7分为强阳性()。
2.5 原位核酸杂交法检测各组中肿瘤细胞CD44mRNA表达的比较具体步骤参照CD44原位杂交试剂盒说明书进行。由上海博亚生物公司合成针对CD59cDNA的寡核苷酸探针。探针序列为5'-AAGTGTTGGAAGCATGAGCAGTGCAATT-3',5'经地高辛标记。石蜡切片经常规脱蜡至水,灭活内源性酶,DAB显色,苏木精复染,充分水洗。乙醇脱水,二甲苯透明,封片,镜检。
2.6 MCF-7细胞增殖活性检测采用 MTT法。将MCF-7细胞制成细胞悬液,用RPMI 1640营养液洗3 次,将细胞配成5 ×108·L-1,取100 μl加入96孔培养板中。培养24 h后更换新鲜培养液,细胞分成4组:对照组,激光照射组(细胞每天接受激光照射2 min),藻蓝蛋白处理组(加入80 mg·L-1的藻蓝蛋白液),光动力学治疗组(加入80 mg·L-1的藻蓝蛋白液两小时后激光照射2 min)。37℃ 5%CO2培养箱中培养72 h,收获前5 h加入20 μl/孔 MTT(5 g·L-1),培养结束时,低温离心1 000 r·min-1,弃上清,加入二甲亚砜100 μl/孔,轻微振荡10 min使甲臜结晶充分溶解,用酶标仪测定490 nm处的光密度(OD490)。
2.7 电镜形态学观察不同组的MCF-7细胞分别收集于EP管中,PBS洗涤两次。1500 r·min-14℃离心10 min,细胞沉淀用PBS洗两次,将细胞悬浮于2.5%戊二醛中固定30 min,再用PBS洗两次、将细胞悬浮于1%锇酸中固定1 h、以丙酮梯度脱水、在将细胞置于丙酮∶包埋剂(1∶1)中置换30 min、用单包埋剂浸泡2 h,离心收集细胞,按常规将细胞包埋、切片、双重染色,用透射电子显微镜观察细胞形态。
2.8 细胞色素C释放试验分别取4组细胞少量置于EP管中,pH7.4 0.01 mol·L-1PBS洗涤两次。细胞涂片,吹干。95%乙醇固定5 min,待干加入FITC-抗人细胞色素C约每孔5 μl,对照孔加小鼠IgG 约5 μl,置湿盒中,37℃ 45 min。PBS 洗涤3 次,干后镜检。阴性对照组,用PBS代替一抗。
2.9 统计学分析结果以±s表示,以SPSS软件分析,t检验确定差异显著性。
3 结果
3.1 各组小鼠瘤块重量和肿瘤形成率的比较Tab 1和Fig 1、2显示,与对照组相比较,激光组中瘤块体积、重量和肿瘤形成率无变化(P>0.05),而藻蓝蛋白处理组中明显降低(P<0.05),PDT组与对照组比较,差异有显著性(P<0.01)。PDT组与藻蓝蛋白处理组比较,P<0.05。这说明CPC具有抗肿瘤的作用,而在辅助He-Ne激光作用后,这种作用效果更加明显。
3.2 各组中NK细胞活性比较由Tab 2可见,与对照组相比,单独激光照射对NK细胞活性影响不大(P>0.05),而C-PC具有增强NK细胞活性的作用,与对照组相比较,P<0.05,差异有显著性。而PDT组与对照组比较,差异有显著性(P<0.01)。PDT组与藻蓝蛋白处理组比较,P<0.05。这表明激光能够增强藻蓝蛋白对NK细胞的活化作用。
3.3 各组小鼠T细胞增殖活性的比较Fig 3表明,与对照组相比,He-Ne激光照射组无明显变化(P>0.05)。而藻蓝蛋白处理组中荷瘤小鼠胸腺T细胞增殖活性明显增强,与对照组相比,P<0.05,差异明显。而光动力学治疗组差异更为显著,P<0.01。PDT组与藻蓝蛋白处理组比较,P<0.05。由此证明CPC具有增强T细胞活性的功能,而激光可强化这一功能。

Tab 1 Comparision of tumor weight of four groups of mice
Fig 1 Comparision of tumor volume of four groups of mice

Fig 2 Comparision of tumor forming rate of four groups of mice

Tab 2 Comparision of NK cell activities of four groups of mice(n=15)
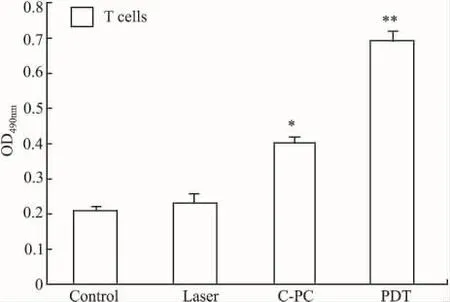
Fig 3 Comparision of the proliferative activity of T cells of four groups of mice
3.4 各组中肿瘤细胞Fas基因表达的比较Tab 3显示,激光照射组肿瘤细胞中Fas蛋白的阳性表达率为53.33%,与对照组差异无显著性(P>0.05),而藻蓝蛋白处理组明显高于对照组(66.67%),P<0.05,有统计学意义。而PDT组中Fas的阳性表达率为80%,明显高于其在其它3组中的表达,P<0.01。Fig 3显示藻蓝蛋白处理组肿瘤组织中Fas的阳性表达量明显高于对照组,而光动力学治疗组肿瘤细胞中Fas的阳性表达量较其它3组中的表达又进一步升高。这表明藻蓝蛋白对肿瘤组织中Fas的表达具有促进作用,而辅助激光照射能使促进作用更明显。
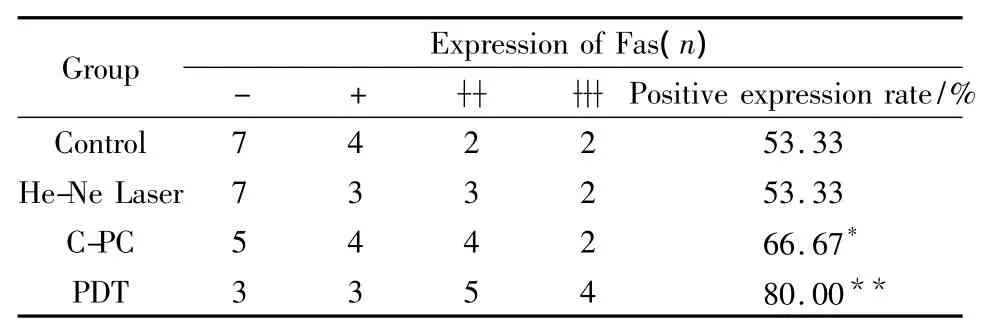
Tab 3 Comparision of Fas protein expression in tumor cells of four groups of mice(n=15)
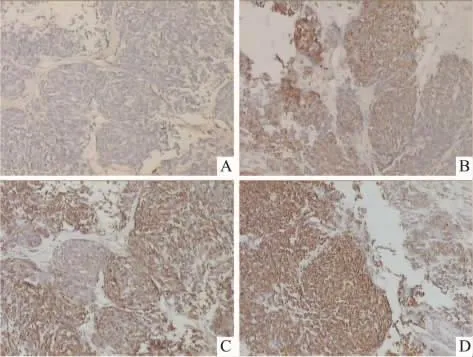
Fig 4 Comparision of Fas protein expression in tumor cells of four groups of mice
3.5 各组中肿瘤细胞中NF-κB和p53蛋白表达的比较Tab 4显示,与对照组相比,激光照射组肿瘤组织中NF-κB和p53的阳性表达率无明显变化(P>0.05)。而藻蓝蛋白处理组肿瘤组织中NF-κB和p53的阳性表达率分别为73.33%和80%,明显低于它们在对照组中的表达(93.33%),P<0.05,有统计学意义。而PDT组中NF-κB和p53的阳性表达率为53.33%和60%,明显低于其在其它3组中的表达(P<0.01)。这表明藻蓝蛋白具有抑制肿瘤组织中NF-κB和p53表达的作用,而激光照射能增强这种抑制作用。
3.6 各组中肿瘤细胞CD44 mRNA表达的比较Tab 5显示,激光照射组肿瘤细胞中CD44 mRNA的阳性表达率86.67%,与对照组相比无明显变化(P>0.05),而藻蓝蛋白处理组为78.57%,明显低于它在对照组中的表达(93.75%),P<0.05,有统计学意义。而PDT组中CD44 mRNA的阳性表达率为60%,明显低于其在其它3组中的表达(P<0.05)。由Fig 4可见,藻蓝蛋白处理组肿瘤组织中CD44 mRNA的阳性表达量明显低于对照组,而光动力学治疗组肿瘤细胞中CD44 mRNA的阳性表达量较其在对照组和激光照射组中的表达又进一步下降。这表明藻蓝蛋白具有抑制肿瘤组织中CD44 mRNA表达的作用,而在激光照射的辅助下该抑制作用得到进一步提升,从而抑制肿瘤细胞的恶性增殖及其侵袭转移能力。
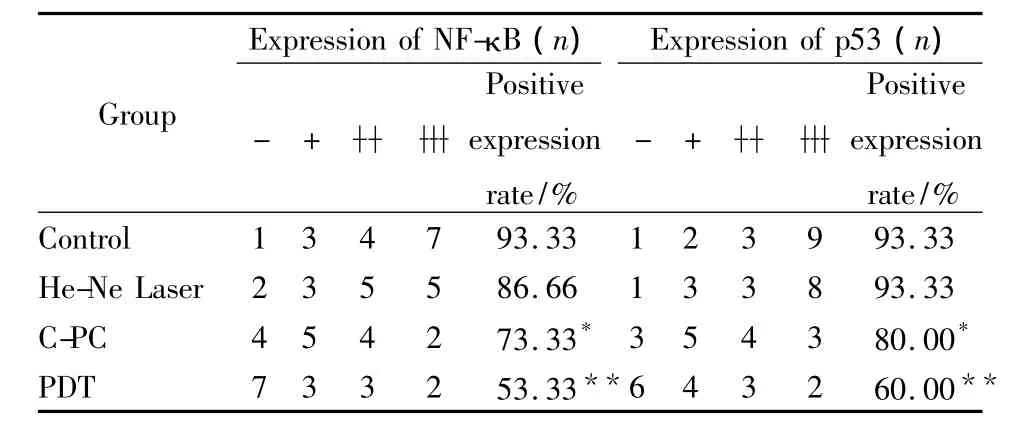
Tab 4 Comparision of NF-κB,p53 protein expression in tumor cells of four groups of mice
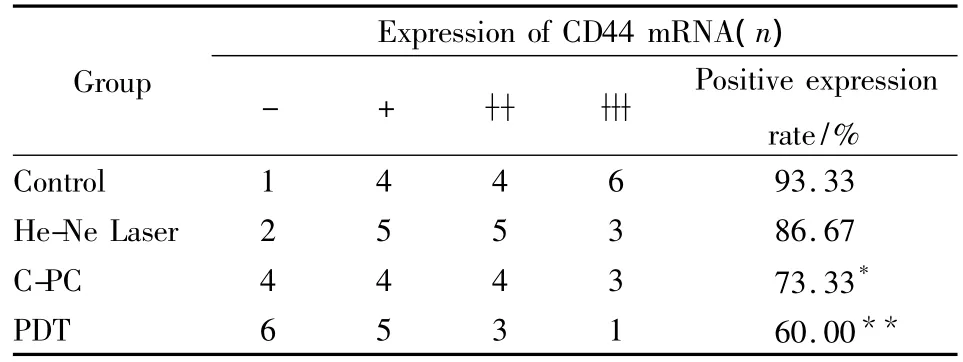
Tab 5 Comparision of CD44 mRNA expression in tumor cells of four groups of mice(n=15)
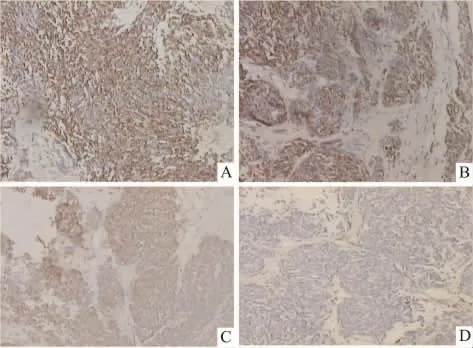
Fig 5 Comparision of CD44 mRNA expression in tumor cells of four groups of mice
3.7 MCF-7细胞增殖活性检测Fig 6表明,与对照组相比,He-Ne激光照射组MCF-7细胞数目无明显变化(P>0.05)。而藻蓝蛋白处理组中MCF-7细胞数目明显减少,与对照组相比(P<0.05),差异明显。而光动力学治疗组差异更为明显(P<0.01)。由此证明藻蓝蛋白具有抑制MCF-7细胞增殖的功能,而激光可强化这一功能。
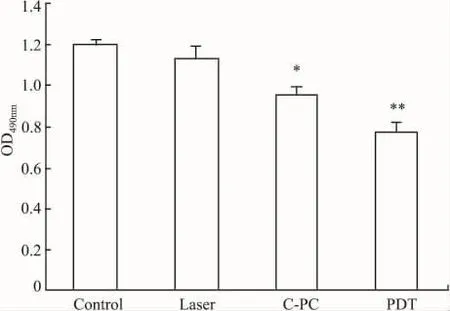
Fig 6 Detection of proliferative activities of MCF-7 cells
3.8 电镜形态学观察Fig 7显示藻蓝蛋白处理组细胞形态发生了一系列的改变,细胞失去微绒毛,胞质浓缩,核染色质凝集,而光动力学治疗组细胞变圆,染色质进一步凝集,该结果说明藻蓝蛋白可能通过诱导体外 MCF-7细胞的凋亡来发挥其抗肿瘤效用,而结合激光作用后可加速细胞的凋亡进程。

Fig 7 Morphological features of three groups of MCF-7 cells
3.9 细胞色素C释放试验Fig 8表明,与对照组相比,He-Ne激光照射组MCF-7细胞内荧光强度无明显变化。而藻蓝蛋白处理组中MCF-7细胞中荧光强度明显增强,而光动力学治疗组中荧光强度进一步增强。由此证明藻蓝蛋白具有促进MCF-7细胞中细胞色素C从线粒体向细胞质的释放,而激光可强化这一功能。
4 讨论
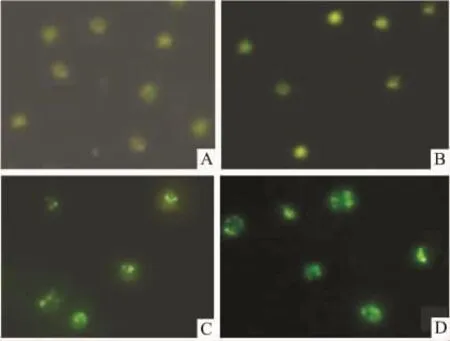
Fig 8 Comparision of release quantities of cytochrome C
肿瘤的形成是一种多因素、多阶段、长期相互作用的过程,其机制非常复杂。近年来,有关分子肿瘤学的研究进展极为迅速,癌基因、原癌基因、抗癌基因的异常表达,造成肿瘤细胞死亡信号传递系统的紊乱可能是肿瘤形成的重要机制[7-11]。本研究选用对人无害的氦氖激光照射瘤细胞区,促进肿瘤死亡信号的传递,并提高荷瘤机体的抗肿瘤免疫力。研究结果证明:藻蓝蛋白处理组瘤块重量、肿瘤形成率均低于对照组,同时,藻蓝蛋白能够增强NK细胞的活性及T细胞的增殖活性,这表明藻蓝蛋白照射确实具有抗肿瘤及提高免疫细胞活性的作用。而藻蓝蛋白和激光联合作用后,抗肿瘤免疫效应明显增强,藻蓝蛋白的光敏作用可能与藻蓝蛋白的分子结构有关。藻蓝蛋白属于藻胆蛋白的一种,为一种捕光色素蛋白,具光能作用,它的载体蛋白以共价键形式连结着开链血毗咯发色团,与卟啉衍生物有类似之处。目前我国应用的光敏剂多数为血卟啉衍生物,如YHPD、癌光啉等,或叶绿素叶啉,这些光敏剂在临床上应用时,往往存在一定的毒副作用,在治疗时,患者为防止正常组织及皮肤受损而需避光一段时间,使激光治癌受到一定的限制。而藻蓝蛋白从海洋生物藻蓝中提取,资源丰富,且其无毒,安全,其本身已作为营养保键食品为人们利用,故这种光敏剂如能用于临床,病人更易接受,具有进一步推广应用价值。
细胞凋亡的发生作为光动力学疗法治疗癌症、诱导癌细胞死亡的机制性探讨也在本实验中得到了证实。细胞凋亡是细胞受基因调控的程序性的死亡过程,Fas、p53、NF-κB 是调控细胞凋亡的相关基因,是细胞凋亡途径中重要的信号分子[12-15]。免疫细胞上的配体FasL与Fas结合,通过激活caspase引起细胞凋亡。p53作为抑癌基因可通过控制细胞周期G1向S期移行来参与细胞周期调控。近年来发现,核转录因子 κB(Nuclear factor-kappa b,NF-κB)的激活可以促进肿瘤的生长,在肿瘤的治疗中是研究的热点,在肿瘤细胞中其具有调控多种基因转录表达的能力,与肿瘤细胞的生长、增殖和浸润、转移的关系密切,还能调控肿瘤细胞的凋亡和免疫活性[16]。CD44及其变异体分子参与肿瘤的发生发展和侵袭转移,尤其是CD44V6在肿瘤侵袭转移中的作用,它们可能是判断肿瘤生物学行为及预后因素的重要指标[17-18]。藻蓝蛋白处理后肿瘤细胞内抗凋亡基因(p53)和与肿瘤增殖转移逃逸有关的基因(NF-κB、CD44)表达量明显减少,而促凋亡基因(Fas)明显增多。体外实验也证实PDF组出现明显的凋亡形态,MCF-7的增殖活性受到抑制,而细胞色素C的释放量明显增多。在藻蓝蛋白和氦氖激光联合作用的光动力学治疗组中p53、NF-κB、CD44蛋白的表达量进一步增多,而Fas大大减少。MCF-7细胞的凋亡形态更为明显,增殖活性进一步降低,而细胞色素C的释放量进一步增多。
本实验证明藻蓝蛋白可以作为一种光敏剂,其介导的光动力学疗法在宫颈癌治疗中的作用机制主要是通过增强机体的免疫力,同时启动MCF-7细胞内的凋亡信号转导通路诱导细胞凋亡,从而达到杀死肿瘤的目的。
[1] Brown S B,Brown E A,Walker I.The present and future role of photodynamic therapy in cancer treatment[J].Lancet Oncol,2004,5(8):497-508
[2] Kwitniewski M,Juzeniene A,Ma L W,et al.Diamino acid derivatives of PpIX as potential photosensitizers for photodynamic therapy of squamous cell carcinoma and prostate cancer:in vitro studies[J].J Photochem Photobiol B,2009,94(3):214 -22.
[3] Prasad G A,Wang K K,Halling K C,et al.Correlation of histology with biomarker status after photodynamic therapy in Barrett esophagus[J].Cancer,2008,113(3):470 - 6.
[4] Nyst H J,Tan I B,Stewart F A,et al.Is photodynamic therapy a good alternative to surgery and radiotherapy in the treatment of head and neck cancer?[J]Photodiagnosis Photodyn Ther,2009,6(1):3-11.
[5] Li B,Zhang X C,Gao M H,et al.Effects of CD59 on antitumoral activities of phycocyanin from Spirulina platensis[J].Biomed Pharmacother,2005,59(10):551 -60.
[6] 蔡心涵,何立明,蒋家伦,等.螺旋藻藻蓝蛋白对癌激光疗法增敏作用的实验研究[J].中国海洋药物杂志,1995,14(1):15-9.
[6] Cai X H,He L M,Jiang J L,et al.The experimental study of application of phycocyanin in cancer laser therapy[J].Chin J Marine Drugs,1995,14(1):15 -9.
[7] Schimke R T,Mihich E.Fifth annual Pezcoller symposium:apoptosis[J].Cancer Res,1994,54(1):302 -5.
[8] 李 冰,褚现明,高美华,张学成.钝顶螺旋藻藻蓝蛋白诱导HeLa细胞凋亡的分子机制研究[J].中国药理学通报,2009,25(8):1045-50.
[8] Li B,Chu X M,Gao M H,Zhang X C.Study on the molecular mechanism of C-phycocyanin from Spirulina platensis induced apoptosis in HeLa cells[J].Chin Pharmacol Bull,2009,25(8):1045-50.
[9] 王晓琴,王振华,刘 梅,张 波.氧化还原调控在紫檀芪诱导HeLa细胞内质网凋亡途径中的作用[J].中国药理学通报,2010,26(9):1184-8.
[9] Wang X Q,Wang Z H,Liu M,Zhang B.The role of redox sensing in pterostilbene-induced HeLa cell apoptosis via endoplasmic reticulum pathway[J].Chin Pharmacol Bull,2010,26(9):1184-8.
[10]张乃菊,陈天平,董淑英,等.赖氨匹林对人宫颈癌HeLa细胞的抑制作用及其机制研究[J].中国药理学通报,2010,26(9):1212-5.
[10] Zhang N J,Chen T P,Dong S Y,et al.Inhibitory effects and mechanism research of aspisol on huran cervical cancer HeLa cells[J].Chin Pharmacol Bull,2010,26(9):1212 -5.
[11]于春艳,李洪岩,钟加滕,等.维生素K3通过下调mTOR信号途径而诱导HeLa细胞自噬[J].中国药理学通报,2009,26(9):1173-6.
[11] Yu C Y,Li H Y,Zhong J T,et al.Vitamin K3 induces autophagy in HeLa cells through downregulating the mammalian target of rapamycin(mTOR)pathway[J].Chin Pharmacol Bull,2009,25(9):1173-6.
[12] Choi S E,Sohn S,Cho J W,et al.9-Hydroxypheophorbide alpha-induced apoptotic death of MCF-7 breast cancer cells is mediated by c-Jun N-terminal kinase activation[J].J Photochem Photobiol B,2004,73(1-2):101 -7.
[13]曹 波,雷志勇,陈虹新,等.新的微管抑制剂YB-13诱导He-La细胞凋亡及其机制[J].中国药理学通报,2008,24(1):123-7.
[13] Cao B,Lei Z Y,Chen H X,et al.YB-13,a novel synthetic m icrotubule inhibitor,induces apoptosis of HeLa cells and itsmechanism[J].Chin Pharmacol Bull,2008,24(1):123 -7.
[14]乔爱敏,池岛乔,张为革,等.激活AKT和ERK可拮抗N-去甲基克拉霉素对HeLa细胞的凋亡诱导作用[J].中国药理学通报,2007,23(3):379 -83.
[14] Qiao A M,Ikejima takashi,Zhang W G,et al.N-demethyl-clarithromycin induced HeLa apoptosis through regulating Akt and ERK activity[J].Chin Pharmacol Bull,2007,23(3):379 -83.
[15] Zhou C,Shunji C,Jinsheng D,et al.Apoptosis of mouse MS-2.brosarcoma cells induced by photodynamic therapy with Zn(Ⅱ)–Phthalocyanine[J].J Photochem Photobiol B,1996,33(3):219-23.
[16] Gilmore T D,Koedood M,Piffat K A,et al.Rel/NFκB/IkB proteins and cancer[J].Oncogene,1996,13(7):1367 -78.
[17] Screaton G R,Bell M V,Jackson D G,et al.Genomic structure of DNA encoding the lymphocyte homing receptor CD44 reveals at least 12 alternatively spliced exons[J].Proc Natl Acad Sic USA,1992,89(24):12160-4.
[18] Camp R L,Kraus T A,Pure E.Variations in the cytoskeletal interaction and posttranslational modification of the CD44 homing receptor in macrophages[J].J Cell Biol,1991,115(5):1283 -92.
