CD44抗体HI44a对急性髓系白血病细胞株HL-60细胞体外增殖、分化作用的研究
2011-02-27宋清晓陈元仲
宋清晓,吴 勇,陈元仲
(福建省血液病研究所,福建医科大学附属协和医院,福建福州 350001)
急性白血病是造血系统的恶性疾病,其特征是造血细胞增殖失控、分化障碍和凋亡受阻。白血病细胞可自发产生一些细胞因子,通过自泌环节作用于细胞本身的增殖、分化、凋亡。已知造血因子主要可分为两大类。一类是正性造血细胞因子,如SCF、IL-1、IL-3、IL-6、IL-8、IL-11、G-CSF、GM-CSF、EPO、TPO等;另一类是负性造血细胞因子,主要有TGF-β1、TNF-α和IFNγ等。CD44分子是一种分布广泛的细胞表面黏附分子,包括CD44S和CD44V,是细胞与细胞、细胞与ECM相互识别和作用的分子基础,参与细胞间的黏附、淋巴细胞的活化、淋巴细胞归巢或再循环、细胞的运动及细胞内外的信号传导。由于CD44分子本身的生物学功能特性,决定了其可能成为一个治疗急性髓系白血病的优秀药物靶点。而骨桥蛋白(osteopontin,OPN)作为CD44的配体,特异性地识别CD44V6,它参与了某些肿瘤细胞的侵袭、扩散和转移过程,但CD44抗体诱导急性髓系白血病原始细胞分化的过程中,OPN如何变化及起什么作用均未见报道。HI44a(IgG2a)是一种鼠源性的抗CD44单克隆抗体,其结合位点位于CD44分子胞外区临近透明质酸结合位点处。本实验研究HI44a对急性髓系白血病细胞株HL-60的体外增殖与分化作用。
1 材料与方法
1.1 细胞株及培养条件HL-60细胞株系本所所藏,全反式维甲酸(ATRA,Sigma公司,美国),CD44单克隆抗体HI44a(IgG2a,协和干细胞基因工程公司)。培养条件:含体积分数为0.10的灭活胎牛血清(天津市灏洋生物制品科技有限责任公司)、置37℃、体积分数5%CO2饱和湿度的培养箱培养,隔日半量换液,存活细胞百分率(台盼蓝拒染法)>95%。
1.2 HI44a对HL-60细胞增殖的影响取处于对数生长期的HL-60细胞重悬于体积分数为10%的灭活胎牛血清的RPMI 1640培养液中,分成HL-60、HL60+HI44a、HL-60+ATRA共3组,分别种于96孔培养板,细胞浓度为1×108·L-1,HI44a终浓度为 40 mg·L-1,ATRA 终浓度为 1 μmol·L-1。置37℃、体积分数5%CO2饱和湿度的培养箱培养,培养24、48、72、96 h后分别取细胞悬液用台盼蓝染色后计数活细胞数。取3孔平均值,以时间为横坐标,活细胞数为纵坐标,绘制细胞生长曲线。
1.3 HI44a对HL-60细胞分化的影响取对数生长期HL-60细胞2×108·L-1加入终浓度为40 mg·L-1的HI44a,同时设置阴性及阳性对照组,分别加入终浓度为10 mg·L-1的 IgG2a和终浓度为1 μmol·L-1的 ATRA,置 37℃培养(条件同上),于96 h收集细胞。
1.3.1 细胞形态学检查HI44a处理HL-60细胞前后细胞形态的变化 收集HL-60细胞及HI44a、ATRA处理96 h的HL-60细胞离心,涂片,晾干后行瑞氏染色,普通光学显微镜油镜下观察细胞形态的变化。
1.3.2 流式细胞学检测HI44a处理HL-60细胞前后细胞表面分化抗原CD11b、CD15的表达变化 取5 ×108·L-1培养后细胞,PBS 洗两次,加入20 μl荧光标记的鼠抗人CD11b或CD15抗体(BD公司),同时以FITC标记的IgG2a作为同型对照,4℃孵育30 min,PBS洗涤后,流式细胞仪检测并分析。
1.4 RT-PCR检测HI44a处理HL-60细胞前后TGFβ1、TGFβR1的表达收集各组细胞,提取总RNA,准确定量后合成cDNA,PCR扩增反应体系20 μl,含 cDNA 1 μl,2 × Tag PCR MasterMix 10 μl(TIANGEN),上、下游引物各0.5 pmol,置 DNA扩增仪(2400型,PE公司)扩增。同时以β-肌动蛋白(β-actin)的mRNA扩增作为内参照。PCR产物经琼脂糖凝胶电泳,凝胶图像分析仪分析。
1.5 荧光定量 RT-PCR 法检测 OPN、IL3-Rα、GM-CSFRα、HβC mRNA的表达收集各组细胞,提取总RNA,准确定量后合成cDNA,再采用SYBR Green(BD公司)进行定量PCR,总反应体系20 μl,含 2 × SYBR Green PCR Mix 9 μl,上、下游引物各0.5 pmol,cDNA 2 μl。荧光定量 PCR 结果采用相对定量法=2-△△CT分析。反应体系及反应参数、各基因引物及PCR参数,见Tab 1。
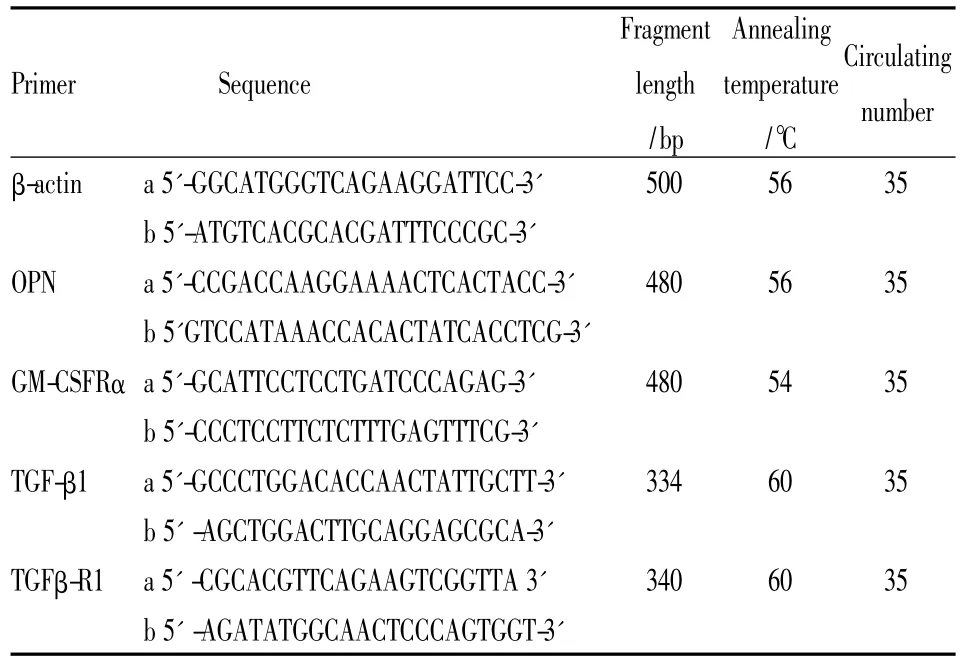
Tab 1 The sequences of primers,the sizes of amplified fragments,the annealing temperatures and cycles for PCR
1.6 DNA序列分析检测HI44a处理HL-60细胞前后OPN异构体的变化
1.6.1 PCR 反应 总反应体系 50 μl,采用高保真酶(platinum Taq DNA polmerase high fidelity),反应体系如下:10 × High fielidty Buffer 5 μl,2.5 mmol·L-1each dNTP Mix 4 μl,50 mmol·L-1MgSO42 μl,上、下游引物各 1 pmol,Platium Taq 0.2 μl,cDNA 3 μl。OPN编码区序列上游引物为:5'-TGCAGCCTTCTCAGCCAAAC-3',下游引物 为:5'-TTACAGGGAGTTTCCATGAAGCC-3'。扩增条件:94℃预变性2 min 后,94℃变性 30 s,58℃退火 30 s,68℃ 延伸 2 min,共35个循环,再68℃延伸7 min。扩增产物长度为1 200 bp。
1.6.2 OPN PCR产物纯化及测序 回收PCR产物按割胶回收试剂盒(General Electric Company)说明书进行,将纯化产物连接至T载体上(Promega公司产品),将所连接产物转化至感受态大肠杆菌JM-109细胞,用牙签挑取数个白色菌落,采用PCR方法鉴定,扩增产物经2%琼脂糖凝胶电泳可见目的基因扩增带,将HL-60组、HI44a及ATRA组各挑取8个菌落加5 ml含氨苄的LB液体培养基,37℃振摇过夜,按(General Electric Company)试剂盒提取质粒DNA,在紫外分光光度仪上准确定量后进行测序反应,总反应体系 10 μl,含 Big Dye terminator Mix 1.0 μl,5 × buffer 1.5 μl,1 pmol引物 1.6 μl,质粒 DNA 300 ng。反应条件:96℃预变性2 min后,96℃变性20 s,50℃退火 10 s,60℃延伸 4 min,共 25 个循环。将测序反应产物纯化后跑测序胶,计算机分析结果。
1.7 ELISA法检测各实验组培养基上清中的OPN水平OPN ELISA检测试剂盒购自美国R&D公司,按照试剂盒说明书操作。
1.8 统计学处理统计学分析采用SPSS 11.5统计软件,计量资料以±s表示,组间均值比较采用t检验。
2 结果
2.1 HI44a对HL-60细胞增殖的影响HI44a组HL-60细胞增殖受抑制,但不如ATRA明显。
2.2 HI44a对HL-60细胞分化的影响
2.2.1 HI44a处理HL-60细胞前后细胞形态变化HL-60细胞与40 mg·L-1的HI44a共培养后,细胞表现为体积变大、核固缩、核质比例降低、核仁减少、出现核分叶等往成熟细胞分化的表观特征。见Fig 2。
2.2.2 HI44a处理HL-60细胞前后细胞表面分化抗原的表达变化 (1)HI44a作用后,CD15表达上调,但不如ATRA组明显,CD11b表达无明显改变。结果见Tab 2。
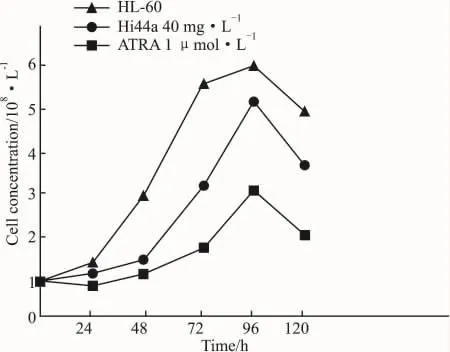
Fig 1 Effects of HI44a on the proliferation of HL-60 cells
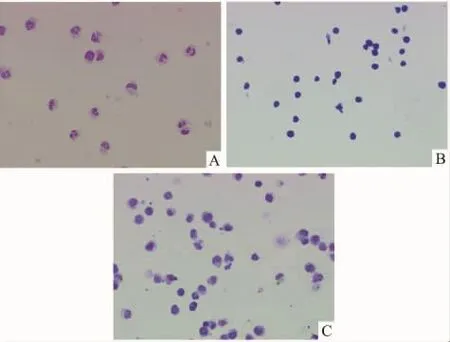
Fig 2 Effects of HI44a on the differentiation of HL-60 cells(HP×200)

Tab 2 The levels of CD15 and CD11b detected by flow cytometry in the HL-60 group,HI44a group and ATRA group
2.2.3 RT-PCR 检测各组细胞 TGF-β1、TGF-βR1 mRNA表达水平 HL-60细胞在与HI44a共同培养96 h 后,TGF-β1mRNA 表达增高,TGF-βR1 表达水平无明显变化。见Fig 3、4。
2.2.4 荧光定量RT-PCR法检测HI44a诱导HL-60分化过程中表达 OPN、GM-CSFRα、HβC 、IL3-RαmRNA的变化,结果采用相对定量法 =2-△△CT分析,结果显示经HI44a处理的HL-60细胞OPN表达下调,GM-CSFRα表达上调。见Fig 5、6。
与HL-60组比较,HI44a组OPN mRNA表达下调0.60倍,ATRA组OPN mRNA表达下调0.69倍,IgG2a组OPN mRNA表达上调1.07倍,结果见Fig 5。
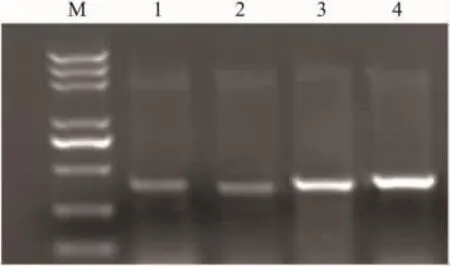
Fig 3 Expression of TGF-β1mRNA in HL-60 group,HI44a group and ATRA group detecded by RT-PCR
Fig 4 Expression of TGFβR1 mRNA in HL-60 group,HI44a group,IgG2a control group and ATRA control group detecded by RT-PCR
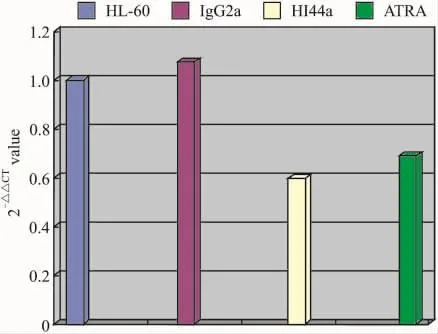
Fig 5 Expression of OPN mRNA in HL-60 group,HI44a group,IgG2a control group and ATRA control group detecded by fluorescence quantitative PCR
与 HL-60组比较,HI44a组GM-CSFRα mRNA表达上调4.63倍,ATRA组GM-CSFRα mRNA表达上调3.48倍,IgG2a组GM-CSFRα mRNA表达上调2.09倍,结果见Fig 6。
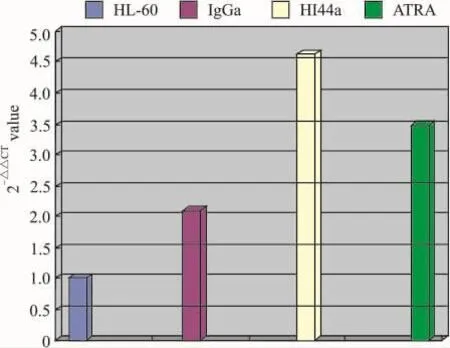
Fig 6 Expression of GM-CSFRα mRNA in HL-60 group,HI44a group,IgG2a control group and ATRA control group detecded by fluorescence quantitative PCR
2.3 OPN基因序列分析结果DNA序列分析OPN存在3种分子量大小不同的异构体,与基因库比对,分别为 isoform A、isoform B、isoform C。isoform A为314个氨基酸组成的蛋白质,isoform B为300个氨基酸组成的蛋白质,isoform C为287个氨基酸组成的蛋白质。各组测序结果见Tab 3。

Tab 3 The composition of three osteopontin isoforms studied by full-length cDNA of osteopontin sequence analysis
2.4 实验组与对照组细胞培养基中的OPN水平比较HI44a组OPN水平明显低于HL-60组及IgG2a组,结果见Tab 4。

Tab 4 The level of osteopontin
3 讨论
急性白血病是造血干细胞的恶性克隆疾病,目前西医多采用化疗、骨髓移植等方法来治疗,雷公藤[1]、肉苁蓉[2]、大蒜素[3]等传统中药提取物抗白血病的研究也取得一定成果,现在更多的学者把目光转向了分子靶向治疗。CD44作为白血病干细胞的标志之一,对急性髓系白血病干细胞的增殖和迁移等起重要的调节作用。在急性髓系白血病细胞上,主要表达 CD44s及 CD44v3-v10,其中以表达CD446v为主,急性髓系白血病患者CD44-6v的高表达提示其预后欠佳[4],故CD44-6v可能有助于促进急性髓系白血病幼稚细胞的形成[5]。另外,对急性髓系白血病病人的研究还发现,骨髓中骨桥蛋白的含量远高于正常人,而且其含量越高,预后越差[6]。
据报道,CD44抗体A3D8-H90或透明质酸能够逆转M1-M5各亚型的AML细胞及细胞系的分化阻滞,Song等[7]还发现另一种抗CD44抗体HI44a能够有效的诱导白血病细胞分化及凋亡。本实验中发现经CD44抗体HI44a处理的HL-60细胞形态发生改变,表现为细胞核变小,核质比例变大;粒系分化的指标CD15表达增强,说明HI44a能够诱导HL-60细胞向粒系分化成熟。我们的结论与Song等的结论相符。
CD44V可以特异性的结合骨桥蛋白(OPN)[8-10],介导 T 细胞、骨髓细胞的趋化和黏附作用[8,10-11],抗 CD44 抗体可以削减 OPN 与 IL-3 对小鼠骨髓细胞的增殖作用[11]。OPN-CD44的相互作用在GM-CSF所介导的抗凋亡的信号转导通路中发挥重要作用,当信号分子GM-CSF通过信号转导促使编码OPN的基因表达,产生OPN,与细胞表面的受体CD44分子作用后通过信号转导网络传递GM-CSF的抗凋亡信号[12],研究者还发现在肿瘤细胞增殖过程中,OPN的表达逐渐增高,这与其抗凋亡的作用相符,因此,研究者致力于从OPN基因转录的调控因子中寻找特异靶点而阻断其抗凋亡信号的转导[5]。本实验中发现,HI44a处理的HL-60细胞,增殖受抑,且渐向较成熟阶段细胞分化,OPN表达下调,TGF-β1、GM-CSFRα 表达上调,推测 HI44a结合CD44分子后,阻断了OPN-CD44所参与的信号通路中抗凋亡信号的转导,使得抗凋亡信号转导通路的信号分子OPN表达降低,而促凋亡的造血因子TGF-β1及促分化的信号分子GM-CSFRα表达增高,可能通过此相关途径引发细胞的分化及凋亡,但确切机制需要进一步研究。
[1] 俞萍丽,陈元仲,许建华,等.雷公藤内酯醇体内外对HL-60细胞的研究[J].中国药理学通报,2007,23(10):1346 -8.
[1] Yu P L,Chen Y Z,Xu J H,et al.Effects of trip to lide on HL-60 cell in vitro and in vivo[J].Chin Phamacol Bull,2007,23(10):1346-8.
[2] 木合布力·阿布力孜,毛新民,热娜·卡斯,等.木肉苁蓉总苷在HL260细胞中的抗氧化生物活性研究[J].中国药理学通报,2008,24(3):362 -4.
[2] Mourboul ABL ISE,Mao X M,Rena Kasimu,et al.Antioxidantp roperty of general cistanosides in human HL260 cell line[J].Chin Pharmacol Bull,2008,24(3):362 -4.
[3] 郑燕华,林求诚,吕联煌,等.大蒜素对白血病细胞增殖和凋亡的影响[J].中国药理学通报,2009,25(6):790 -3.
[3] Zheng Y H,Lin Q C,Lü L H,et al.Inhibitory effects of allicin on HL-60 cell proliferation and its induction of apoptosis[J].Chin Pharmacol Bull,2009,25(6):790 -3.
[4] Mackay C,Terpe H,Stauder R,et al.Expression and modulation of CD44 variant isoforms in humans[J].J Cell Biol,1994,124:71 -82.
[5] Bourguignon L,Zhu H,Chu A,et al.Interaction between the adhesion receptor,CD44,and the oncogene product,p185HER2,promotes human ovarian tumor cell activation[J].J Biol Chem,1997,272:27913-8.
[6] Wai P Y,Kuo P C.Osteopontin:regulation in tumor metastasis[J].Cancer Metastasis Rev,2008,27:103 -18.
[7] Song G,Liao X,Zhou L,et al.HI44a,an anti-CD44 monoclonal antibody,induces differentiation and apoptosis of human acute myeloid leukemia cells[J].Leuk Res,2004,28:1089 - 96.
[8] Ashkar S,Weber G,Panoutsakopoulou V,et al.Eta-1(osteopontin):an early component of type-1(cell-mediated)immunity[J].Science,2000,287:860 -4.
[9] Weber G,Ashkar S,Glimcher M,et al.Receptor-ligand interaction between CD44 and osteopontin(Eta-1)[J].Science,1996,271:509-12.
[10] Asosingh K,Günthert U,Bakkus M,et al.In vivo induction of insulin-like growth factor-I receptor and CD44v6 confers homing and adhesion to murine multiple myeloma cells[J].Cancer Res,2000,60:3096-104.
[11] Lin Y H,Huang C J,Chao J R,et al.Coupling of osteopontin and its cell surface receptor CD44 to the cell survival response elicited by interleukin-3 or granulocyte-macrophage colony-stimulating factor[J].Molecul Cell Biol,2000,20:2734 -42.
[12] Packham G,White E L,Eischen C M,et al.Selective regulation of Bcl-XL by a Jak kinase-dependent pathway is bypassed in murine hematopoietic malignancies[J].Genes Dev,1998,12:2475 -87.
