雷帕霉素对缺血再灌注大鼠肾小管上皮细胞凋亡的抑制作用
2011-02-21郑传东胡兴平
郑传东,苟 欣,胡兴平,张 力,邓 林
(1.四川省成都市第五人民医院泌尿外科 611130;2.重庆医科大学附属第一医院泌尿外科 400016)
雷帕霉素(rapamycin,RPM)又名西罗莫司是20世纪70年代初,由加拿大Ayerst研究所从放线菌培养液中分离出来的大环内酯类抗生素。近年来研究证明它是一种强有力的免疫抑制剂,其免疫作用较环孢素A强100倍左右,并已广泛应用于肾移植中。肾缺血再灌注损伤是导致急性肾小管坏死和肾移植失败的重要因素。越来越多的研究表明,肾缺血再灌注损伤引起的细胞凋亡是缺血再灌注致肾损害的重要环节之一[1]。因此,抑制细胞凋亡的发生对肾缺血再灌注损伤的防治具有重要的临床意义。有资料表明RPM能抑制细胞凋亡的发生。Fas和Bcl-2(B-cell lymphoma-2)是重要的凋亡相关基因[1]。本研究通过复制大鼠肾缺血再灌注损伤模型,研究RPM对大鼠缺血再灌注肾Fas、Bcl-2蛋白表达的影响以及对再灌注24h的肾组织超微结构的影响,探讨RPM对肾缺血再灌注的保护作用及其机制。
1 材料与方法
1.1 主要试验药物与试剂 RPM由中国华北制药集团新药研究开发有限责任公司提供,批准文号:2002HL0259,口服液,规格1mg/mL。兔多抗Fas由北京博奥森生物技术有限公司提供,兔多抗Bcl-2、即用型SABC法免疫组化试剂盒SA1022、二氨基联苯胺(DAB)显色液均由武汉博士德生物工程有限公司提供。
1.2 试验动物与分组 54只Wistar雄性大鼠,体质量200~250g,由重庆医科大学实验动物中心提供。随机分成假手术组(sham)、手术组(IR)和药物组(RPM+IR)。手术组和药物组又按缺血再灌注时间分为再灌注后0、24、48、72h等4个观察时间点,每个观察时间点6只。
1.3 动物模型的建立与用药 参照以往方法建立肾缺血再灌注损伤模型[2-3],10%水合氯醛(3mL/kg)腹腔注射,麻醉后作腹部正中切口,切除右侧肾,分离左肾动脉,保护好输尿管,靠近肾门处用无创动脉夹夹闭肾动脉。肾脏颜色发白即可确认肾脏血流阻断。假手术组分离左肾动脉后不阻断血流,进行两次开腹,其间隔时间约45min。假手术组、手术组于术前灌胃给予等量生理盐水,以做阴性对照。药物组于术前灌胃给药RPM 3d,剂量为4mg·kg-1·d-1,并于术前2h灌胃,术后给药至各个观察时间点。腹腔内保留林格液20mL/kg,关闭腹腔。缺血45min后,再次打开腹腔,显露肾脏,松开动脉夹,肾脏由苍白变为红润可确认肾脏血流恢复,缝合切口。分别再灌注0、24、48、72h,即为本试验的肾缺血再灌注损伤模型。
1.4 HE染色的组织学检查 取上述动物模型肾组织,用4%多聚甲醛固定,石蜡包埋,切成3μ m厚的切片,HE染色,用普通光镜观察各组肾脏组织病理学变化情况。
1.5 再灌注24h的肾组织超微结构观察 取再灌注24h大鼠左肾迅速固定于2.5%戊二醛磷酸缓冲液中备用,送重庆医科大学电镜室行透射电镜(EM,日立H-7500)检查,观察肾组织超微结构的变化。
1.6 免疫组化检测Fas和 Bcl-2的表达 取上述石蜡切片,常规脱蜡至水。严格按SABC法免疫组化试剂盒操作,每张切片随机采集10个无重叠高倍视野(×400),输入医学图像分析系统进行图像处理。检测Fas、Bcl-2表达的平均光密度值,并计数阳性细胞数及细胞总数,计算阳性表达率。阳性表达率(positive index,PI)=阳性细胞数/视野所有细胞总数× 100%,所有视野均在同一光强度下检测。
1.7 统计学处理 采用SPSS13.00统计软件进行分析,数据均以±s表示,多组间均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 大鼠肾缺血再灌注后各组肾组织形态学改变 肉眼见:手术组肾皮质、髓质严重淤血、水肿;药物组髓质可见轻度淤血和水肿;假手术组未见异常。光镜下:手术组随再灌注时间的延长,肾组织发生不同的病理改变。0h:肾小球和肾小管均未见明显病变。24h:肾小管轮廓清晰,大片肾小管上皮细胞肿胀呈空泡样,坏死脱落明显,基底膜仅剩轮廓,肾小管中可见大量死亡脱落细胞残留物质。48h:肾小管开始出现修复现象,肾小管中残留物减少。72h:大部分肾小管结构已基本恢复,管腔内容物基本清除。光镜下,药物组各个时间点病变较手术组明显减轻,肾小管上皮细胞肿胀呈空泡样、颗粒样变性轻微,无明显坏死,间质无明显异常(图1、2)。假手术组肾组织结构正常。各组染色后肾小球均未见明显的病理改变。

图1 手术组再灌注后24h时肾组织形态学改变(HE×400)
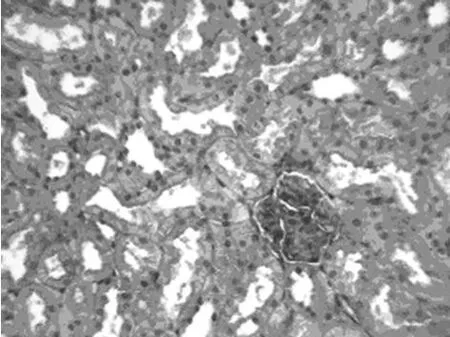
图2 药物组再灌注后24h时肾组织形态学改变(HE×400)
2.2 肾缺血再灌注24h的肾组织超微结构变化 假手术组:肾小管上皮细胞超微结构基本正常。手术组:近曲小管管腔被大量坏死脱落的上皮细胞、线粒体等细胞碎片堵塞,近曲小管上皮细胞胞浆内脂滴堆积。药物组:肾小管近曲小管管腔内有少许细胞脱落物质,上皮细胞整体正常,细胞胞浆内线粒体正常,无明显肿胀,仅有少许深色的溶酶体轻度肿胀(图3、4)。
2.3 肾缺血再灌注后各时间点肾组织Fas和Bcl-2的表达
2.3.1 RPM对Fas蛋白表达的影响 Fas阳性细胞细胞质呈棕黄色,细胞核无着色。阳性表达位于肾小管上皮细胞,肾皮质处最明显,肾小球未见表达(图5、6)。假手术组只有少数细胞呈阴性表达;手术组与假手术组比较,Fas表达明显增强,阳性细胞数明显增加(P<0.05);药物组与手术组比较,Fas表达强度显著减弱,阳性细胞数显著减少(P<0.05),见表1。
表1 3组不同时间点Bc1-2、Fas蛋白阳性表达率比较±s,%,n=6)
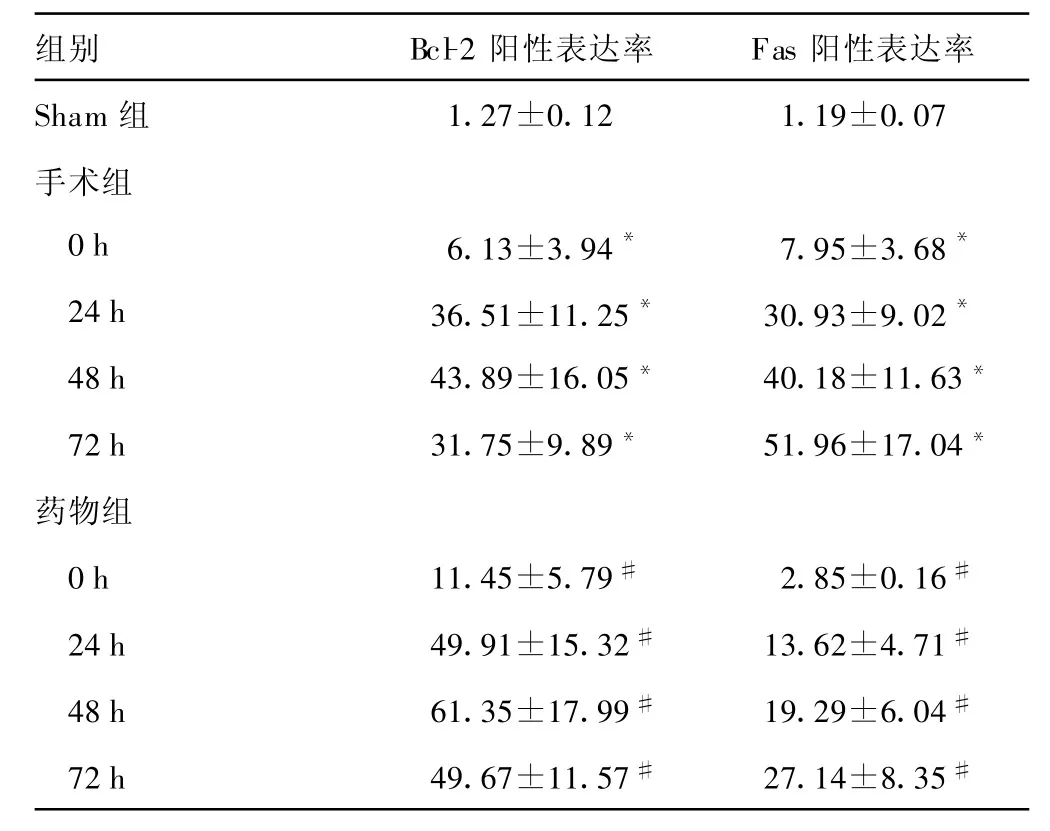
表1 3组不同时间点Bc1-2、Fas蛋白阳性表达率比较±s,%,n=6)
*:P<0.05,与假手术组比较;#:P<0.05,与相应时间点手术组比较。
组别 Bcl-2阳性表达率 Fas阳性表达率Sham组 1.27±0.12 1.19±0.07手术组0h 6.13±3.94* 7.95±3.68*24h 36.51±11.25* 30.93±9.02*48h 43.89±16.05* 40.18±11.63*72h 31.75±9.89* 51.96±17.04*药物组0h 11.45±5.79# 2.85±0.16#24h 49.91±15.32# 13.62±4.71#48h 61.35±17.99# 19.29±6.04#72h 49.67±11.57# 27.14±8.35#

图3 手术组再灌注后24h时肾组织超微结构变化(EM×5000)
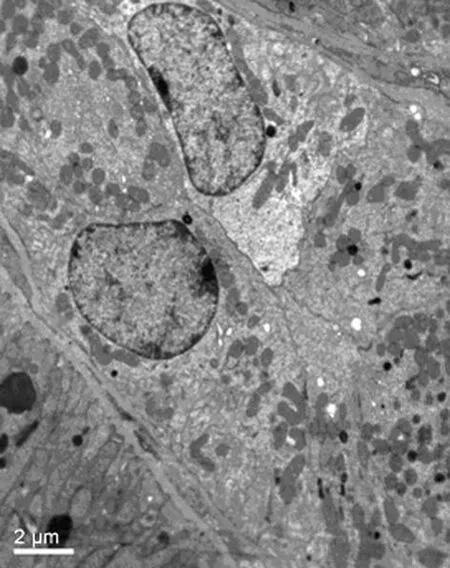
图4 药物组再灌注后24h时肾组织超微结构变化(EM×5000)
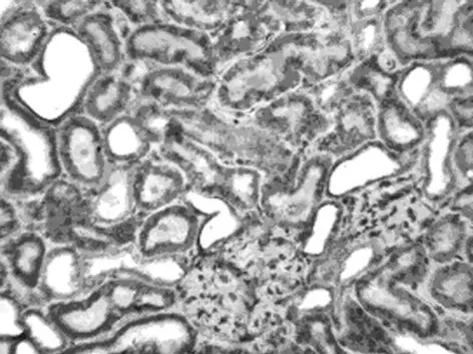
图5 手术组再灌注后72h时Fas在肾组织的表达(SABC×400)
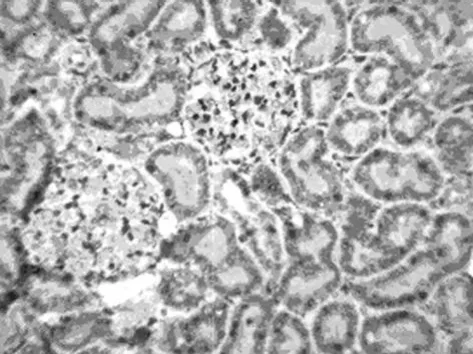
图6 药物组再灌注后72h时Fas在肾组织的表达(SABC×400)
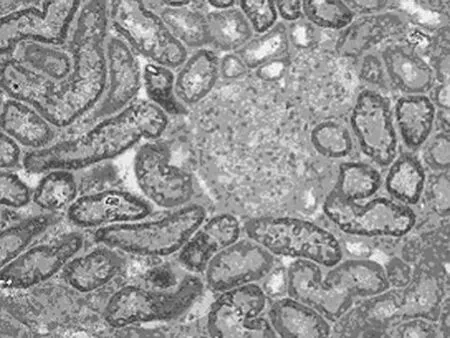
图7 手术组再灌注后48h时Bcl-2在肾组织的表达(SABC×400)
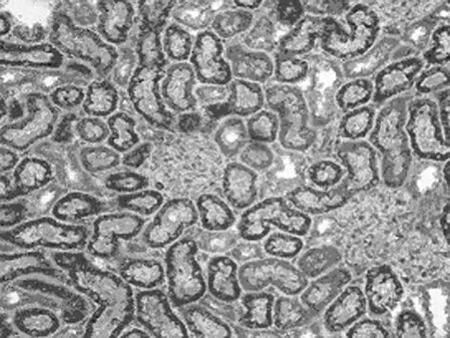
图8 药物组再灌注后48h时Bcl-2在肾组织的表达(SABC×400)
2.3.2 RPM对Bcl-2蛋白表达的影响 Bcl-2阳性细胞细胞质呈棕黄色,细胞核无着色。阳性表达位于肾小管上皮细胞,肾皮质处最明显,肾小球未见表达(图7、8)。假手术组只有少数细胞弱阳性表达;手术组与假手术组比较,Bcl-2表达增强,阳性细胞数增加(P<0.05);药物组与手术组比较,Bcl-2表达显著增强,阳性细胞数显著增加(P<0.05),见表1。
3 讨论
大量动物实验发现,肾脏缺血再灌注损伤导致了肾小管上皮细胞凋亡[4],对移植后的尸体肾活检,同样发现了肾小管上皮细胞凋亡[5]。肾小管细胞培养模型的研究进一步证实了动物实验和异体移植肾的研究结果,使培养的肾小管细胞的ATP部分缺失或处于缺氧培养环境,模拟肾脏缺血性损伤,可见肾小管细胞凋亡增加,同时细胞坏死也更严重。
3.1 Fas参与肾缺血再灌注损伤 细胞凋亡的触发因素有自然状态下的程序性死亡和病理状态下的生存信号丢失、DNA损伤、受体介导等。受体介导途径中,Fas/FasL系统最具代表性[6]。Fas为Ⅰ型跨膜糖蛋白,属于神经生长因子受体(NGFR)/肿瘤坏死因子受体(TNFR)超家族成员。Fas细胞外部分可与抗Fas单克隆抗体或Fas配体(FasL)特异性结合,经死亡域传导死亡信号,可促发一系列细胞内事件,导致细胞凋亡[7]。Fas及FasL是诱发肾脏多种细胞发生凋亡的蛋白。以往认为,FasL只存在于免疫系统淋巴细胞表面,目前发现,肾小管上皮细胞有FasL表达,说明在肾脏细胞中存在Fas/FasL系统[8]。本实验结果显示,药物组与手术组比较,Fas表达强度明显减弱(P<0.05),提示RPM具有抑制Fas表达的作用,可抑制细胞凋亡。
3.2 Bcl-2参与肾缺血再灌注损伤 Bcl-2是研究最早抗凋亡基因之一,在缺血再灌注损伤中表现得尤为突出[9]。Bcl-2抗细胞凋亡的作用机制可能与以下几方面有关:(1)抑制Ca2+的释放;(2)Bcl-2通过阻止促细胞凋亡基因信号传递或阻止这些诱导基因产物发挥作用;(3)抑制细胞色素C的释放,产生细胞内抗氧化作用;(4)Bcl-2抗Fas凋亡的特性[10]。本实验结果显示,药物组与手术组比较,Bcl-2表达明显增强(P<0.05),提示RPM具有促进Bcl-2表达的作用,可抑制细胞凋亡。
3.3 RPM肾脏保护作用的可能机制 RPM分子式为C51H79NO13,其相对分子质量为914.2,在结构上与另一种免疫抑制药FK506极为相似,二者均属大环内酯类,但RPM具有与FK506不同的作用机制。FK506为与环孢素(CsA)作用机制相似的钙调神经素抑制剂(CNI)类免疫抑制剂,而RPM为具有不同作用机制的增殖信号抑制剂(Proliferation signal inhibitors,PSI)类免疫抑制剂[11]。有研究发现RPM 可能通过非直接通路使激活的T细胞凋亡,阻止了树突状细胞(DC)的抗原呈递,并抑制其成熟,减少细胞因子的分泌[12-13]。阻止DC在肾组织迁移聚集,可以明显减轻大鼠缺血再灌注肾组织的病理损伤及改善肾功能[14]。RPM不仅局限于对免疫系统的细胞产生作用,它亦能抑制平滑肌细胞、内皮细胞和成纤维细胞等增殖[15]。
RPM对大鼠急性肾缺血再灌注损伤保护作用的确切机制还不清楚。其作用机制可能是:(1)通过抑制 T细胞、T细胞依赖性B细胞、树突状细胞的活性,减少细胞因子的分泌,抑制炎症,减少自由基的生成;(2)抑制平滑肌细胞、内皮细胞和成纤维细胞等增殖,改善肾脏微循环;(3)从抑制细胞凋亡等多种途径减轻肾组织损伤。RPM已经广泛应用于临床器官移植中抗急、慢性排斥反应,预防心血管内再狭窄,以及抗肿瘤、抗病毒等。本实验结果表明,RPM也对大鼠缺血再灌注肾有明确的保护作用。RPM可能通过下调Fas、上调Bcl-2蛋白表达水平而减轻肾缺血再灌注损伤,该药物是探索临床预防和减轻肾缺血再灌注损伤的有效方法之一。
[1]吴其夏,余应年,卢建.病理生理学[M].2版.北京:中国协和医科大学出版社,2003:271.
[2]李开龙,何娅妮,王惠明,等.甘草酸18a体对缺血再灌注损伤后肾小管上皮细胞p21蛋白表达的影响[J].重庆医学,2008,37(22):2550-2552.
[3]于新路,王禾,张波,等.大鼠实验性肾缺血再灌注引起肾小管上皮细胞凋亡及其与Bcl-2、Fas/Fas-L表达变化的关系[J].第四军医大学学报,2003,24(8):723-726.
[4]Chien CT,Lee PH,Chen CF,et al.De novo demonstration and co-localization of free-radical production and apoptosis in rat kidney subjected to ischemia-reperfusion[J].J Am Soc Nephrol,2001,12(5):973-982.
[5]Castaneda MP,Swiatecka-Urban A,Mitsnefes MM,et al. Activation of mitochondrial apoptotic pathways in human renal allografts following ischemia[J].Transplantation,2003,76(1):50-54.
[6]梁堵禾,靳凤烁,江军,等.大鼠急性肾功能衰竭时肾小管上皮细胞 Fas、Fas-L表达的意义[J].创伤外科杂志,2003,5(2):118-121.
[7]Yoneyama K,Goto T,Miura K,et al.The expression of Fas and Fas ligand,and the effects of interferon in chronic liver diseases with hepatitis C virus[J].Hepatol Res,2002,24(4):327-337.
[8]成秀梅,常风云,段彦苍,等.愈肾合剂对糖尿病肾病大鼠肾脏细胞凋亡及Fas、Fas-L表达的影响[J].中国老年学杂志,2006,26(12):1643-1645.
[9]Meier P,Finch A,Evan G.Apoptosis in development[J]. Nature,2000,407(8051):796-801.
[10]蒋黎,李俊刚,兰林,等.鼠特异性Fas抗体对人鼠嵌合肝中人肝细胞增殖的促进作用[J].重庆医学,2009,38(19):1734-1740.
[11]Lehmkuhl H,Ross H,Eisen H,et al.Everolimus(certican)in heart transplantation:optimizing renal function through minimizing cyclosporine exposure[J].Transplant Proc,2005,37(10):4145-4149.
[12]Hackstein H,Taner T,Logar AJL,et al.Rapamycin inhibits macropinocytosis and mannose receptor-mediated endocytosis by bone marrow-derived dendritic cells[J]. Blood,2002,100(3):1084-1087.
[13]Monti P,M ercalli A,Leone BE,et al.Rapamycin impairs antigen uptake of human dendritic cells[J].Transplantation,2003,75(1):137-145.
[14]周同,孙桂芝,张玉梅,等.黏附分子与树突状细胞在大鼠肝和肾缺血-再灌注损伤中作用及抗黏附干预的影响[J].中国微循环,2004,8(5):342-343.
[15]黄赤兵,张银甫.雷帕霉素作用机制研究及在肾移植中的应用进展[J].中国药房,2006,17(7):547-549.
