甘草酸二铵对博莱霉素致肺纤维化大鼠的治疗作用
2011-02-21殷宗宝李海军陈栩栩程启慧
殷宗宝,邓 超,李 英,李海军,陈栩栩,程启慧
(海南省海口市人民医院重症医学科 570208)
细胞因子网络在特发性肺纤维化(IPF)的发生中发挥重要作用,这些细胞因子能影响疾病过程中纤维化的进程,一些细胞因子在调节及维持肺纤维化过程中具有决定性作用[1]。甘草酸二铵具有较强的非特异性的抗炎作用,其抗炎作用与皮质醇类似,可减少肝细胞的水肿、坏死,同时甘草酸二铵调节内源性类固醇水平,而无盐皮质激素样不良反应[2]。本实验根据甘草酸二铵这一药理作用探讨其对肺纤维化的治疗作用及对细胞因子的影响,以期为临床防治肺纤维化奠定良好的实验基础。
1 材料与方法
1.1 试剂 甘草酸二铵为江苏正大天晴药业股份有限公司产品,国药准字H10940191,生产批号2000011504;注射用盐酸博莱霉素为日本化药株式会社产品,进口许可证号X20000349;地塞米松磷酸钠注射液为西南药业股份有限公司产品,国药准字H50021463,生产批号2000020604;浓缩型兔抗大鼠转化生长因子β1(TGF-β1)抗体和γ干扰素(IFN-γ)抗体为Santa Cruz公司产品;即用型SABC试剂盒(兔IgG)和DAB显色试剂盒为北京中杉金桥生物技术有限公司产品;大鼠TGF-β1、白细胞介素4(IL-4)和IFN-γELISA试剂盒为美国Rapid Bio公司产品。
1.2 动物来源及分组 健康清洁级雄性大鼠40只(5周龄),合格证号:SCXK0020158,体质量(180±20)g,由温州医学院实验动物中心提供;随机分为对照组、博莱霉素致肺纤维化组(模型组)、地塞米松治疗组(DXM组)和甘草酸二铵治疗组(甘草酸二铵组)共4组,每组10只,常规喂养。
1.3 造模方法 参照文献[3]的方法,对大鼠气道内滴注博莱霉素致肺纤维化模型的方法略作改进。对照组以等量的生理盐水代替博莱霉素气管内滴注。甘草酸二铵组和DXM组于造模后第28天开始,分别给已制成的肺纤维化动物模型连续14d腹腔内注射甘草酸二铵150mg·kg-1·d-1和地塞米松注射液3mg·kg-1·d-1(浓度5mg/mL),第43天全部处死。
1.4 标本采集 大鼠血清采集:2%戊巴比妥钠腹腔内注射麻醉,仰卧位开腹腔,取腹主动脉近心端断端全血6~8mL,室温静置2h后,3000r/min离心15min,取上层血清保存-70℃冰箱中备用。取大鼠左肺下叶和右肺下叶1cm×1cm×l cm大小的组织,固定于10%甲醛溶液中,分别用于免疫组化检测和病理组织学观察。
1.5 检测指标及方法
1.5.1 普通病理观察 肺组织常规HE染色。肺组织切片肺泡炎按Khalin等[4]标准判断。-:无肺纤维化;+:轻度肺纤维化,受累面积少于全肺20%;++:中度肺纤维化,受累面积占20%~50%;+++:重度肺纤维化,受累面积大于50%,肺泡结构紊乱。
1.5.2 肺免疫组化检测 IFN-γ、TGF-β1检测按免疫组化试剂盒(SABC法)说明书进行。TGF-β1在博莱霉素致肺纤维化大鼠肺组织中的不同部位表达情况定量分析,据IHC染色程度分为4级:不显色为阴性(-);显色稍深于背景,浅棕色为弱阳性(+);显色部位与背景明显区别,棕色为阳性(++);显色部位深度着色,深棕色为强阳性(+++)。肺组织TGF-β1的IHC表达结果用SPOT及IPP图像采集分析系统处理,40× 10视野下观察采集图像,用Image-Pro Plus6.0版专业图像分析软件处理结果,以累积光密度值(IOD)表示TGF-β1表达的相对强度,每张切片选5个免疫反应较强视野进行分析。IFN-γ在博莱霉素致肺纤维化大鼠肺组织中的不同部位表达情况定量分析方法与TGF-β1的定量分析方法相同。
1.5.3 大鼠血清TGF-β1、IL-4、IFN-γ的测定 采用双抗体夹心ELISA法,按试剂盒说明书进行。
1.6 统计学处理 资料采用SPSS11.0统计软件进行分析,计量资料以±s表示,组间比较采用多组间的方差分析(F检验),如差异有统计学意义,再进行组间两两比较,用LSD-t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 肺组织病理变化 普通病理观察:对照组未出现明显的病理变化(封3图1)。模型组肺泡壁增厚,肺纤维化程度重,肺泡结构破坏,肺泡腔消失(封3图2)。甘草酸二铵组肺泡腔内残留少量炎性细胞,肺组织结构比较完整,无肺纤维化形成(封3图3)。DXM组肺组织病理变化基本同甘草酸二铵组。对照组大鼠几乎无肺泡炎及肺纤维化发生。模型组造模后第43天肺纤维化广泛形成;甘草酸二铵组和DXM组比模型组大鼠肺纤维化发生率低,且程度轻,见表1。

表1 各组大鼠肺纤维化分级
2.2 肺组织TGF-β1和IFN-γ的表达 对照组只有较大血管、支气管壁的平滑肌细胞TGF-β1呈中度阳性反应,其余细胞均为弱阳性反应。模型组病变区有少许炎症细胞,肺泡间质中TGF-β1阳性反应的成纤维细胞、肌纤维母细胞等间质细胞明显,阳性反应增强,并可见沉积的细胞外间质呈片块状、粗条索状阳性着色(封3图4);甘草酸二铵组和DXM组TGF-β1阳性反应细胞较少,基本为弱阳性反应(封3图5)。模型组细胞间质IFN-γ阳性反应较弱,而甘草酸二铵组和DXM组IFN-γ阳性反应较强(封3图6),见表2。
表2 肺内间质TGF-β1和IFN-γ的定量表达(IOD±s)

表2 肺内间质TGF-β1和IFN-γ的定量表达(IOD±s)
●:P<0.01,与模型组比较;★:P<0.05,与DXM组比较。
组别 TGF-β1 IFN-γ对照组 13.47±6.86● 11.99±6.92●模型组 18.07±5.81 9.42±3.67DXM组 10.50±5.15● 13.85±7.48●甘草酸二铵组 13.60±5.90●★ 14.49±5.79●F 11.24 3.45P 0.000 0.018
2.3 大鼠血清TGF-β1、IL-4和IFN-γ含量 各组大鼠血清标本TGF-β1、IL-4和IFN-γ含量见表3。模型组大鼠血清IL-4和TGF-β1含量高于其他组,DXM组与甘草酸二铵组血清TGF-β1含量相比,差异无统计学意义(P=0.169)。DXM组、甘草酸二铵组血清IL-4含量两两相比差异也无统计学意义(P>0.05)。甘草酸二铵组血清IFN-γ含量最高,但与DXM组相比差异无统计学意义(P=0.389),两组与模型组相比差异有统计学意义,P值分别为0.000、0.001。
表3 各组大鼠血清TGF-β1、IL-4和IFN-γ含量±s,pg/mL,n=10)
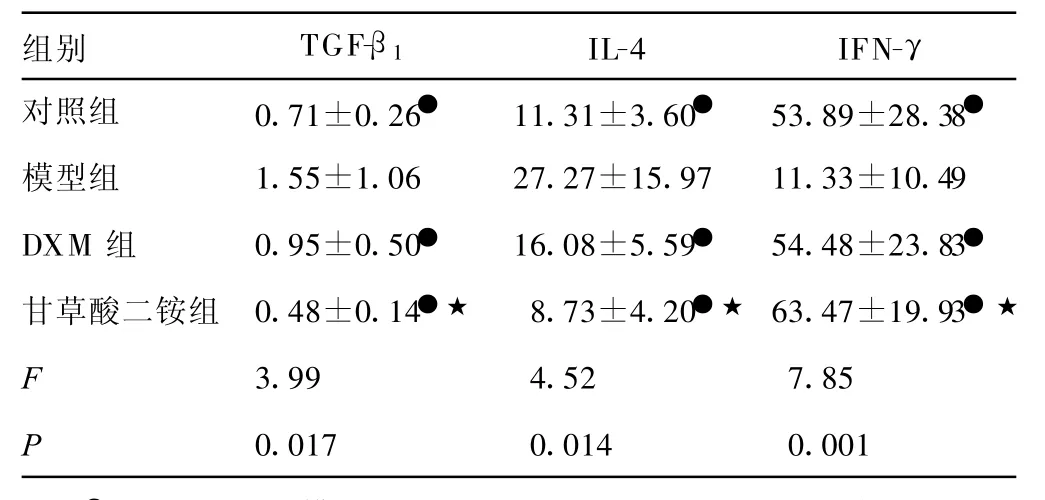
表3 各组大鼠血清TGF-β1、IL-4和IFN-γ含量±s,pg/mL,n=10)
●:P<0.01,与模型组比较;★:P>0.05,与DXM组比较。
组别 TGF-β1 IL-4 IFN-γ对照组 0.71±0.26● 11.31±3.60● 53.89±28.38●模型组 1.55±1.06 27.27±15.97 11.33±10.49DXM组 0.95±0.50● 16.08±5.59● 54.48±23.83●甘草酸二铵组 0.48±0.14●★ 8.73±4.20●★ 63.47±19.93●★F 3.99 4.52 7.85P 0.017 0.014 0.001
3 讨论
TGF-β1是一种调节细胞活动的多功能调节肽,在纤维化大鼠肺内主要由肺泡巨噬细胞分泌,它能够从周围组织中募集成纤维细胞并能刺激未成熟成纤维细胞增生和分化[4-5]。还能刺激成纤维细胞大量合成胶原蛋白Ⅰ、Ⅲ、Ⅳ型,尤其是Ⅳ型胶原蛋白,以增加肺间质的胶原成分,同时还可抑制胶原蛋白酶及纤溶酶原激活物的合成,增加蛋白酶抑制物的形成,以减少肺间质细胞外基质的降解,造成细胞外基质调控失衡,引起肺纤维化。
IL-4一方面激活 T淋巴细胞分化为 Th2并促使其产生IL-4、IL-5,这些细胞因子再次作用于T淋巴细胞,并抑制Th1细胞形成和分泌IL-2、IFN-γ和TNF-β等细胞因子;另一方面诱导成纤维细胞合成胶原,刺激细胞外基质蛋白的表达,调节细胞的增殖和分化,并在调节炎性反应和细胞介导的免疫应答方面发挥重要作用[6]。
IFN-γ可抑制Th0细胞向 Th2细胞转化,同时抑制 Th2细胞合成和分泌细胞因子如IL-4、IL-5等,削弱IL-4使成纤维细胞活化为具有纤维化活性的肌成纤维细胞这一效应,从而拮抗其致纤维化活性。它对细胞外基质蛋白,如胶原、纤维连接蛋白等的生成也有显著的抑制作用。有实验证明IFN-γ可以下调小鼠巨噬细胞中TGF-β1的过度表达,从而下调前胶原的表达,使间质中胶原积聚减少[7]。因此,细胞因子网络能影响IPF疾病过程中成纤维细胞的活化、增殖及胶原的沉积[3]。
甘草酸二铵是从药用植物甘草根、茎中提取的一种有效的活性成分,具有抗炎、免疫调节、抗氧化、影响内源性类固醇激素和保护细胞膜结构等广泛的药理学作用[8]。有研究表明甘草酸二铵可以抑制活化的巨噬细胞分泌炎性因子,如IL-4、TGF-β1等[9];还可以抑制嗜酸性粒细胞活化趋化因子的分泌,而嗜酸性粒细胞活化趋化因子可以募集嗜酸性粒细胞并促进其分泌其他的炎症因子,如IL-4、IL-5、TGF-β1等[10]。本实验结果显示,甘草酸二铵组大鼠HE染色显示细胞基膜完好,成纤维细胞的增生及间质胶原纤维的沉积范围及程度显著小于模型组;免疫组化检测表明肺组织内TGF-β1阳性反应细胞较少,基本为弱阳性反应,强度和范围显著小于模型组,这与叶进燕等[2]报道类似;而IFN-γ阳性反应细胞较多,较模型组表达明显。甘草酸二铵组大鼠血清中TGF-β1、IL-4含量明显较模型组低,而IFN-γ则相反。因此本实验结果表明甘草酸二铵可以促进大鼠肺组织分泌IFN-γ,抑制IL-4、TGF-β1的生成,具有较强的抗肺纤维化作用。虽然甘草酸二铵组与DXM组相比在以上因子的表达方面差异无统计学意义,但甘草酸二铵无盐皮质激素样不良反应。
[1]Lukacs NW,Hogaboam C,Chensue SW,et al.Type l/type 2cytokine paradigm and the progression of pulmonary fibrosis[J].Chest,2007,120(1Suppl):S5-8.
[2]叶进燕,陈少贤,徐红蕾,等.甘草甜素对大鼠肺纤维化的治疗作用及对转化生长因子表达的影响[J].中华结核和呼吸杂志,2006,9(29):636-637.
[3]Luppi F,Cerri S,Beghe B,et al.Corticosteoid and immunomodulatory agents in idiopathic pulmonary fibrosis[J]. Res Pir M ed,2004,98(11):1035-1044.
[4]Khalin N,Berezay O,Sporn M,et al.Macrophage production of transforming growth factor β1and collagen synthesis in chronic pulmonary inflammation[J].J Exp Med,2005,170(3):723-737.
[5]Denis M,Ghadirian E.Transforming growth factor-β generated in the course of hypersensitivity pneumonitis:contribution to collagen sythesis[J].Am J Respir Cell Biol,2004,7(2):156-160.
[6]Paul WE.Interleukin-4:a prototypic immunoregulatorylymphokine[J].Blood,2001,77(9):1859-1870.
[7]Eickelberg O,Pansky A,Koehler E,et al.M olecularmechanisms of TGF(betta)antagonism by interferon-γand cycloporine A in lung fibrosis[J].Chest,2001,15(3):797-806.
[8]丁旭春,王新华,王真.复方甘草甜素治疗博莱霉素致肺纤维化大鼠的研究[J].现代中西医结合杂志,2008,17(27):4237-4238.
[9]Kato T,Horie N,Hashimoto K,et al.Bimodal effect of glycyrrhizin on macrophage nitric oxide and prostaglandin E2production[J].In Vivo,2008,22(5):583-586.
[10]Javaprakasam B,Duddaqa S,Wang R,et al.Licorice flavonoids inhibit evtaxin-1secretion by human fetal lung fibroblasts in vitro[J].J Aqric Food Chem,2009,57(3): 820-825.
