神经生长因子介导神经源性气道炎症机制探讨*
2011-02-21佘巍巍曾锦荣王昌明蔡双启
佘巍巍,曾锦荣,王昌明,蔡双启
(1.桂林医学院附属医院呼吸内科,广西541001;2.广西医科大学附属医院呼吸内科,南宁531001)
支气管哮喘与细胞信号传导的研究一直备受国内外学者的普遍关注,有必要从基因水平研究神经生长因子(NGF)调控免疫细胞因子表达的机制。NGF不仅是神经系统营养因子[1],由于其能够高效地调控炎症细胞因子的作用而受到国内外学者的关注。肿瘤坏死因子-α(TNF-α)是一种具有广泛生物学活性的前炎症细胞因子,TNF-α能诱导血管内皮细胞表达黏附分子,促进炎症细胞的浸润与活化,刺激血小板活化因子、白三烯等炎症介质的合成,从而导致气道高反应性。本研究拟通过建立大鼠哮喘模型来研究NGF与TNF-α的关系及各自在哮喘气道炎症中的作用,并探讨其可能的机制。
1 材料与方法
1.1 实验动物 8周龄清洁级雌性SD大鼠30只,按随机数字表法将大鼠随机分为正常对照组(A组)、哮喘组(B组)、NGF干预组(C组),每组10只。
1.2 哮喘模型的建立及抗NGF干预 A组:致敏过程以磷酸盐缓冲液(PBS)代替卵清蛋白(OVA)注射,激发过程以盐水雾化吸入,相关参数与B组相同;B组哮喘模型的构建方法于实验第1天、第14天致敏,即OVA 20μ g由1mg氢氧化铝乳化后,腹腔注射200μ L。第21~27天,将大鼠置于密闭容器内,以超声雾化器雾化3%OVA盐水气溶胶并对其进行吸入激发,每天1次,每次30min。C组哮喘模型建立同B组,但于每次激发前3h,先经鼻滴入抗大鼠β-NGF抗体(稀释1∶50)50μ L,每日1次,连续7d。各组大鼠均于末次激发后24h处死,取组织标本进行相关检测。并通过肺功能检测、HE染色观察肺组织病理变化、BALF炎症细胞计数等多方面来证实模型的成功建立。
1.3 肺组织病理标本制作[2]灌洗后经气管向右肺注入4%多聚甲醛使胸膜展平后,置4%多聚甲醛中固定,常规石蜡包埋,切片,厚度约5μ m,HE染色,显微镜下观察支气管、肺组织病理特征。
1.4 免疫组织化学 石蜡切片经常规处理后,滴加正常山羊血清室温封闭20min,然后按亲和素-生物素-过氧化物酶复合物(ABC)法进行免疫组织化学反应。阴性对照组用PBS代替上述抗体。
1.5 原位分子杂交 石蜡切片经常规处理后,按经典方法进行原位分子杂交。阴性对照用PBS代替上述抗体。用原位分子杂交比较3组TNF-α水平,RT-PCR半定量法测定大鼠肺组织NGF mRNA表达,Western-blot法检测3组NGF蛋白水平变化。
1.6 结果判定 观察NGF、TNF-α及 NGF mRNA、TNF-α mRNA在肺组织的表达,并用显微图像分析系统测定8个视野的阳性系数和灰度值。阳性系数的计算参照文献[1]的方法。NGF、TNF-α及其NGF mRNA、TNF-αmRNA阳性细胞均以胞质着色为主,阳性颗粒呈棕褐色或棕黄色。
2 结果
2.1 NGF蛋白及NGF mRNA的表达 B组大鼠肺组织及其周围可见大量的NGF蛋白及NGF mRNA阳性细胞,而C组则明显减少,A组大鼠仅见少量阳性细胞,见封2图1。B组大鼠肺组织NGF蛋白、NGF mRNA的平均灰度值(待测物质灰度值越高,表明其在细胞中表达的量越低,反之,灰度值越低表明其在细胞中表达的量越高)分别为145±7、128±7;A组分别为189±7、191±6;C组分别为156±6、139±8,3组比较差异有统计学意义(t=19.50、P<0.01;t=15.90、P<0.01;t= 14.89、P<0.01);各组大鼠肺组织NGF蛋白平均阳性系数B组大于A组,且C组小于B组,3组比较差异有统计学意义(t =1.29、P<0.01;t=3.85、P<0.01;t=2.19、P<0.01);其NGFmRNA平均阳性系数为B组小于A组,且C组大于B组,3组比较差异有统计学意义(t=1.24、P<0.01;t=3.65、P<0.01;t=2.14、P<0.01),见封2图2。其阳性产物平均灰度值,见表1。
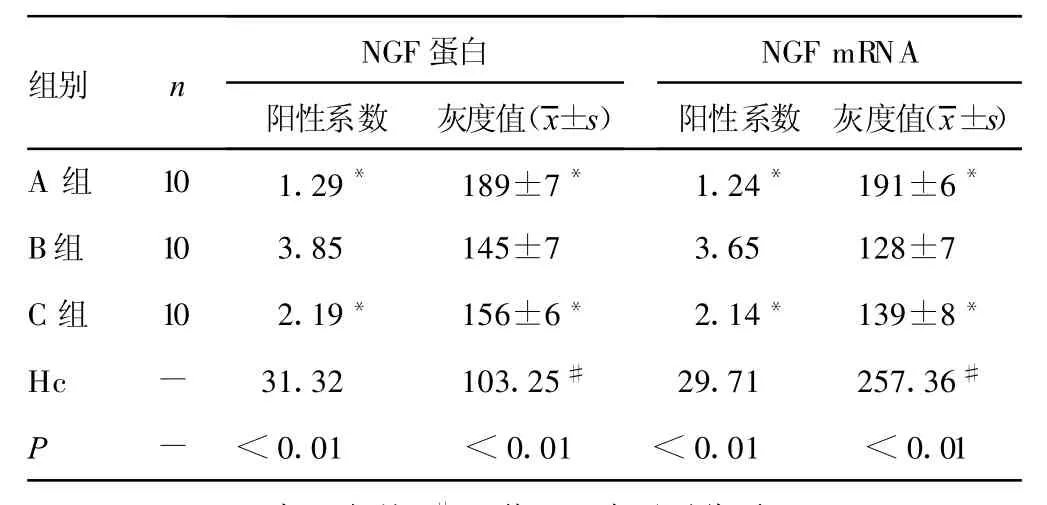
表1 各组大鼠肺组织NGF蛋白及NGF mRNA平均阳性系数(平均秩)及平均灰度值比较
2.2 TNF-α蛋白及TNF-αmRNA的表达 B组大鼠TNF-α蛋白及TNF-αmRNA的灰度值分别为141±7、127±7;A组分别为175±8、179±9;C组分别为164±8、155±6;3组比较差异有统计学意义(t=28.40、P<0.01;t=22.22、P<0.01)。各组大鼠肺组织中TNF-α蛋白平均阳性系数为B组大于A组,且C组小于B组,3组比较差异有统计学意义(t=1.61、P<0.01;t=3.80、P<0.01;t=2.35、P<0.01);其TNF-αmRNA平均灰度值为B组大于A组,且C组小于B组,3组比较差异有统计学意义(t=1.47、P<0.01;t=3.81、P<0.01;t= 2.19、P<0.01),见表2。B、C组血清TNF-α水平明显高于A组(P<0.05);C组血清TNF-α水平低于B组(P<0.05)。见封2图3。
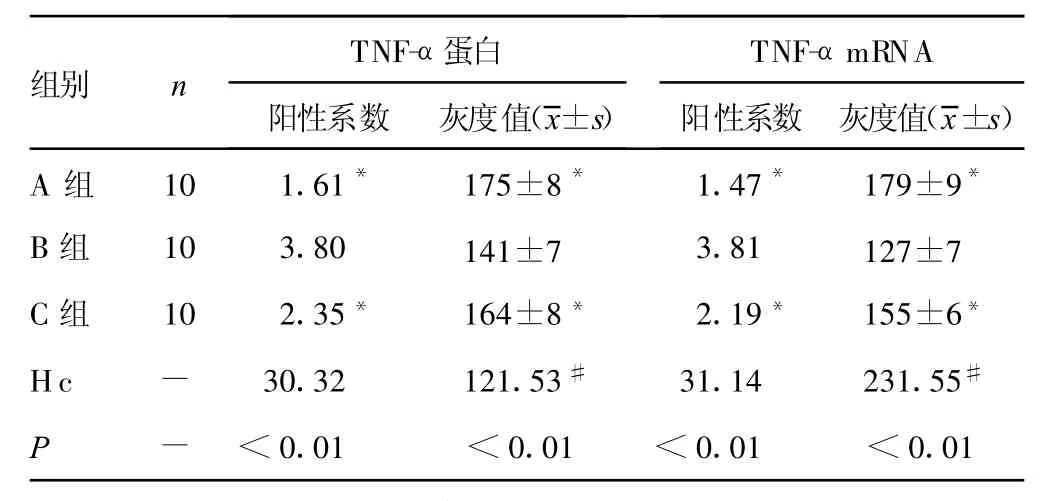
表2 各组大鼠肺组织TNF-α蛋白及TNF-αmRNA平均阳性系数(平均秩)及平均灰度值比较
3 讨论
支气管哮喘是一种气道炎症性疾病,其炎症发生与调控气道的神经系统之间存在复杂的相互作用。气道神经激活和气道上皮的相互作用在其中起着重要作用[3]。已有研究表明,支配气道的感觉神经及其相关营养因子可能与气道炎症的形成密切相关,并提出了气道神经源性炎症学说[4-5]。众多的实验证明哮喘状态下NGF及其受体表达升高[6-7],在哮喘患者血清和支气管肺泡灌洗液中NGF的水平明显升高[8],同时,国内外有许多资料均已证实TNF-α对气道炎症具有促进作用[9-10]。哮喘组大鼠血清、TNF-α浓度较正常对照组增高,通过趋化激活中性粒细胞等炎性细胞共同参与气道炎症的形成,在气道炎症的持续和放大中起到重要作用,说明其在气道炎症发病中具有重要意义。在炎症情况下,TNF-α和NGF相互之间有何影响?正是本实验要探讨的症结所在。本实验测定了哮喘大鼠肺组织TNF-αmRNA的表达,并观察了拮抗NGF作用后哮喘大鼠TNF-α表达的变化。发现哮喘大鼠肺组织TNF-αmRNA的表达及血清 TNF-α水平均较正常对照组增高,而应用了抗NGF抗体拮抗了NGF作用后TNF-α表达水平下降。由此,可判断哮喘大鼠炎症发作可能是由于肺组织TNF-αmRNA表达增加,TNF-α生成增多所致。阻断内源性NGF可降低哮喘大鼠肺组织TNF-αmRNA的表达,提示NGF可能通过调节TNF-α的表达参与哮喘发病。NGF可能通过增进肺组织TNF-αmRNA的表达作为参与哮喘的发病机制之一。本实验结果显示,与正常大鼠比较,哮喘大鼠肺组织(主要为免疫炎性细胞和气道结构细胞)中NGF蛋白及NGF mRNA表达显著增加,说明哮喘状态下NGF增高主要是由于支气管、肺组织细胞合成增加所致,同时还发现,拮抗NGF生物活性则能够有效抑制TNF-α的合成和分泌。从本研究结果可推测,哮喘气道神经源性炎症发病机制中可能存在一个循环作用链:气道上皮、支气管、肺组织炎性细胞(嗜酸性粒细胞等)合成NGF增加,合成的NGF刺激细胞合成TNF-α增多,TNF-α再作用于气道效应细胞(上皮细胞、平滑肌细胞等)而触发气道神经源性炎性反应,反过来,炎性反应又可以显著上调肺组织NGF的表达,从而形成恶性循环,拮抗NGF生物活性则能够有效抑制TNF-α的合成和分泌,达到减轻哮喘气道高反应等病理生理改变的目的。在国外研究中,Silvestri等[11]报道哮喘发作期患者TNF-α水平明显高于缓解期及对照组患者,而且哮喘病情越严重,持续时间越长,血清 TNF-α浓度越高;反之,病情越轻,持续时间越短,血清TNF-α浓度越低。Bonini等[12]在其研究中发现,哮喘患者血清NGF水平增高,且过敏性哮喘患者血清NGF水平比非过敏性哮喘患者高。对过敏性哮喘小鼠进行抗NGF处理,可明显减轻哮喘引起的气道高反应性。
综上所述,NGF可以通过调节合成和分泌TNF-α表达参与哮喘神经源性炎性反应而在哮喘气道炎症中发挥作用;同时抗NGF干预可下调TNF-αmRNA表达和蛋白分泌水平,减轻哮喘气道炎症,参与哮喘的整个病理生理过程,从而有利于对于哮喘气道炎症的控制,因而能为哮喘防治提供新的思路。
[1]曹霞,何素蓉,刘艳.神经生长因子治疗新生儿缺氧缺血性脑病的临床疗效观察[J].重庆医学,2008,37(20): 2323-2324.
[2]Feltis BN,Wignarajah D,Reid DW,et al.Effects of inhaled fluticasone on angiogenesis and vascular endothelial growth factor in asthma[J].Thorax,2007,62(4):314-319.
[3]刘春丽,赖克方,钟南山.气道神经源性炎症与慢性咳嗽的发病机制[J].国外医学呼吸系统分册,2004,24(4): 237-242.
[4]Barnes PJ.Non-adrenergic non-cholinergic neurol control of human airways[J].Arch Int Pharmacodynother,1986,280Suppl 2:208-228.
[5]Casale TB.Neuropeptides and the lung[J].J Allergy Clin Immunol,1991,88(1):1-14.
[6]Lindsay RM,Harmar AJ.Nerve growth factor regulates expression of neuropeptide genes in adult sensory neurons [J].Nature,1989,337(6205):362-364.
[7]AlaMR.Chemokines in allergic inflammation[J].J Allergy Clin Immunol,1997,99(3):273-277.
[8]Grifflmhs CEM,Voothees JJ,Nickoloff BJ.Characterization of intercellular adhesion molecular-l and HLA-DR expression in normal and inflamed skin:modulation recombinant interferon and tumor necrosis factor[J].J Am Acad Dermatol,1989,20(4):617-629.
[9]Ulich TR,Howard SC,Remick DG,et al.Intratracheal administration of endotoxin and cytokines.VI.Antisetum to CINC inhibits acute inflammation[J].Am J Physiol,1995,268(2Pt 1):L245-250.
[10]刘晓湘,曹德寿,闫军浩,等.NGF对哮喘豚鼠下呼吸道及内脏感觉传入部位 TNF-αmRNA表达的上调作用[J].解剖学报,2004,35(3):225-229.
[11]Silvestri M,Bontempelli M,Giacomelli M,et al.High serum levels of tumour necrosis factor-alpha and interleukin-8in severe asthma:markers of systemic inflammation[J]. Clin Exp Allergy,2006,36(11):1373-1381.
[12]Bonini S,Lambiase A,Angelucci F,et al.Circulating nerve growth factor levels are increased in humans with allergic diseases and asthma[J].Proc Natl Acad Sci USA,1996,93(20):10955-10960.
