甘蔗锌指蛋白基因ShSAP1的克隆与表达模式
2011-02-10李晓君蔡文伟张树珍许莉萍陈萍王俊刚
李晓君,蔡文伟,张树珍,许莉萍,陈萍,王俊刚
1 中国热带农业科学院 热带生物技术研究所甘蔗研究中心,海口 571101
2 福建农林大学 农业部甘蔗遗传改良重点开放实验室,福州 350002
3 海南大学农学院,儋州 571737
在动物中,具有A20/AN1锌指结构域的蛋白已被广泛研究,该类蛋白作为免疫性炎症和细胞凋亡的负调因子,在免疫应答中具有重要的调控作用[1-3]。植物中,具有 A20/AN1锌指结构域的蛋白与逆境应答密切相关,研究者将其定义为 SAP (Stress associated protein) 家族[4-6]。研究发现,水稻所有SAP家族成员的表达能被干旱、高盐和冷冻中的一种或多种胁迫诱导增强[6]。对番茄进行冷冻、热激、盐胁迫、干旱、机械伤害、ABA、氧胁迫和细胞膜伤害处理,利用real-time PCR分析其13个SAP家族成员在进行处理前后的表达模式发现,所有SAP成员都与一种或多种逆境应答相关[7]。
甘蔗Saccharum officinarum是一种重要的糖料作物,也是重要的能源作物。非生物胁迫,尤其是高盐与干旱,是全球作物减产的主要原因[8]。2010年中国南方干旱造成云南、广西、广东、海南等地甘蔗大规模减产。研究甘蔗自身的抗逆基因功能,对研究甘蔗的抗逆机制及抗逆分子育种具有重要意义。本研究于甘蔗热带种Badila茎秆成熟与未成熟抑制差减文库中筛选到一个具有完整阅读框的EST,其推导蛋白具有A20/AN1锌指结构域,通过Smart Race法获得了基因全长,命名为 ShSAP1 (Saccharum stress-associated protein 1)。通过甘蔗基因组DNA扩增ShSAP1基因以确定基因内是否具有内含子,并通过Southern blotting分析了ShSAP1在Badila内的拷贝数,从而对ShSAP1基因结构进行分析;通过半定量 RT-PCR对 ShSAP1基因在甘蔗Badila不同部位、不同茎节及高盐胁迫、模拟干旱、脱落酸 (ABA)、赤霉素 (GA3)、乙烯利 (ET) 处理下的mRNA表达量进行了分析,以期对ShSAP1在甘蔗成熟与逆境应答中的功能进行初步探讨。
1 材料与方法
1.1 实验材料
甘蔗热带种拔地拉 (Badila),为本实验室基地种植。
1.2 主要试剂
RNA plant kit、DNA消化酶购自Biomega公司;反转录试剂盒购自Fermentas;Southern blotting试剂盒为Roche公司的DIG DNA Labeling and Detection KitⅠ;Taq DNA聚合酶、PMD18-Vector及限制性核酸内切酶购自TaKaRa公司;氨苄青霉素 (Amp)、琼脂糖购自Sigma公司;琼脂糖凝胶回收试剂盒、质粒提取试剂盒购自Biomega公司;大肠杆菌DH5α感受态购自天根生物;ABA、ET、GA3购自上海生工;常用的化学试剂为国产分析纯。本研究所用引物均由上海生工生物工程有限公司合成,引物序列见表1。
1.3 表达分析材料及处理方法
甘蔗不同部位表达分析材料:Badila成熟植株。不同胁迫和激素处理组的表达分析材料:四叶期甘蔗无菌组培苗,MS培养基培养。24 h处理组:高盐胁迫和模拟干旱处理,将幼苗接入中含有200 mmol/L NaCl,10% (W/V) PEG6000的MS培养基中;激素处理,分别用100 µmol/L ABA,200 mg/L GA3,1 mmol/L ET喷施幼苗叶片;CK不做任何处理,处理后将幼苗于人工培养箱中光照培养,16 h光照28 ℃/8 h黑暗24 ℃,24 h后提取叶片RNA。激素时间梯度处理组:选取大小一致的幼苗,用100 µmol/L ABA、200 mg/L GA3、1 mmol/L ET进行喷施处理,处理时间分别为3 h、6 h、12 h,处理开始于12 h处理组,同时对CK喷施同体积的无菌水,隔6 h进行第2批处理,隔9 h进行第3批处理,处理期间全程光照培养,12 h后同时提取叶片RNA。
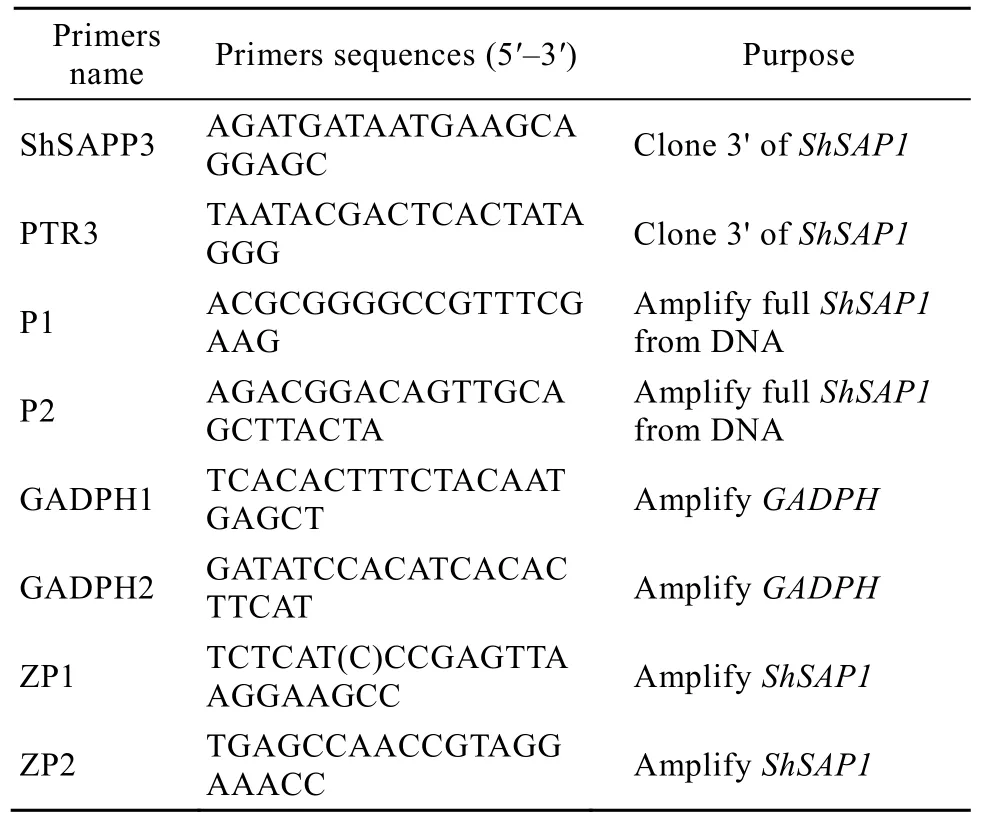
表1 本研究所用引物Table 1 Primers used in this study
1.4 核酸提取及反转录
RNA提取参照Biomega RNA Plant kit说明书,取5 µg RNA按照Fermentas反转录试剂盒说明书进行反转录,DNA提取依照CTAB法。
1.5 ShSAP1的克隆
由本实验室茎秆成熟相关 cDNA文库中获得ShSAP1的EST序列 (716 bp),具有完整的ORF,经同源序列的分析比对确定 5'端完整,以获得的ShSAP1 5'端设计引物ShSAPP3,全长cDNA文库噬菌体臂上的序列设计引物 PTR3,以本实验室全长cDNA文库库液为模板扩增ShSAP1 3'端cDNA序列。 PCR反应条件为94 ℃ 5 min ;94 ℃ 30 s,59 ℃45 s,72 ℃ 1 min,4个循环;94 ℃ 30 s,57 ℃ 45 s,72 ℃ 1 min ,8个循环;94 ℃ 30 s,55 ℃ 45 s,72 ℃ 1 min,25个循环;72 ℃ 10 min 。
1.6 ShSAP1基因组全长的获得及ShSAP1的拷贝数确定
于ShSAP1拼接序列5′末端和3′末端设计引物P1和P2,以Badila cDNA及DNA为模板进行PCR扩增,PCR反应条件:94 ℃ 5 min ;94 ℃ 30 s,57 ℃1 min,72 ℃ 2 min,30个循环;72 ℃ 10 min。以ShSAP1 cDNA 全序列为模板,依照 DIG DNA Labeling and Detection Kit Ⅰ合成探针,DNA提取如前介绍,DNA酶切电泳和转膜方法参照文献[9],杂交及显色参照 Roche DIG DNA Labeling and Detection Kit Ⅰ试剂盒说明书进行。
1.7 半定量RT-PCR分析ShSAP1的表达模式
半定量RT-PCR反应中的内参基因GAPDH引物为GADPH1和GADPH2,ShSAP1的扩增引物:ZP1和ZP2。先用内参基因GADPH将模板调整至基本一致,选取平台期之前的循环作为半定量RT-PCR的循环数,内参基因和目的基因的PCR反应条件均为94 ℃ 5 min;94 ℃ 30 s,50 ℃ 40 s,72 ℃ 1 min,X个循环;72 ℃ 10 min 。X表示循环数,不同部位和24 h处理组的为27个循环,12 h处理组中ABA小组为27个循环,ET和GA3小组为30个循环。每组PCR重复3次。
1.8 生物信息学分析
ShSAP1氨基酸序列经 NCBI PSI-BLAST (Position-specific iterated BLAST),选择有研究报道的相近序列进行同源性分析,使用 DNAMAN和MEGA4进行 A20/AN1结构域比较和系统发育树构建。
2 结果与分析
2.1 甘蔗ShSAP1基因的的克隆
以本实验室全长 cDNA文库库液为模板,用ShSAP-P3和 PTR3两条引物采用降落 PCR扩增ShSAP1的3′端,得到900 bp左右的条带,结果如图1所示,经测序,该片段核苷酸序列长度为872 bp,含有25个PolyA尾,将3'端获得序列与差减文库中得到的5'端716 bp序列进行拼接,得到cDNA全长1 008 bp,命名为 ShSAP1,GenBank登录号为:HM991960,ShSAP1基因起始密码子 ATG位于127 bp处,终止密码TAG位于642 bp处,阅读框为516 bp,推导171个氨基酸,具有A20/AN1锌指结构域。

图1 Smart Race PCR扩增ShSAP1 3′序列Fig. 1 Amplification of the 3′ sequence of ShSAP1 gene by Smart Race PCR. M: DNA maker DL2000; 1: 3′ PCR products of ShSAP1.
2.2 ShSAP1与其他植物SAP家族基因的锌指结构域比较与系统进化分析
SAP蛋白家族具有A20/AN1锌指结构域特征,A20结构位于蛋白的N端,具有Cys2/Cys2锌指结构,首次发现于人类血管内皮细胞中的一个 TNFα-诱导蛋白中[10],Linnen等在爪蟾的受精卵动物半球母系来源RNA编码蛋白中首次鉴定AN1锌指结构域[11],经典的 AN1结构模式为 CX(2)CX(9-12) CX(1-2)CX(4)CX(2)HX(5)HXC,X为任意氨基酸,后来的研究中把CX(4)CX(9-12)CX(1-2)CX(4)CX(2) HX(5)HXC也定义为AN1锌指。AN1和A20结构都参与了免疫反应,AN1与A20锌指常常相互连接[1,12]。OSiSAP1是植物中首次发现同时具有 AN1和A20锌指结构域的蛋白,研究表明OSiSAP1与逆境应答相关,并能增强转化烟草的抗逆性[13],随后水稻、拟南芥和番茄等植物的A20/AN1锌指蛋白也被研究,结果发现A20/AN1锌指蛋白与植物的逆境应答相关[6-7]。
ShSAP1编码蛋白 N端具有一个 Cys2/Cys2锌指,位于14~40个氨基酸之间,C端112~149氨基酸序列间具有AN1锌指结构域,其锌指序列模式为CX(2)CX(10)CX(1)CX(4)CX(2)HX(5)HXC,具有相同结构的蛋白往往行使相似的功能,为此,我们将甘蔗的ShSAP1同目前研究较清楚的其他植物SAP家族基因进行了氨基酸序列比较及同源进化树分析,结果见图2。ShSAP1具有SAP家族基因的保守锌指结构,与甘蔗的Sc-zf和水稻的OSiSAP8亲缘关系最近。ShSAP1推导氨基酸序列与刘金仙等[14]于福农22中分离得到的甘蔗锌指蛋白基因Sc-zf氨基酸序列基本一致,而两端非编码区核酸序列却有明显差异,经 DNAMAN分析ShSAP1与Sc-zf的cDNA序列相似性为81.57%,推测ShSAP1与Sc-zf为同源基因。
2.3 ShSAP1基因结构
以引物P1、P2从Badila cDNA与基因组DNA中扩增ShSAP1,以验证拼接结果的正确性,并分析ShSAP1的基因结构。由cDNA扩增得到1 000 bp左右的片段 (图3A),而从基因组DNA中可以扩增得到2 300 bp左右的片段 (图3B),片段测序结果经分析后发现由 cDNA扩增得到的序列与之前的拼接结果吻合,由基因组DNA扩增片段的大小为2 241 bp,为ShSAP1的基因组序列,经GSDS网站(http://gsds.cbi.pku.edu.cn/) 分析发现 ShSAP1有两段大小分别为 202 bp和 1 052 bp的内含子位于5'UTR区,而其阅读框则是连续的 (图3C)。为了确定ShSAP1的拷贝数,我们以ShSAP1的cDNA序列合成探针对 Badila基因组进行了 Southern blotting分析,结果如图3D所示,ShSAP1的拷贝数为1~2个,为低拷贝基因。
2.4 ShSAP1的表达分析

图2 ShSAP1推导蛋白与其他A20/AN1型锌指蛋白的氨基酸序列比较及系统发育树分析Fig. 2 Comparison of ShSAP1 A20 and AN1 zinc finger domain with other zinc-finger protein and phylogenetic tree analysis. Conserved cysteine and histidine are indicated in box. (A) Putative functional domains of ShSAP1. (B) N-terminal A20 type zinc-finger. (C) C-terminal AN1-type zinc-finger. (D) phylogenetic tree of the related zinc finger proteins. proteins used in this analysis have been studied and have A20 and AN1 zinc finger domains. Protein accession number are showed in the bracket.
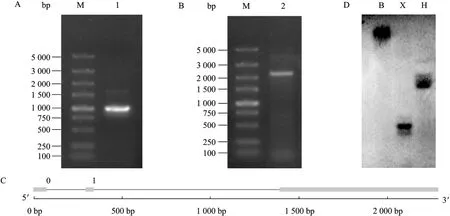
图3 ShSAP1的基因结构 (A、B、C) 与甘蔗基因组Southern blotting分析Fig. 3 Gene structure (A, B, C) and genome Southern blotting (D) of ShSAP1. (A) M: DL5000 DNA marker; 1: PCR product of ShSAP1 from cDNA. (B) M: DL5000 DNA maker; 2: PCR product of ShSAP1 from genomic DNA. (C) Two introns (indicated by line ) located in the 5′ UTR region of ShSAP1 (http://gsds.cbi.pku.edu.cn/). (D) Results of genome Southern blotting. Total genomic DNA was digested by Hind III (H), Xba I (X), BamH I (B).
刘金仙等对甘蔗Funong 22中克隆得到的Sc-zf进行了表达分析,发现 Sc-zf在黑穗病菌 Ustilago scitaminea、水杨酸 (SA)、H2O2、NaCl和 PEG 胁迫下表达特性不同,受到黑穗病菌和NaCl的诱导,PEG的抑制,但也受SA和H2O2的影响[14],这与前人所做的SAP家族基因在逆境下的表达特性存在差异。ShSAP1由甘蔗Badila成熟与未成熟茎秆抑制差减文库中筛选而出,为了分析ShSAP1与Badila成熟的关系,我们选取Badila成熟植株不同部位和不同茎节进行了表达分析,结果如图4-A所示,ShSAP1在Badila叶片、茎及根部均有表达,随着茎秆成熟度增加,ShSAP1的表达量也随之升高。甘蔗3~4节为快速生长部位,同时有少量蔗糖的积累,7~8节为正在成熟的茎节,13~14节为成熟茎节,糖分趋于饱和,21~22茎节的糖分已经饱和[15],甘蔗在成熟过程中,糖分不断累积,渗透物质不断增加,抗逆性不断增强,我们推测ShSAP1基因与甘蔗的成熟和糖分累积存在一定的关系。
在无菌条件下对Badila组培苗进行不同激素、干旱及盐胁迫下ShSAP1的表达分析发现,Badila幼苗ShSAP1的表达能被ABA、ET、GA3、模拟干旱及盐胁迫诱导增强 (图 4B)。在 ABA、ET和 GA3处理下,ShSAP1的表达水平随着处理时间延长持续增加,12 h内基本达到较高水平 (图4C)。ET和GA3是植物成熟和茎节伸长的2种重要激素,ShSAP1可能与甘蔗成熟与茎节生长有关。根据ShSAP1在模拟干旱、盐胁迫及ABA处理下的表达模式,我们推测ShSAP1可能参与了甘蔗依赖于ABA的早期逆境应答过程。

图4 ShSAP1的表达模式分析Fig. 4 Expression analysis of ShSAP1. GADPH was used as internal control. (A) The expression level of different part and stalks in sugarcane. (B) Expression of ShSAP1 in sugarcane seedlings under salt (200 mmol/L), drought (10% PEG6000), GA3 (200 mg/L), ABA (100 µmol/L) and ET (1 mmol/L) after 24 h treatment. (C) Changes of ShSAP1 expression level in sugarcane seedlings under ABA (100 µmol/L), ET (1 mmol/L) and GA3 (200 mg/L) treatment within 12 h.
3 讨论
A20/AN1锌指蛋白因在动物免疫应答中具有重要作用而被广泛研究,转录因子 NF-κB (Nuclear factor kappa enhancer binding protein) 在细胞凋亡、免疫和炎症反应中起着相当作用[16]。A20锌指N端具有去泛素化酶活性,C端具有泛素连接酶活性,IκB是核因子NF-κB的抑制子。A20锌指一方面通过泛素连接酶与IκB激酶IKK作用使其降解,阻止IκB磷酸化;另一方面通过去泛素化IκB-26S蛋白酶复合体,阻止IκB降解,从而抑制NF-κB的活性,降低过敏性反应及细胞凋亡[2,10-12,17]。植物中的 SAP家族,目前研究较为深入的有水稻的 OsiSAP1、ZFP177、OsiSAP8、拟南芥的 AtSAP12、獐毛的AlSAP[13,18-21],上述水稻的 SAP基因均参与了水稻逆境应答,应答模式有所差异,SAP1和SAP8与干旱和盐胁迫密切相关,在烟草和水稻中过表达OsiSAP1和 OsiSAP8能显著提高转化植株的抗盐抗旱性,OsiSAP8定位于细胞质,酵母双杂交表明OsiSAP8的 A20与自身和 AN1具有相互作用[18];ZFP177则在高温和冻害应答中起作用,亚细胞定位于细胞质,过表达ZFP177能提高转基因烟草的抗冻抗高温能力[19]。研究者推测水稻SAP家族可能通过泛素蛋白酶途径降低逆境对植物造成伤害,如通过降解细胞凋亡中的关键因子来增强植物抗逆性[18]。AtSAP12具有2个AN1结构域,在冻害和盐胁迫下表达增强,其蛋白构象能被氧化还原剂改变,研究者推测SAP12是一个氧化还原剂感应器,通过构象变化与蛋白结合,作为激活子或抑制子来调控信号传递[20]。盐土植物獐毛AlSAP的表达水平能被高盐、干旱、冷冻、高温及ABA和SA诱导增强,过表达AlSAP可提高烟草的抗旱和抗盐能力,转化植株的 ROS清除系统和渗透保护的基因表达也相对增强[21]。A20/AN1锌指蛋白可能属于植物逆境信号通路中的上游调控因子,通过抑制或激活信号传递相关蛋白进而调控下游基因表达,SAP家族基因在植物抗逆基因过程中具有很好的应用前景,但其作用的分析机制仍然需要进一步研究。
甘蔗在成熟过程中,伴随着糖分等渗透物质的不断累积,抗逆性不断增强,ShSAP1可能参与了甘蔗成熟相关如可溶性糖累积等过程。根据 ShSAP1在ET、GA3、ABA、干旱和盐胁迫的表达分析结果,我们推测 ShSAP1可能参与了 ET、GA3的信号转导,在干旱和盐胁迫下参与了早期依赖于ABA的信号转导从而调控下游基因的表达。ShSAP1在甘蔗成熟与逆境应答中的功能及其调控机制仍需要进一步的研究,包括下游调控基因网络及转基因分析等。本文对ShSAP1的基因结构及表达模式进行了分析,为ShSAP1的功能研究打下了基础。
[1] Huang J, Teng L, Li LX, et al. ZNF216 is an A20-like and IκB kinase γ-interacting inhibitor of NFκB activation. J Biol Chem, 2004, 279(16): 16847−16853.
[2] Heyninck K, Beyaert R. A20 inhibits NF-κB activation by dual ubiquitin-editing functions. Trends Biochem Sci, 2005, 30(1): 1−4.
[3] Hishiya A, Iemura S, Natsume T, et al. A novel ubiquitin-binding protein ZNF216 functioning in muscle atrophy. EMBO J, 2006, 25(3): 554−564.
[4] Jin Y, Wang M, Fu JJ, et al. Phylogenetic and expression analysis of ZnF-AN1 genes in plants. Genomics, 2007, 90(2): 265−275.
[5] Vij S, Tyagi AK. A20/AN1 zinc-finger domain-containing proteins in plants and animals represent common elements in stress response. Funct Integr Genomics, 2008, 8(3): 301−307.
[6] Vij S, Tyagi AK. Genome-wide analysis of the stress associated protein (SAP) gene family containing A20/AN1 zinc-finger(s) in rice and their phylogenetic relationship with Arabidopsis. Mol Gen Genomics, 2006, 276(6): 565−575.
[7] Solanke AU, Sharma MK, Tyagi AK, et al. Characterization and phylogenetic analysis of environmental stress-responsive SAP gene family encoding A20/AN1 zinc finger proteins in tomato. Mol Gen Genomics, 2009, 282(2): 153−164.
[8] Vinocur B, Altman A. Recent advances in engineering plant tolerance to abiotic stress: achievements and limitations. Curr Opin Biotech, 2005, 16(2): 123−132.
[9] Wang GL, Fang HJ. Plant Genetic Engineering. Beijing: Science Press, 2002.王关林, 方宏筠. 植物基因工程. 北京: 科技出版社, 2002.
[10] Opipari AW Jr, Boguski MS, Dixit VM. The A20 cDNA induced by tumor necrosis factor alpha encodes a novel type of zinc finger protein. J Biol Chem, 1990, 265(25): 14705−14708.
[11] Linnen JM, Bailey CP, Weeks DL. Two related localized mRNAs from Xenopus laevis encode ubiquitin-like fusion proteins. Gene, 1993, 128(2): 181−188.
[12] Evans PC, Ovaa H, Hamon M, et al. Zinc-finger protein A20, a regulator of inflammation and cell survival, has de-ubiquitinating activity. Biochem J, 2004, 378: 727−734.
[13] Mukhopadhyay A, Vij S, Tyagi AK. Overexpression of a zinc-finger protein gene from rice confers tolerance to cold, dehydration, and salt stress in transgenic tobacco. Proc Natl Acad Sci USA, 2004, 101(16): 6309−6314.
[14] Liu JX, Que YX, Zheng YF, et al. Molecular cloning of sugarcane zinc finger protein gene and its expression analysis. J Agri Biotechnol, 2009, 17(4): 707−712.刘金仙, 阙友雄, 郑益凤, 等. 甘蔗锌指蛋白基因的克隆和表达分析. 农业生物技术学报, 2009, 17(4): 707−712.
[15] Rae AL, Perroux JM, Grof CPL. Sucrose partitioning between vascular bundles and storage parenchyma in the sugarcane stem: a potential role for the ShSUT1 sucrose transporter. Planta, 2005, 220(6): 817−825.
[16] Chen ZJ. Ubiquitin signalling in the NF-κappaB pathway. Nat Cell Biol, 2005, 7(8): 758−765.
[17] Shembade N, Ma A, Harhaj EW. Inhibition of NF-κB signaling by A20 Through disruption of ubiquitin enzyme complexes. Science, 2010, 327(5969): 1135−1139.
[18] Kanneganti V, Gupta AK. Overexpression of OsiSAP8, a member of stress associated protein (SAP) gene family of rice confers tolerance to salt, drought and cold stress in transgenic tobacco and rice. Plant Mol Biol, 2008, 66(5): 445−462.
[19] Huang J, Wang MM, Jiang Y, et al. Expression analysis of rice A20/AN1-type zinc finger genes and characterization of ZFP177 that contributes to temperature stress tolerance. Gene, 2008, 420(2): 135−144.
[20] Ströher E, Wang XJ, Roloff N, et al. Redox-dependent regulation of the stress-induced zinc-finger protein SAP12 in Arabidopsis thaliana. Mol Plant, 2009, 2(2): 357−367.
[21] Saad RB, Zouari N, Ramdhan WB, et al. Improved drought and salt stress tolerance in transgenic tobacco overexpressing a novel A20/AN1 zinc-finger “AlSAP”gene isolated from the halophyte grass Aeluropus littoralis. Plant Mol Biol, 2009, 72(1/2): 171−190.
