细胞珠蛋白对肝星状细胞氧化损伤的保护作用
2011-02-09吕颖慧王启钊李招发刁勇许瑞安
吕颖慧,王启钊,李招发,刁勇,许瑞安
1 华侨大学分子药物学研究所,泉州 362021
2 分子药物教育部工程研究中心,泉州 362021
细胞珠蛋白 (Cytoglobin,Cygb) 是新近发现的哺乳动物中4种球蛋白 (Globin) 之一,由190个氨基酸残基组成,分子量21.4 kDa,编码基因定位于染色体17q25[1]。Cygb最初由Kawada等在大鼠肝星状细胞 (Hepatic stellate cells,HSC) 中发现,且证实不论在活体或者离体状态,Cygb蛋白与其mRNA均显著上调,故 Cygb初期仅被认为可以作为判断HSC激活和诊断肝纤维化与肝硬化的一个标记物而己[2]。我们的前期研究首次证明Cygb不仅具有预防肝纤维化的作用,还能有效实现肝纤维化的逆转,且其作用与协调肝脏中细胞间的氧化应激密切相关[3-6];最近的研究表明 Cygb在肾脏中也能发挥显著的抗纤维化作用,这种作用同样通过减小肾脏中的氧化应激实现[7],提示其抗氧化功能在对抗组织纤维化中的重要作用。本课题组早期已成功克隆cygb基因[8],并已建立成熟的体外表达纯化大量Cygb蛋白的有效方法[9-10],为进一步阐明 Cygb这一功能基因在肝纤维化、肝硬化中的抗氧化治疗作用提供了有利条件。
众所周知,肝脏中存在着机制复杂的氧化应激反应,并且在肝纤维化进程中,中心环节——肝星状细胞发生由静息态向活化态的转变。因此,探讨Cygb蛋白在肝脏氧化损伤中的具体保护作用及机制必须要考虑到上述的复杂因素。本研究采用了过氧化氢及铁过载两种不同作用机制的氧化反应模型来模拟肝脏内的实际氧化刺激环境。其中过氧化氢主要模拟在肝脏中广泛存在的 H2O2活性氧中间体;铁过载模型则主要用以触发肝脏内的脂质过氧化反应,铁与花生四烯酸的协同增效反应主要发生于酒精性脂肪肝诱发的肝纤维化进程中。这两种模型基本可以代表在肝脏中的主要氧化应激分子作用。本实验还选取了两种不同活化状态的肝星状细胞——未完全活化的原代大鼠肝星状细胞 (Rat hepatic stellate cells,rHSC) 及完全活化的人肝星状细胞系 (LX-2) 为研究对象,较全面揭示Cygb蛋白在肝纤维化中的抗氧化作用及机制,并探讨将其应用于肝纤维化抗氧化治疗中的可能性。
1 材料与方法
1.1 材料
Cygb质粒 (pCygb) 与EGFP质粒 (pEGFP) 为本实验室构建并保存;SD大鼠购自福建吴氏实验动物中心;人肝星状细胞系LX-2购自上海天呈科技有限公司;胶原酶、Nycodenz、肝素钠、花生四烯酸(AA)、次氮基三乙酸 (NTA)、硝酸铁 (Fe(NO3)3)、MTT试剂购自Sigma公司;链霉蛋白酶购自Roche公司;OPTI-MEM I及 Lipofectamine 2000购自Invitrogen公司;DMEM、DnaseⅠ及胎牛血清均购自 Hyclone公司;desmin及 α-SMA 抗体购自SantaCruz公司;兔抗CYGB抗体由Kawada博士惠赠;超氧化物阴离子荧光探针 (Dihydroethidium)购自碧云天生物技术研究所;其余生化试剂均为分析纯,购自国药集团化学试剂有限公司。
1.2 方法
1.2.1 细胞培养
rHSC分离培养采用本实验室已报道的方法[4,11],分离纯化后的细胞经台盼蓝鉴定存活率>95%, desmin及 α-SMA免疫细胞化学染色鉴定纯度>95%,可满足实验需求。rHSC培养48 h后换液,然后每2~3 d换液1次,本文中应用分离后体外培养5 d的rHSC进行实验。人肝星状细胞系LX-2培养于含20%胎牛血清的DMEM培养液。
1.2.2 Cygb蛋白制备
Cygb蛋白制备参照本实验室已成功建立的方法[9-10]。
1.2.3 H2O2作用
细胞均以1.0×108/L接种于96孔板,100 µL/孔。培养过夜后,加入终浓度为 200 µmol/L的 H2O2于 37 ℃作用 48 h,行 MTT检验。Cygb蛋白(10 mg/L,50 mg/L) 或维生素 E (VE,50 µmol/L)分别于H2O2处理前30 min或H2O2处理后30 min加入培养液中。
1.2.4 Fe-NTA/AA作用
Fe-NTA溶液配制参照文献[12]。简述如下:取5 mL 50 mmol/L Fe(NO3)3溶液与5 mL 150 mmol/L NTA溶液混合,用1 mol/L碳酸氢钠溶液调节pH值至7.4,定容至20 mL,得25 mmol/L Fe-NTA母液,现配现用。细胞均以 1.0×108/L接种于 96孔板,100 µL/孔。培养过夜后,用DMEM培养液或含有终浓度20 µmol/L AA的培养液换液,继续培养16 h后,吸除培养液并用D-hank’s缓冲液冲洗细胞以去除残留的AA,然后分别加入含终浓度为1 000 µmol/L或100 µmol/L Fe-NTA的DMEM培养液,到既定时间后进行结晶紫检测。Cygb蛋白(10 mg/L,50 mg/L)于 Fe-NTA处理前 30 min或Fe-NTA处理后30 min加入培养液中。
1.2.5 细胞毒性实验
分别用 MTT检验及结晶紫染色检测过氧化氢或铁过载对肝星状细胞的毒性作用。MTT检验中,向每孔细胞中加入10 µL (96孔板) 5 mg/mL MTT试剂,继续培养4 h,终止培养,吸弃培养液,每孔加入100 µL (96孔板) DMSO,振荡使结晶物充分溶解,于酶标仪492 nm处测OD值,以630 nm作参比波长;结晶紫染色中,细胞用10%甲醛固定30 s,1×PBS漂洗2次;加入结晶紫染液孵育10 min,1×PBS漂洗5遍,然后加入33%乙酸水溶液溶解,570 nm读数。实验中设置6个平行样,重复3次。用未经抗氧化物或氧化物处理的细胞作为对照(Control),相对增殖率 (Ralative growth rate,RGR)用以下公式计算:

1.2.6 细胞内超氧化物检测
细胞相应处理后,除去培养液,用D-Hank’s缓冲液冲洗两遍,然后加入 10 µmol/L的超氧化物阴离子荧光探针 (Dihydroethidium) 工作液,37 ℃孵育60 min,用D-Hank’s缓冲液冲洗2遍,荧光显微镜绿色激发观察。
1.2.7 RNA干扰实验
对照siRNA (NC) 及Cygb干扰RNA (si1&si2)以双链 RNA形式由上海吉玛公司合成 (每 OD siRNA中加入150 µL DEPC水,配成20 µmol/L母液,分装,−20 ℃保存备用)。采用Lipofectamine 2000转染,按照说明书操作,简述如下:在无双抗培养基中接种LX-2细胞,转染时细胞汇合度达30%~50%,用适量无血清 OPTI-MEM I培养基稀释相应 siRNA (终浓度 100 nmol/L),混匀。摇匀Lipofectamine 2000,取适量用 OPTI-MEM I稀释并轻轻混匀后室温孵育5 min。将稀释的siRNA和稀释的 Lipofectamine 2000混合,室温孵育20 min后加入细胞培养板中,37 ℃、CO2培养箱孵育48 h后提取总RNA行RT-PCR检验并用real-time PCR定量分析 (n=3);72 h后提取总蛋白进行Western blotting检验并用凝胶成像系统对条带进行分析。应用筛选得到的有效siRNA按上述方法转染48 h后分别加入相应浓度的H2O2或Fe-NTA/AA作用。设计得到的siRNA序列如表1所示。
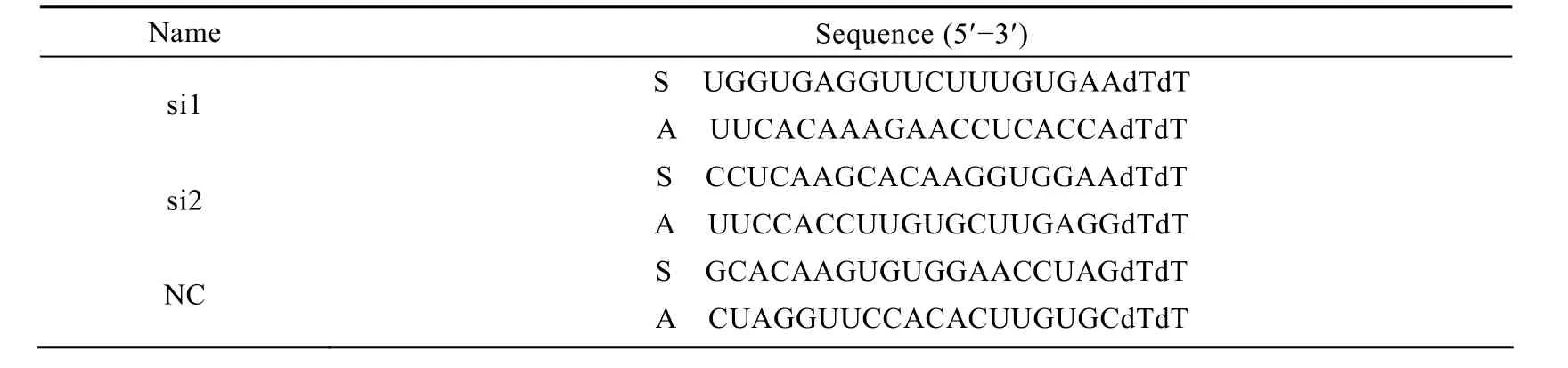
表1 设计得到的siRNA序列Table 1 Designed sequences of siRNAs
1.2.8 基因转染实验
pCygb及pEGFP分别转染LX-2细胞后48 h加入氧化刺激物,继续作用24 h进行检测。用过氧化氢刺激的细胞行MTT检测,用Fe-NTA/AA刺激的细胞行结晶紫检测。
1.2.9 数据统计
2 结果
2.1 内源性 Cygb蛋白对于氧化反应引起的肝星状细胞损伤的保护性作用
2.1.1 Cygb-siRNA筛选
用设计合成的3个siRNA序列转染LX-2细胞48 h后提取总RNA行RT-PCR、72 h后提取总蛋白行Western blotting,结果如图1所示,可见si1转染后能明显减少Cygb基因的表达,si2效果不明显,因此本实验中应用si1。
2.1.2 siRNA干扰Cygb后LX-2细胞对氧化损伤的反应
如图2所示,100 µmol/L过氧化氢作用于NC转染的 LX-2细胞 1 d未对细胞增殖产生影响,而Cygb被干扰的细胞增殖率显著降低 (P<0.01),显然Cygb被干扰使LX-2对过氧化氢的毒性更加敏感了;继续延长作用时间,过氧化氢对细胞的毒性作用也逐渐明显,且对于Cygb被干扰的细胞毒性要显著大于转染对照RNA的细胞组 (P<0.01),说明肝星状细胞内源性的 Cygb在过氧化氢造成的氧化环境中对细胞具有显著的保护性作用;同样,无论是单用 50 µmol/L Fe-NTA 作用或是 50 µmol/L Fe-NTA+20 µmol/L AA协同作用,Cygb被干扰的细胞均比转染对照siRNA的细胞更易产生损伤,证实内源性Cygb在Fe-NTA/AA造成氧化环境中对肝星状细胞同样具有显著的保护性作用。
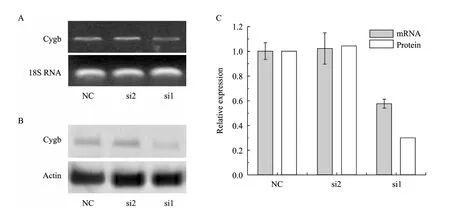
图1 Cygb-siRNA的筛选Fig. 1 Screening of Cygb-siRNA. (A) RT-PCR. (B) Western blotting. (C) Quantification of the expression of cygb mRNA and protein, respectively.
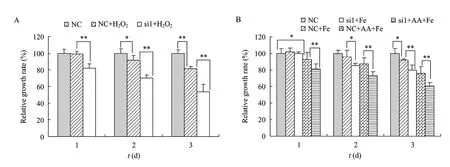
图2 siRNA干扰Cygb后氧化反应对LX-2细胞增殖的影响Fig. 2 Effects of oxidation on the proliferation of LX-2 cells transfected with siRNA targeting Cygb. (A) H2O2 treated. (B) Fe-NTA/AA treated. *P<0.05; **P<0.01.
2.2 重组 Cygb蛋白对氧化反应引起的肝星状细胞损伤的保护性作用
2.2.1 H2O2损伤
经Cygb蛋白预处理后再加入200 µmol/L H2O2作用48 h,进行MTT检测结果如图3所示。过氧化氢对rHSC及LX-2细胞均表现出明显的毒性;加入50 µmol/L VE、高浓度Cygb蛋白、低浓度Cygb蛋白预处理都能对过氧化氢造成的细胞损伤起到一定的保护作用,其中50 mg/L Cygb蛋白起到的保护作用最明显 (P<0.01),能完全抵消 200 µmol/L过氧化氢对LX-2细胞的作用 (图3B,与未经过氧化氢处理的对照组相比较P>0.05)。
2.2.2 Fe-NTA/AA损伤
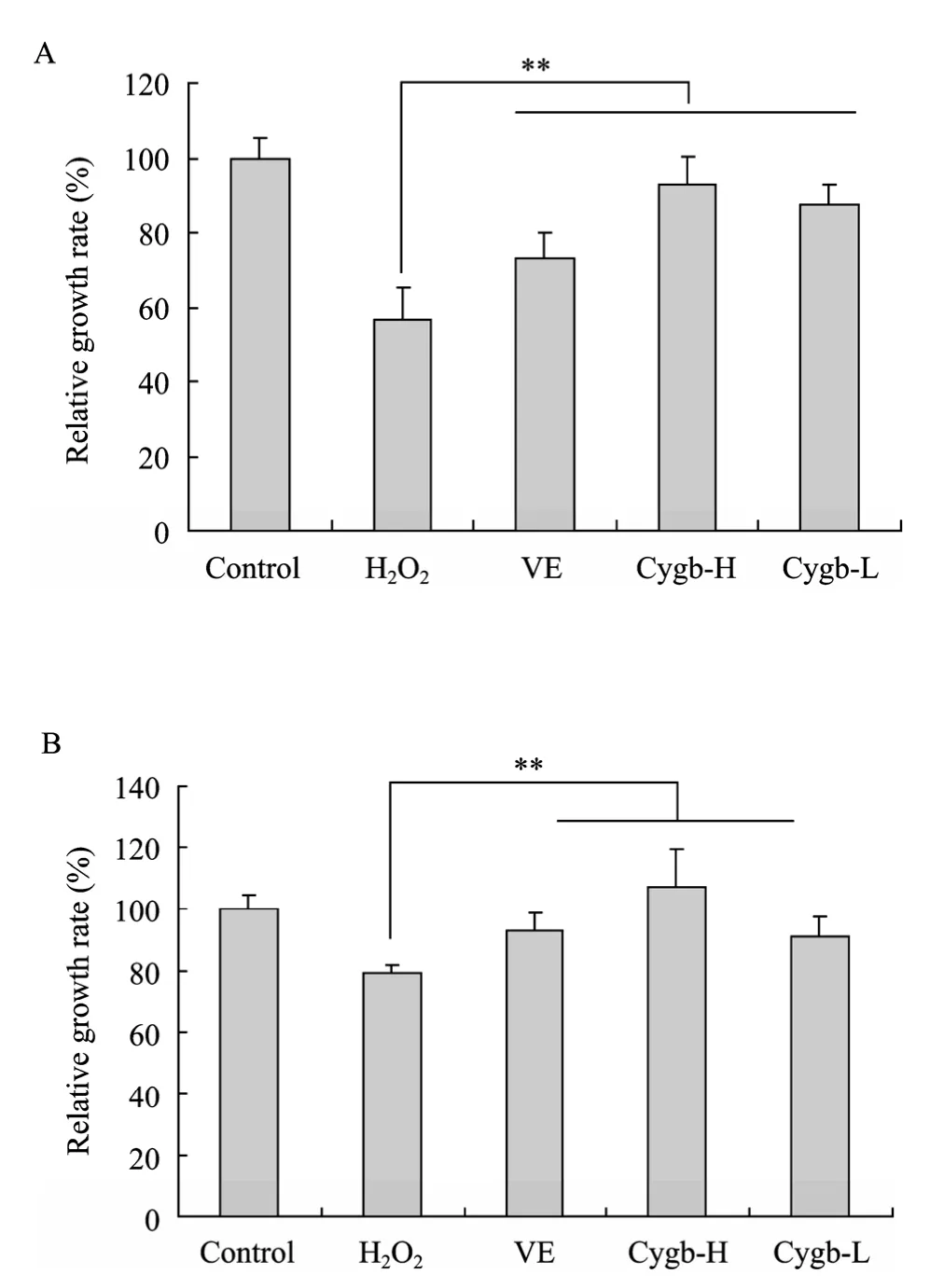
图3 Cygb蛋白对H2O2损伤的保护性作用Fig. 3 Protection effects of Cygb protein towards the injury induced by H2O2. (A) rHSC. (B) LX-2. VE: 50 µmol/L; Cygb-H: 50 mg/L; Cygb-L: 10 mg/L. **P<0.01.
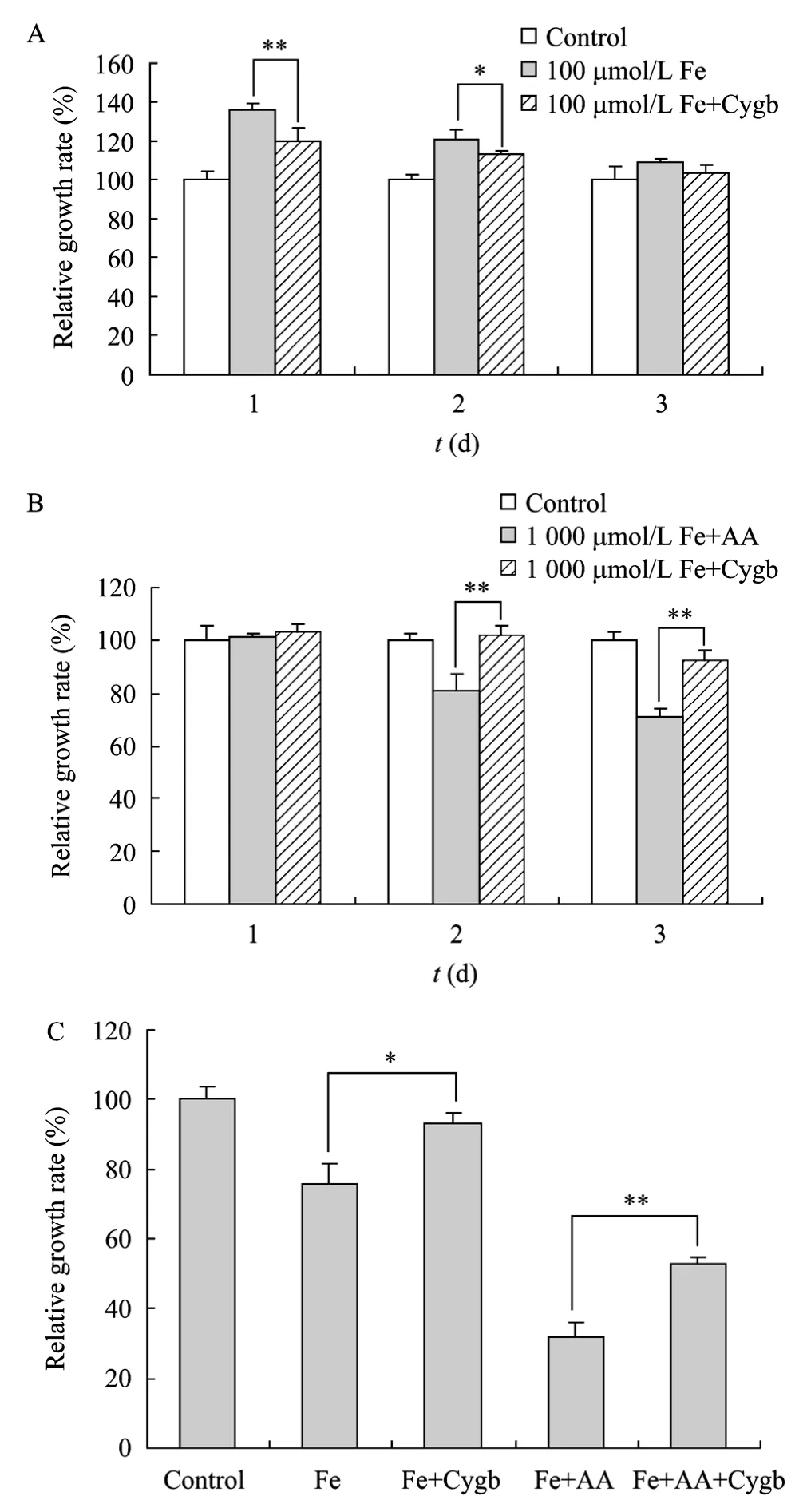
图4 Cygb蛋白对Fe-NTA/AA损伤的保护性作用Fig. 4 Protection effects of Cygb protein towards the injury induced by Fe-NTA/AA. (A,B) rHSC. (C) LX-2. *P<0.05; **P<0.01.
加入 50 mg/L Cygb蛋白预处理能够抑制100 µmol/L Fe-NTA引起的rHSC增殖 (图4A,作用1 d P<0.01;作用2 d P<0.05);在1 000 µmol/L Fe-NTA与AA共同作用的情况下,Cygb蛋白预处理同样能够减小由 Fe与 AA引起的协同增效作用(图4B,作用2 d&3 d P<0.01)。因此,在Fe-NTA/AA作用下,Cygb蛋白能够起到抑制rHSC细胞过度增殖以及保护其被过度损伤的作用。对于LX-2细胞,50 mg/L Cygb蛋白预处理组细胞增殖率显著高于单用500 µmol/L Fe-NTA处理组 (P<0.05),且能极显著降低500 µmol/L Fe-NTA+20 µmol/L AA对LX-2造成的毒性作用 (P<0.01)。
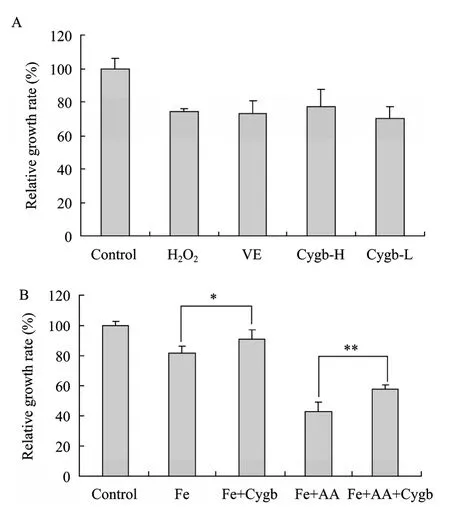
图5 Cygb蛋白对氧化反应引起的LX-2细胞损伤的治疗性作用Fig. 5 Therapeutic effects of Cygb protein on LX-2 cells towards the injury induced by oxidation. (A) H2O2 treated. (B) Fe-NTA/AA treated. VE: 50 µmol/L; Cygb-H: 50 mg/L; Cygb-L: 10 mg/L. *P<0.05; **P<0.01.
2.3 重组 Cygb蛋白对氧化反应引起的肝星状细胞损伤的治疗性作用
加入 200 µmol/L H2O2作用 30 min后再加入Cygb蛋白处理,48 h后进行MTT检测结果如图5所示。过氧化氢对LX-2细胞表现出明显的毒性,抑制率约25%;加入50 µmol/L VE、高浓度Cygb蛋白、低浓度Cygb蛋白的各组细胞相对增殖率与单加过氧化氢的阳性对照组相比未表现出显著性差异(图5A,P>0.05),说明Cygb蛋白或是VE之类的抗氧化剂对过氧化氢造成的细胞损伤没有显著的治疗性作用。然而Fe-NTA作用30 min后加入50 mg/L Cygb蛋白处理的LX-2细胞增殖率却显著高于单用500 µmol/L Fe-NTA处理组 (图5B,P<0.05),且能显著降低 500 µmol/L Fe-NTA+20 µmol/L AA对LX-2造成的毒性作用 (图5B,P<0.01)。
2.4 Cygb蛋白对于氧化反应引起的肝星状细胞内超氧化物水平的影响
2.4.1 H2O2处理
加入500 µmol/L过氧化氢作用后会引起rHSC及LX-2细胞内超氧化物显著增多 (图6A2、B2),而加入 Cygb蛋白预处理的细胞内超氧化物含量明显降低,高浓度组 (图 6A4、B4) 荧光强度明显弱于低浓度组 (图6A3、B3),与对照组相差无几 (图6A1、B1),说明 Cygb蛋白预处理可显著减少由过氧化氢引起的肝星状细胞内超氧化物的增加。
2.4.2 Fe-NTA处理
加入500 µmol/L Fe-NTA作用后会引起rHSC及LX-2细胞内超氧化物显著增多 (图7A2、B2),而加入 Cygb蛋白预处理的两种细胞内超氧化物含量都明显降低 (图7A3,A4,B3,B4),证明Cygb蛋白预处理可显著减少由 Fe-NTA引起的细胞内超氧化物的增加。
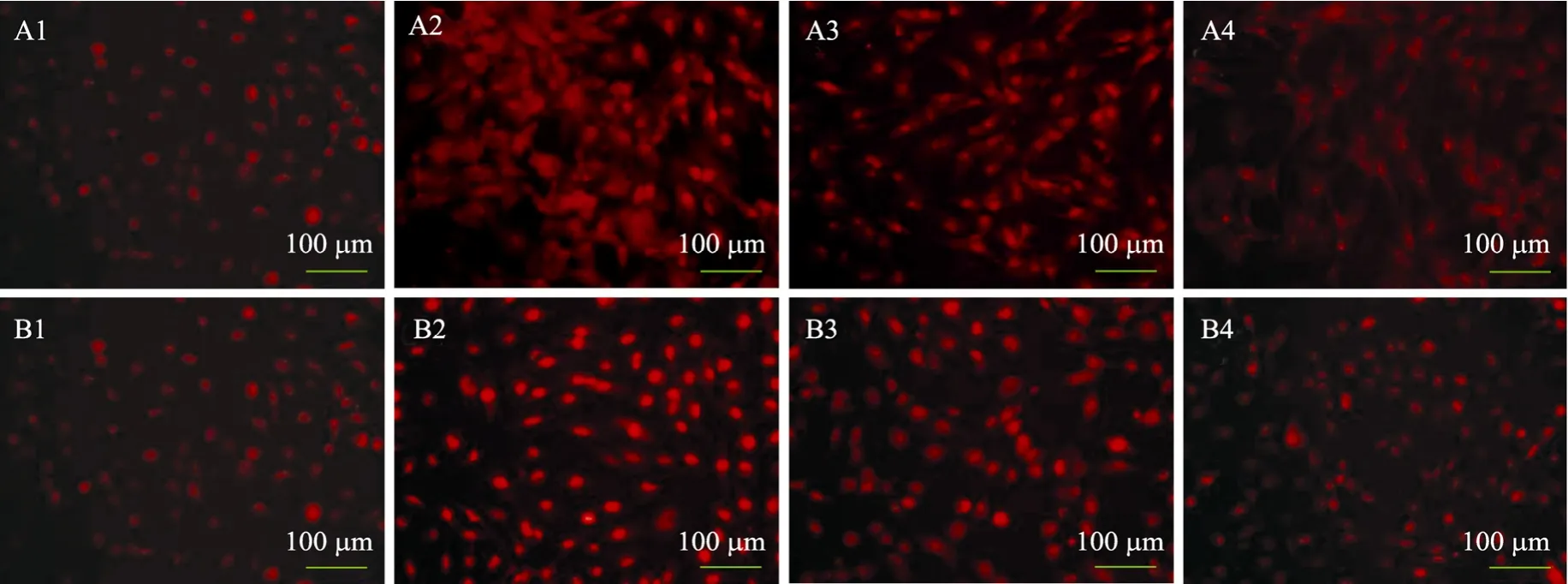
图6 细胞内超氧化物检测Fig. 6 Intracellular superoxide assay. The red fluorescence represented the superoxide in the cells. (A) rHSC. (B) LX-2. 1−4: control, H2O2 group, 10 mg/L Cygb group and 50 mg/L Cygb group, respectively.
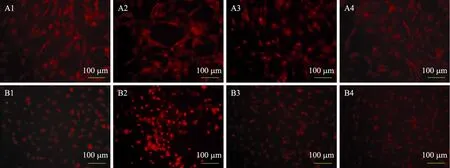
图7 细胞内超氧化物检测Fig. 7 Intracellular superoxide assay. The red fluorescence represented the superoxide in the cells. (A) rHSC. (B) LX-2. 1−4: control, Fe-NTA group, 10 mg/L Cygb group and 50 mg/L Cygb group, respectively.
2.5 细胞内过表达 Cygb蛋白对氧化反应引起的肝星状细胞损伤的保护性作用
如图8所示,无论是单用500 µmol/L Fe-NTA处理,或是Fe-NTA+20 µmol/L AA协同作用24 h后,转染pCygb的LX-2细胞增殖率均要显著高于转染pEGFP的细胞组 (图8,Fe-NTA/AA model);同样,用400 µmol/L过氧化氢处理24 h后,转染pCygb的细胞增殖率要明显高于转染pEGFP的细胞组 (图 8,H2O2model),说明 LX-2细胞内过表达Cygb蛋白会对氧化损伤造成的毒性作用起到保护性作用。
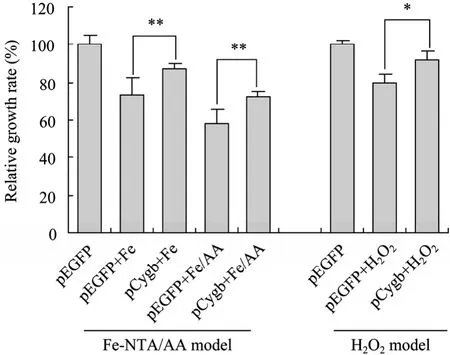
图8 LX-2细胞内过表达Cygb蛋白对氧化损伤的保护性作用Fig. 8 Effects of oxidation on the proliferation of LX-2 cells over-expressing Cygb gene. *P<0.05; **P<0.01.
3 讨论
本文选取了两种肝脏中有代表性的氧化模型:过氧化氢模型及铁过载模型,研究了Cygb蛋白在肝纤维化氧化应激中发挥的具体作用。结果表明内源性 Cygb蛋白对于两种氧化反应导致的肝星状细胞损伤都具有显著性的保护作用,证明其在活化肝星状细胞内的表达上调是其应对氧化应激的保护性措施,而并非只是纤维化的标志分子。利用重组Cygb蛋白的实验则进一步证实了 Cygb蛋白对人肝星状细胞系 LX-2及原代大鼠肝星状细胞都能发挥显著的保护作用,且对于铁过载导致的肝星状细胞损伤还具有显著的治疗性作用。
为何预处理时Cygb蛋白及VE均能表现出明显的保护作用,而过氧化氢作用30 min后处理却效果不佳呢?目前多项研究已经证实Cygb作为一种胞浆蛋白在细胞内发挥作用,而并非一种分泌性蛋白[13-15],并且尚无相关细胞表面 Cygb受体的报道出现,因此Cygb蛋白进出细胞尚缺乏相应的主动运输机制。由文献[16]可知过氧化氢较易从溶液中扩散穿透细胞膜进入细胞中。若先用过氧化氢处理细胞半小时,则大部分过氧化氢已经透过细胞膜进入细胞中发挥作用,而Cygb蛋白则由于缺乏细胞表面受体或其他的主动运输机制而较难被细胞吸收而在胞内发挥作用;若先用Cygb蛋白进行预处理,则由于Cygb具有显著的过氧化物酶活性,加入的过氧化氢会首先与溶液中的Cygb蛋白相互作用,大大降低实际对细胞发挥作用的过氧化氢的浓度,因而会对细胞产生显著保护作用,从理论上讲,只要溶液中的Cygb蛋白能够完全反应掉加入的过氧化氢,则可完全抵消过氧化氢产生的毒性。而在铁过载模型中,Cygb蛋白却能对肝星状细胞发挥显著的保护性作用,这是由于肝星状细胞表面不具备铁吸收受体而导致大部分Fe游离于胞外,因而同样在胞外的Cygb蛋白可较充分发挥其抗氧化作用。简而言之,重组Cygb蛋白对胞内的活性氧清除效果不理想,可能与其进出细胞缺乏相应的主动运输机制有关。由此推论,通过将Cygb基因导入细胞中使其在细胞内过量表达或者通过基因工程手段在 Cygb蛋白上连接小分子穿膜肽[17],使其能够穿过细胞膜进入胞内发挥作用,可能是实现 Cygb蛋白直接应用于肝纤维化治疗的解决方案。在此前提下,本实验进一步利用脂质体将 Cygb质粒转染入肝星状细胞中使其过表达,证实细胞内过表达Cygb蛋白对无论是铁过载或是过氧化氢引起的氧化反应均能发挥较好的保护性作用。
由课题组前期研究可知过氧化氢与Fe-NTA/AA的氧化作用机制不同,Fe-NTA/AA所引发的脂质过氧化反应较过氧化氢要温和,因而对完全活化的LX-2细胞及未完全活化的rHSC产生截然不同的作用[11]。本文的实验证实重组 Cygb蛋白不仅能保护完全活化的LX-2细胞免受氧化应激损伤,并且能发挥抑制未完全活化的原代肝星状细胞过度增殖以及保护其被过度损伤的作用,提示该蛋白在肝纤维化进展的不同阶段都能发挥抗氧化治疗作用。
本文为全面阐释Cygb的抗氧化作用及机制、加速药物新靶点开发提供了理论依据。
REFERENCES
[1] de Sanctis D, Dewilde S, Pesce A, et al. Crystal structure of cytoglobin: the fourth globin type discovered in man displays heme hexa-coordination. J Mol Biol, 2004, 336(4): 917−927.
[2] Kawada N, Kristensen DB, Asahina K, et al. Characterization of a stellate cell activation−associated protein (STAP) with peroxidase activity found in rat hepatic stellate cells. J Biol Chem, 2001, 276(27): 25318−25323.
[3] Lv YH, Wang QZ, Diao Y, et al. Cytoglobin: a novel potential gene medicine for fibrosis and cancer therapy. Curr Gene Ther, 2008, 8(4): 287−294.
[4] Xu RA, Harrison PM, Chen M, et al. Cytoglobin overexpression protects against damage-induced fibrosis. Mol Ther, 2006, 13(6): 1093−1100.
[5] Xu RA, Chen L, Xiao WD. Molecular Gene Medicine. Beijing: Peking University Press and Peking University Medical Press, 2008: 289.许瑞安, 陈凌, 肖卫东. 分子基因药物学. 北京: 北京大学, 北京大学医学出版社, 2008: 289.
[6] Li XY, Xu RA, Wang GJ, et al. Effects of rAAV/rSTAP on mRNA level of interstitial collagenase in rat stellate cells. Chin J Clini Pharm Ther, 2004, 9(11): 1236−1238.李欣燕, 许瑞安, 王广基, 等. 重组副腺病毒介导的大鼠星状细胞激活相关蛋白基因转染对大鼠肝星状细胞表达间质胶原酶 mRNA的影响. 中国临床药理学与治疗学, 2004, 9(11): 1236−1238.
[7] Mimura I, Nangaku M, Nishi H, et al. Cytoglobin, a novel globin, plays an antifibrotic role in the kidney. Am J Physiol Renal Physiol, 2010, 299(5): F1120−F1133.
[8] Li XY, Xu RA, Wang GJ, et al. Cloning of stellate cell activation-associated protein (STAP)gene and construction of its recombinant adenovirus-associated virus. Chin J Pharm Biotech, 2005, 12(6): 351−353.李欣燕, 许瑞安, 王广基, 等. 大鼠星状细胞激活相关蛋白基因的克隆及其重组腺相关病毒载体的构建. 药物生物技术, 2005, 12(6): 351−353.
[9] Zhang TT, Li ZF, Xu RA. Preparation, purification and activity of recombinant rat cytoglobin. J Huaqiao Univ: Nat Sci, 2009, 30(6): 671−675.张亭亭, 李招发, 许瑞安. 重组大鼠细胞球蛋白的制备、纯化与活性. 华侨大学学报: 自然科学版, 2009, 30(6): 671−675.
[10] Xu RA, Wang GJ, Diao Y. Production and function of recombinant cytoglobin protein: CN, 200510094205. 2005-09-05.许瑞安, 王广基, 刁勇. 重组细胞球蛋白 (Cytoglobin)的 生 产 方 法 及 其 用 途: 中 国 , 200510094205. 2005-09-05.
[11] Wang QZ, Lv YH, Li ZF, et al. Construction, detection and analysis of the oxidative stress models of hepatic stellate cells. Chin J Clini Pharm Ther, 2010, 15(9): 1002−1007.王启钊, 吕颖慧, 李招发, 等. 肝星状细胞氧化应激模型的构建、检测与分析. 中国临床药理学与治疗学, 2010, 15(9): 1002−1007.
[12] Sakurai K, Cederbaum AI. Oxidative stress and cytotoxicity induced by ferric-nitrilotriacetate in HepG2 cells that express cytochrome P450 2E1. Mol Pharmacol, 1998, 54(6): 1024−1035.
[13] Trent JT III, Hargrove MS. A ubiquitously expressed human hexacoordinate hemoglobin. J Biol Chem, 2002, 277(22): 19538−19545.
[14] Burmester T, Ebner B, Weich B, et al. Cytoglobin: a novel globin type ubiquitously expressed in vertebrate tissues. Mol Biol Evol, 2002, 19(4): 416−421.
[15] Schmidt M, Gerlach F, Avivi A, et al. Cytoglobin is a respiratory protein in connective tissue and neurons, which is up-regulated by hypoxia. J Biol Chem, 2004, 279(9): 8063−8069.
[16] Cadenas E. Biochemistry of oxygen toxicity. Annu Rev Biochem, 1989, 58: 79−110.
[17] Deshayes S, Morris MC, Divita G, et al. Cell-penetrating peptides: tools for intracellular delivery of therapeutics. Cell Mol Life Sci, 2005, 62(16): 1839−1849.
