新铂类药物双环铂对8种结肠癌耐药细胞的化疗敏感性分析*
2011-02-09李楠静李立兰
魏 雯,刘 桢,陈 曦,李楠静,李立兰,毕 锋
(四川大学华西医院肿瘤中心腹部肿瘤科,成都 610041)
双环铂是由北京兴大科学系统公司开发的新型铂类化合物,是我国具有完全自主知识产权的化学Ⅰ类抗癌新药,体外研究和Ⅰ期临床试验显示双环铂具有低毒、高效的抗肿瘤活性,是前景较好的新一代铂类抗癌药物[1-2]。本试验选用双环铂作用于8种耐奥沙利铂或伊立替康的结肠癌耐药细胞系及其原代细胞,旨在测试双环铂对奥沙利铂或伊立替康有无交叉耐药性,及双环铂对耐药结肠癌细胞的化疗敏感性。为推广双环铂的临床应用,为耐药患者提供更多的化疗选择奠定基础。
1 材料与方法
1.1 材料 选取由四川大学华西临床医学院信号转导实验室提供的8种结肠癌原代细胞及其耐药细胞共配对成8组(耐奥沙利铂和耐伊立替康各4组),所有耐药细胞系均由本实验室研究人员用浓度梯度递增法诱导建立,经反复测试证明其耐药性能稳定[3],耐药指数(RI=原代 IC50/耐药IC50)为:COLO320和COLO320/OHP(10.16),COLO320和COLO320/CPT(25.87),SW620和SW620/OHP(21.06),SW620和SW620/CPT(19.38),SW480和SW480/OHP(12.19),SW480和SW480/CPT(14.13),LOVO和LOVO/OHP(13.78),LOVO和LOVO/CPT(15.56)。
1.2 试剂 RPMI 1640培养液(Gibco公司),新生小牛血清(Gibco公司),胎牛血清(杭州四季青公司),四甲基偶氮唑盐(MT T,上海华舜生物工程有限公司),二甲基亚砜(DMSO,重庆医药股份有限公司化玻分公司),双环铂(北京市兴大科学系统公司)。
1.3 方法 以原代细胞COLO320和耐药细胞COLO320/OHP为例。
1.3.1 细胞培养 将COLO320与COLO320/OHP细胞接种到含10%胎牛血清的RPMI 1640培养液中,置于37℃,5%CO2饱和湿度孵箱内培养(thermo),细胞呈单层贴壁生长。用0.1%胰酶消化传代,以0.1 μ g/mL的奥沙利铂维持其耐药性。
1.3.2 接种细胞至培养板 将COLO320和COLO320/OHP用胰酶消化,离心后弃上清液,重悬为单细胞悬液,在细胞计数板上计数,得到细胞悬液浓度,稀释至8 000~10 000个/mL,接种于96孔板上,每孔加100 μ L细胞悬液即800~1 000个细胞。
1.3.3 加药培养 事先将双环铂用纯水配置成从高到低的9个浓度:1 000、500、250、100、50、10、5、1、0.5 μ g/mL,在 96 孔板接种完成24 h后,再经新鲜培养基稀释10倍使混合液中药物终浓度为 100、50、25、10、5、1、0.5、0.1、0.05 μ g/mL,取一个上述接种好 COLO320与 COLO320/OHP细胞的 96孔板,按浓度从低到高的顺序加入上述含药培养基,每孔100 μ L。加药后作用24 h再次更换新鲜培养基继续培养,细胞在不同的浓度药物作用之下出现生长差异,定期观察细胞的生长状况,并于更换培养基后48 h后做M TT细胞毒性试验,将仅有细胞不加药物的孔作为阴性对照。
1.3.4 M TT细胞毒性试验 将上述换液培养48 h的培养板弃掉原培养液,每孔加入100μ L培养基及20 μ L MT T避光孵育4 h,同时设置调零孔(培养基、MT T、二甲基亚砜),4 h后弃去孔中液体,加入 150 μ L DMSO,置摇床上低速振荡10 min,使结晶物充分溶解。在酶联免疫检测仪OD490 nm(570 nm)处测量各孔的吸光值(OD值),注意调零。
1.3.5 模拟临床浓度计算抑制率 按照上述步骤另将耐药细胞COLO320/OHP单独培养于96孔板上,并根据公式药物浓度(μ g/mL)=(1.75×D)/(5 000÷ 50%)×103(D 为临床用药剂量mg/m2,D值取450[2],1.75 m2为平均成人体表面积,5 000 mL为平均血容量,50%为血细胞比容,乘103后将mg换算成μ g,计算出双环铂的模拟临床浓度为 78.75 μ g/mL,按该浓度将双环铂加入上述只含耐药细胞的96孔板,并以未加药的细胞做对照,重复MTT试验。
1.3.6 统计学处理 所有数据均用SPSS16.0统计软件分析,用回归分析计算 COLO320与COLO320/OHP在双环铂作用下的IC50(半数致死浓度)[4-5]、耐药指数,绘制抑制率曲线,并根据公式:抑制率=[(对照组平均OD值-实验组平均OD值)/(对照组平均OD值-空白对照组平均OD值)]×100%,计算出双环铂在模拟临床浓度为 78.75 μ g/mL时对8种结肠癌耐药细胞的抑制率,从而间接反映其体外化疗敏感性。剩余7个细胞组按照上述同样的方法完成药敏实验(除COLO320及其耐药细胞用胎牛培养基培养外,其余细胞均用小牛培养),每个浓度设3个复孔,每组细胞重复做3次。
2 结 果
各耐药细胞系自身耐药指数(对奥沙利铂/伊立替康的耐药指数)为10.16~25.87,而双环铂的耐药指数均为 1.10~2.46,表明双环铂对耐奥沙利铂、伊立替康细胞具有不完全交叉耐药性。双环铂在模拟临床用药浓度下对8种结肠癌耐药细胞中的7种敏感,对其中1种(480与480/CPT)细胞具有高度化疗敏感性,3种(320与320/OHP、480与 480/OHP、LOVO与LOVO/OHP)中度敏感,3种(620与620/OHP、620与 620/CPT、LOVO与 LOVO/CPT)低度敏感,1种(320与 320/CPT)不敏感。见表1、图1。
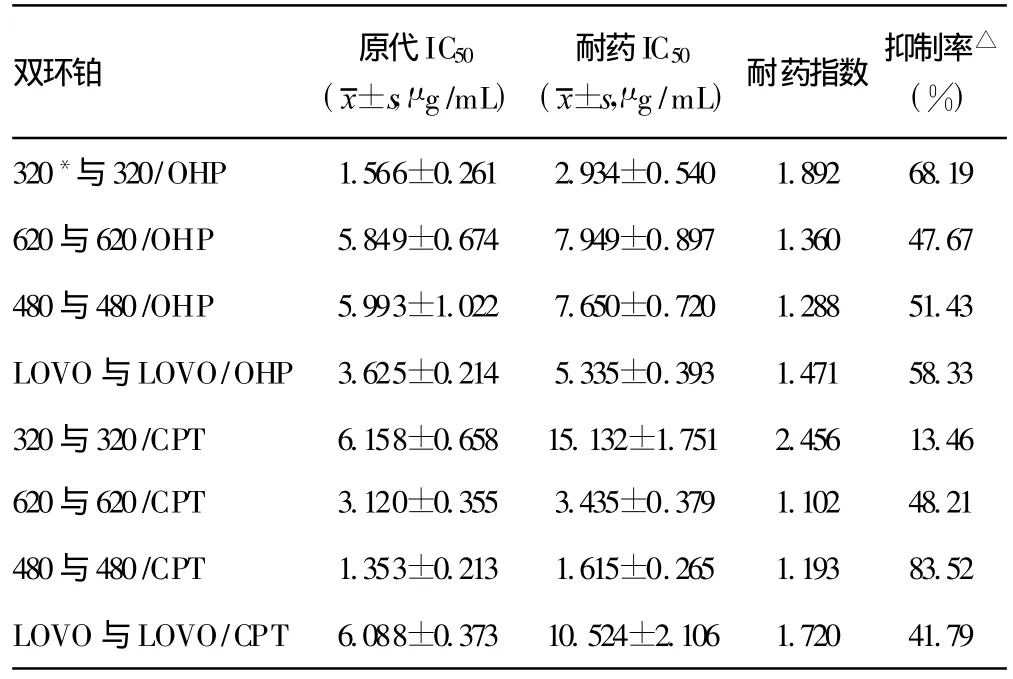
表1 双环铂对8种结肠癌耐药细胞的化疗敏感性

图1 双环铂作用下各细胞系的耐药指数与其原有耐药指数的比较
3 讨 论
20世纪60年代末,Rosenberg发现了第一个具有抗肿瘤活性的金属配合物——顺铂[6],由此揭开了铂类抗肿瘤药物发展的序幕。顺铂在随后的实验中被证实具有抗癌谱广泛、抗癌活性高、与其他类抗癌药物少有交叉耐药的优点,因而被广泛应用于临床实体瘤的化疗中[7],然而与此同时也发现其具有严重致恶心呕吐和胃肠道毒性、肾毒性、骨髓抑制、耳毒性、周围神经毒性等多种不良反应及易产生耐药的缺点[8],限制了其临床应用。于是,全世界的各个研究机构努力探寻一种既能保留较好的抗肿瘤活性,又能降低其不良反应及耐药性的方法,并通过改造顺铂原有结构,至今已合成和筛选出铂类化合物3 000多种[8]。其中第2代铂类以卡铂为代表,其抗癌谱和抗瘤活性与顺铂相似,可作为实体瘤治疗中顺铂的替代药物,肾毒性、消化道反应及神经毒性较顺铂为低,不需水化、利尿,使用方便[9]。第3代铂类以奥沙利铂为代表,对结直肠癌的治疗取得突破性进展,与 5-FU、亚叶酸钙联用,对胃癌、非小细胞肺癌、卵巢癌也有较好疗效。即便如此,肿瘤的耐药及不可忽视的不良反应仍使这些铂类药物其不能发挥最大潜能[10-11]。
为了进一步研发低毒、高效、无耐药的铂类,在北京大学化学学院的杨旭清教授的带领下,与多所重点高校及科研院所合作,成功研发了一种国家Ⅰ类抗肿瘤新药双环铂。双环铂采用超分子的设计理论,使一系列性能优于现已使用的铂类抗癌药,如在水中的溶解度、稳定性和脂溶性[8].双环铂临床前的研究和Ⅰ期、Ⅱ期临床研究揭示,双环铂与老一代铂类抗癌药物相比,对各种恶性肿瘤有更好的效能和低的毒性[9,12-14],对肿瘤细胞有较好的靶向作用,且不良反应较小,能够诱导部分肿瘤细胞凋亡[1,12,15-16]。在管忠震教授主持下,由中山大学肿瘤防治中心——国家抗肿瘤药物临床试验研究中心完成了Ⅰ期临床,证明本品安全性良好,其胃肠道反应及肾毒性低于顺铂,其血液毒性低于卡铂。蛋白结合率低,消除半衰期长。该技术项目已获得知识产权局的发明专利证书,并也获得美国、欧盟、俄罗斯、日本、韩国等国家和地区的发明专利证书,得到知识产权保护(美国专利号:6699901B1,欧洲专利号:1186610,日本专利号:3697210)。目前正进入Ⅱ(Ⅲ)期临床阶段。新近公布的一个Ⅱ期临床研究结果表明:双环铂联合紫杉醇的化疗方案和卡铂联合紫杉醇的化疗方案相比,疗效大致相仿,安全性良好,试验组与对照组相比可能有一定的生存获益,值得开展进一步临床研究明确[2]。
本试验通过测试双环铂对8种耐药结肠癌细胞的化疗敏感性,从而了解双环铂对现今一线抗结肠癌药物奥沙利铂及伊立替康有无交叉耐药性,从而为临床耐药患者提供更多化疗选择奠定基础。试验技术主要采用了M TT细胞毒性试验[4]。试验结果表明:各耐药细胞系自身耐药指数(对奥沙利铂/伊立替康的耐药指数)为10.16~25.87,而双环铂的耐药指数均为1.10~2.46,表明双环铂对耐奥沙利铂、伊立替康细胞具有明显化疗杀伤作用,对奥、伊两药具有不完全交叉耐药性。双环铂在模拟临床用药浓度下对8种结肠癌耐药细胞中的7种敏感,对其中1种(480与480/CPT)细胞具有高度化疗敏感性,3种(320与320/OHP、480与 480/OHP、LOVO 与 LOVO/OHP)中度敏感,3种(620与 620/OHP、620与 620/CPT、LOVO 与LOVO/CPT)低度敏感,1种(320与320/CPT)不敏感。
本试验是将肿瘤细胞完全暴露在药物下进行的,而药物在体内分布、代谢、排泄速度与体外实验具有较大差异。然而,体外药敏实验结果的初步筛选可为临床治疗提供线索。因此,在完善更多试验来进一步证实其疗效后,可考虑将双环铂作为耐奥沙利铂和伊立替康患者的另一化疗选择。下一步将继续完善:选取更多的耐药细胞种类,进行多药联合化疗敏感性测试,并进行动物试验验证疗效,期待在不久的将来能为临床患者带来益处。
[1]颜冬梅,屠凌岚,彭小英,等.铂类抗癌新药双环铂的体内外抗肿瘤活性[J].中国现代应用药学,2007,24(5):352-356.
[2]彭晋.双环铂联合紫杉醇与卡铂联合紫杉醇方案在初治晚期非小细胞肺癌的Ⅱ期临床研究[J].中国肿瘤临床,2009,36(12):711-714.
[3]Liu Z,Qiu M,Tang QL,et al.Establishment and biological characteristics of oxaliplatin-resistant human colon cancer cell lines[J].Chin J Cancer,2010,29(7):661-667.
[4]赵斌,葛金芳,朱娟娟,等.小议在M TT法测细胞增殖抑制率中IC50的计算方法[J].安徽医药,2007,11(9):834-836.
[5]刘德传,郭以河.MT T法测定大肠癌对化疗药物敏感性的实验研究[J].现代肿瘤医学,2009,17(4):699-701.
[6]Rosenberg B,VanCamp L,Trosko JE,et al.Platinum compounds:a new class of potent antitumour agents[J].Nature,1969,222(5191):385-386.
[7]Akiyama S,Chen ZS,Sumizawa T,et al.Resistance to cisplatin[J].Anticancer Drug Des,1999,14(2):143-151.
[8]Yang X,Jin X,Song Q,et al.Structural studies of dicycloplatin,an antitumor supramolecule[J].Sci China Chem,2010,53(6):1346-1351.
[9]闫长会,施畅,李玉凤,等.新铂类药物双环铂与顺铂、卡铂体内毒性的比较研究[J].中国新药杂志,2005,14(10):1156-1159.
[10]Rabik CA,Dolan ME.M olecular mechanisms of resistance and toxicity associated with platinating agents[J].Cancer Treat Rev,2007,33(1):9-23.
[11]Kartalou M,Essigmann JM.Mechanisms of resistance to cisplatin[J].M utat Res,2001,478(1/2):23-43.
[12]林飞,吕廉,杨旭清,等.双环铂及其衍生物对大鼠靶器官毒性损伤的比较[J].癌变·畸变·突变,2005,17(5):276-279.
[13]冯凤莲,林飞,杨旭清,等.新发现的一种具有生殖毒性的药物——双环铂[J].中华实用中西医杂志,2004,17(10):1552-1553.
[14]李秀琴,徐发亮,陈西敬,等.丙磺舒等药物对大鼠双环铂肾排泄的影响及其机理研究[J].青海医学院学报,2005,26(4):243-246.
[15]颜冬梅,屠凌岚,郑晓亮,等.双环铂对人卵巢癌细胞A2780的凋亡诱导作用[J].肿瘤学杂志,2009,15(7):667-670.
[16]王淳,阎瑞芳.双环铂诱导肺癌细胞发生凋亡的初步评价[J].实用肿瘤学杂志,2005,19(1):21-22.
