银杏黄酮提取和精制工艺的研究
2011-02-07韩学哲王东双安晓东连运河
韩学哲,王东双,安晓东,连运河
(1.河北省天然色素工程技术研究中心,河北 邯郸 057250;2.晨光生物科技集团股份有限公司,河北 邯郸 057250)
银杏叶提取物(Ginkgo Biloba Extract)的主要含有是银杏黄酮和内酯两大活性成分[1],其中银杏黄酮有效成分包括:银杏双黄酮 (gilobetin)、白果素(bilobetin)、槲皮素(quercetin)、山奈酚(kaempferol)等都具有3,3,4-三羟基结构的物质[2],具有抗氧化、降血脂、抗肿瘤等方面的作用[3]。鉴于银杏叶中黄酮具有独特的生理作用、临床治疗和保健价值[4],使GBE及其制剂一直为国际国内研究开发的热点之一[5]。目前,银杏叶中银杏黄酮的得率不高,生产消耗较大,对满足市场需求不利,因此,不断探索银杏叶中黄酮新的提取、精制工艺,提高得率,降低成本,以达到节能增效的目的,具有很现实的意义。本研究旨在通过实验研究,筛选最佳工艺,提高黄酮得率,降低生产成本。
本文应用循环提取工艺对银杏叶整叶进行提取,确定了提取温度、提取遍数和固液比。并对银杏黄酮精制工艺进行了研究,进行了大孔树脂筛选实验,研究了上柱液的pH值和洗脱液对黄酮得率的影响,最终确定了最佳的银杏黄酮的提取和精制的工艺条件。
1 实验部分
1.1 仪器和试剂
Agilentl200高效液相色谱仪(美国Agilent公司)。
银杏叶(从山东郯城收购);乙醇(食品级),其他试剂均为分析纯。槲皮素,山萘酚,异鼠李素对照品均购于上海同田生物技术有限公司。
1.2 检测方法[6-8]
色谱条件与系统适用性试验:以十八烷基硅烷键合硅胶为填充剂,甲醇-0.4%磷酸溶液(50∶50)为流动相,检测波长为360nm。理论塔板数按槲皮素峰计算应不低于2500。
溶液制备:分别精密称取经P2O5干燥过夜的槲皮素、山柰素、异鼠李素对照品,加甲醇制成每1mL分别含0.0299,0.0387,0.015mg的溶液,作为对照品溶液。精密称取固体样品0.05g,液体样品吸取样品2mL蒸干,将固体样品或者液体样品残渣加甲醇-25%盐酸溶液 (4∶1)混合液25mL溶解,移入250mL烧瓶中,回流30min,冷却,转移至50mL量瓶中,以甲醇定容,摇匀,滤过,即得供试品溶液。
测定法:分别精密吸取上述对照品溶液与供试品溶液,注入液相色谱仪,测定,分别计算3种黄酮苷元的含量,以下式换算成总黄酮醇苷的含量。总黄酮醇苷含量=(槲皮素含量+山柰素含量+异鼠李素含量)×2.51。
1.3 银杏黄酮的提取工艺过程

2 结果与讨论
目前,对银杏叶中黄酮类化合物的提取,广泛使用的以乙醇-水溶液(70%乙醇)和纯水为浸取溶剂进行生产。结果表明:1次浸取2 h,计算黄酮类化合物的浸出率,乙醇-水体系高于水体系。综合考虑能耗和得率成本,故本实验选70%乙醇作为浸取溶剂。
2.1 提取温度对提取效果的影响
在提取固液比1∶5,提取1次,提取时间2h条件下,选取温度 80 、70 、65 、55、45℃的条件,考察温度对银杏叶中总黄酮提取率的影响,不同温度下提取结果见表1。

表1 温度对黄酮提取率的影响Tab.1 Effect of temperature to extraction ratio of flavone
由表1数据可以看出,温度升高,提取率增大,当提取温度在65℃和70℃时,浸出率仅差0.3%,温度再升高提取率反而有所下降。这是由于银杏黄酮苷的分子结构中,存在多个酚羟基,酚羟基性质很不稳定,在温度较高时易被空气氧化所致,故选择浸取温度65℃为宜。
2.2 提取遍数对提取效果的影响
在提取每遍固液比1∶5,提取5遍,提取时间2h条件下,考察提取遍数对银杏叶中总黄酮提取率的影响,结果见表2。

表2 提取遍数对黄酮提取率的影响Tab.2 Effect of extraction times to extraction ratio of flavone
由表2数据可以看出,提取遍数增多,提取率增大,当提取遍数在第4遍时,浸出率1.5%,第5遍和第4遍相差0.4%,提取遍数再增多浸出率没有增长太多,考虑到生产成本,故选择提取遍数3遍为宜。
2.3 固液比对提取效果的影响
在提取3遍,提取时间3h,提取温度65℃条件下,选取总固液比 1∶9,1∶15,1∶18 的条件,考察固液比对提取银杏叶中总黄酮含量的影响,以考察提取完的渣中的含量检测提取率,结果见表3。

表3 固液比对黄酮提取率的影响Tab.3 Effect of solid-to-liquid ratio to extraction ratio of flavone
由表3数据可以看出,总固液比增大,提取率增大,当浸取总固液比在1∶15和1∶18时,渣中含量相差0.02%,浸出率仅差0.2%,固液比增大提取率也增长不明显,考虑到生产成本,因此,总固液比选择1∶15。
2.4 溶剂逆流循环提取对提取效果的影响
由于提取过程中第2遍和第3遍的提取液远没有达到饱和,因此,设计将溶剂逆流循环使用,固液比:第 1 遍 1∶5、第 2 遍 1∶5、第 3 遍 1∶5,将第一轮的第2遍萃取液作为第二轮的第1遍使用,第二轮的第3遍和作为第二轮第2遍,第3遍使用新溶剂,然后第二轮的第2遍萃取液作为第三轮的第1遍使用,这样依次循环下来,保证提取溶剂每次提取溶剂都达到饱和,并且浓缩时只浓缩第1遍料液,减少了浓缩量,降低了生产消耗;提取温度为65℃,时间为每遍2h。考察逆流循环提取的效果见表4。

表4 循环提取工艺银杏黄酮的提取率Tab.4 Extraction ratio of flavone by extraction process cycling
由表4数据可以看出,逆流循环提取,提取溶剂能达到饱和,提取率达到非循环提取效果,并且溶剂使用量、浓缩量较非循环提取能减少三分之二。
2.5 树脂选择
选择树脂需要考察树脂的分离效果和产品的含量两项指标才能确定树脂的使用,因此,选择了5种树脂:AB-8、LX-38、D101、LXA-8、HZ-841,进行实验,实验结果见表5。

表5 不同树脂的产品含量和得率Tab.5 Content and yield of different resin production
由于目前市场上银杏产品黄酮含量大于24%,因此,选择D101作为下步实验用树脂。
D101树脂的动态吸附效果见图1。
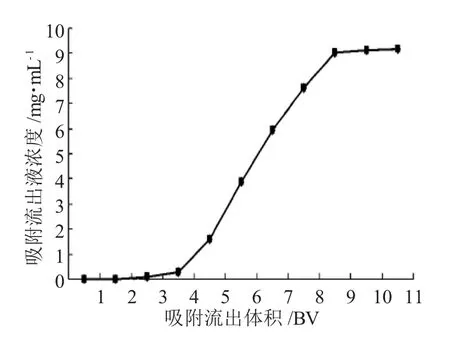
图1 D101树脂对银杏黄酮的动态吸附效果Fig.1 Dynamic adsorption effect of D101 resin to ginkgetin
配银杏黄酮浓度为3mg·mL-1的溶液,吸附流速为2BV·h-1,处理11BV的料液,每处理1BV的物料液收集一次流出液并用液相检测银杏黄酮的含量。从图1中可知,3个树脂床体积气有泄漏,未达到饱和之前,吸附柱内被吸附的银杏黄酮的浓度由上至下梯度降低,因而采用串联吸附方式,可以使树脂的吸附性能得到最大限度的发挥利用。
2.6 上样液pH值对D101树脂吸附效果的影响
取一定量的原液,分别调 pH 值为 4、4.5、5、5.5、6,控制流速为1BV·h-1,收集流出液并测量,以TLC板标定终点,计算吸附量。见图2,当pH值为5时,树脂的吸附能力最大。

图2 上样液pH值对树脂吸附效果的影响Fig.2 Effect of pH of gel loading buffer to adsorption of resin
2.7 洗脱液对银杏黄酮得率的影响
分别称取定量被银杏黄酮饱和的D101树脂,各加入6BV甲醇、乙醇、丙酮,静态洗脱4h,取上清液,测定其中银杏黄酮的浓度并换算成得率,结果见表6。

表6 洗脱剂对黄酮得率的影响Tab.6 Effect of eluant to flavone yield
从表6中可知,甲醇和乙醇的得率相差不大,考虑到甲醇的毒性,选用乙醇作为洗脱剂。
3 结论
本文通过乙醇提取银杏叶中银杏黄酮,并对醇提工艺的条件进行了优化。最佳工艺为:提取溶剂为70%的乙醇,提取温度65℃,固液比为1∶5,提取3遍,浓缩后调pH值为5,过D101大孔树脂柱,乙醇解析可得到含量为24%的精制银杏黄酮。
本研究采用了循环提取的工艺大大减少了溶剂的使用量,降低了生产成本,适合工业化生产。对提取温度、提取次数对提取率的影响做了较为详细的分析,对工业化生产有着指导意义。整个工艺过程操作简便,使用的溶剂对环境无污染,成本低,适合工业化生产。
[1]何琦,及元乔,丁立生,等.D140大孔吸附树脂银杏黄酮提取纯化性能研究[J].天然产物的研究与开发,2001,13(1):56.
[2]肖顺昌,等.银杏叶黄酮制备工艺研究[J].中国医药工业杂志,1990,21(5):340.
[3]庄向平,等.银杏叶中黄酮含量的测定和提取方法[J].中草药,1992,23(3):122.
[4]李兆龙.银杏叶开发利用[M].上海科技文献出版社,1996.3-4.
[5]刘桂霞,孙玉伟,金兆祥.银杏叶的研究进展[J].国外医药(植物药分册),1994,9(1):10.
[6]贾淑杰,张蓉,李昌军.HPLC法测定中药功能食品金奥立中总黄酮含量[J].中草药,2002,(7):620-621.
[7]杜安全,王先容,周正华.银杏叶总黄酮苷的HPLC法分析水解条件[J].安徽医药,2001,(3):164-165.
[8]曾里,曾凡骏,王威,等.几种HPLC法测定银杏总黄酮的比较研究[J].食品的研究与开发,2008,29(6):85-88.
