左旋肉碱的化学合成*
2011-02-07张海宏赵利军
虞 斌,张海宏,赵利军
(东北制药集团股份有限公司,辽宁 沈阳 110026)
左旋肉碱,也叫L-carnitine、L-卡尼汀、左卡尼汀、L- 肉碱、维生素 Bt、肉毒碱。化学名:(R)-3- 羟基-4-(三甲基铵)丁酸,或者L-β-羟-γ-三甲胺丁酸,英文名:(R)-3-Hydrox-4-(trimethylammonio)butyrate,分子式:C7H15NO3;(CH3)3N+CH2CH(OH)CH2COO-,分子量:161.20;外观性状:白色晶体,易吸湿,略有特殊腥味。不溶于丙酮、乙醚、苯,极易溶于水、乙醇和碱。水中溶解度:2500g·L-1。比旋光度[α]20D:-32°(C=1,H2O),熔点:210℃。
左旋肉碱最早是从肌肉中被提取并分离出来,后来研究发现左旋肉碱是人体必需物质,并将其命名为“维生素BT”。进一步研究证实左旋肉碱是脂肪酸转运到细胞线粒体内的唯一载体,因而左旋肉碱最重要的功能是促进脂肪酸的β-氧化,降低血清胆固醇及甘油三脂的含量,提高机体的耐受力。另外,左旋肉碱还具有:解毒酰基残留物、参与支链氨基酸代谢、调节糖原生成、促进ATP转运等生理作用[1]。2010年《中华人民共和国食品安全法》批准左旋肉碱扩大使用范围及使用量。
左旋肉碱的生产方法主要有3种:提取法、化学合成法、生物合成法。提取法最早是从肉浸膏中分离提取出左旋肉碱,由于提取纯化的步骤较多,且产量较少,难以形成规模生产。化学合成法主要采取两种途径:(1)直接用DL-混旋体作原料,利用拆分剂析出左旋体;(2)以不同的化学物质为原料进行合成。生物合成法制备左卡尼汀主要有两种方法:(1)是微生物发酵法;(2)是利用酶法转化。目前,工业上一般采用环氧氯丙烷为原料经过氨化、酸化等几步反应,在反应过程中进行手性化,得到左旋体。本文论述该工艺路线的进展情况。
1 化学合成与手性拆分
1.1 混旋体肉碱
早期化学合成的肉碱是消旋体,以环氧氯丙烷为原料经过氨化、酸化、氰化、水解及去离子化得到混旋的肉碱(DL-Carnitine),见图1。曾用于食欲增进剂和调整胃功能的药物,或作为食品添加剂。
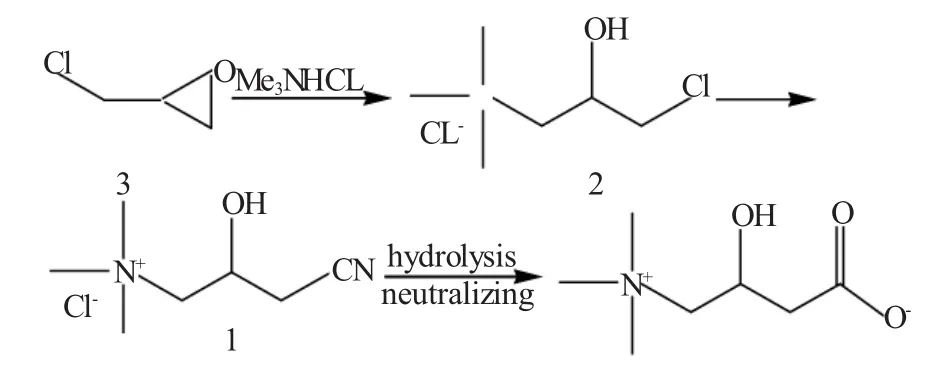
图1 环氧氯丙烷制混旋肉碱Fig.1 DL-carnitine
1.2 消旋体拆分制左旋肉碱
后来发现只有左旋肉碱具有生理活性,右旋肉碱对肉碱乙酰转移酶-(CAT)和肉碱脂肪酰转移酶(PTC)有竞争性抑制作用。采用消旋体拆分法是常用的旋光物质制备方法,最常见的是用一种光学纯的碱去拆分一种酸,或用一种光学纯的酸去拆分一种碱,酸碱形成盐进行重结晶。Y.Hamari[2]等利用(-)- 扁桃酸,V.Iannella[3]与 H.Kiruchi[4]利用(-)-二苯甲酰-L-酒石酸对消旋体肉碱进行了拆分制得左旋肉碱(L-Carnitine),见图2。
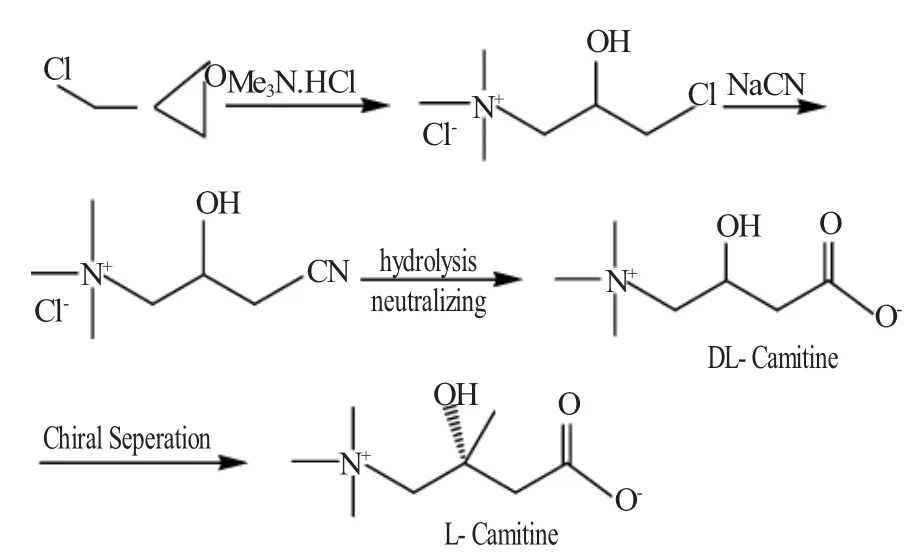
图2 利用(-)-二苯甲酰-L-酒石酸对消旋体肉碱拆分制左旋肉碱Fig.2 Racemate resolution method
1.3 前体1的拆分
G.Kato 等[5],T.Morishta 等[6],D.M.Muller等[7]利用D-樟脑磺酸,(-)-二苯甲酰-L-酒石酸,N-乙酰-D-谷氨酸等对前体1进行了拆分,进一步合成制得左旋肉碱。
1.4 前体2的拆分
R.Voeffray等[8]采用 L-(+)- 酒石酸,张红素[9]采用D-(+)-酒石酸对前体2进行了拆分,再经氰化、水解制得左旋肉碱。
1.5 前体3的拆分
Jacobsen等[10]在考察不同金属催化剂对末端环氧化合物水解拆分效果时,发现(S)-Salen Co催化剂对环氧氯丙烷的水解拆分效果最佳,得到左旋环氧氯丙烷(ee值98%),产率44%(图3)。目前,化学合成法生产左旋肉碱主要采用这一方法得到的左旋环氧氯丙烷为原料[11]。
2 存在问题及解决方案
化学合成与手性拆分制备左旋肉碱过程中存在使用NaCN,HCN以及CaCN等有毒物质,拆分剂及催化剂价格偏高,拆分分离开的另一半旋光体如何利用,反应步骤多,收率低,成本高,产品价格高等问题。针对上述问题,开展了一些有益的工作。
2.1 构型反转合成产物
由于通过拆分消旋体肉碱或其前体来制备左旋肉碱的过程中产生许多右旋肉碱或其前体物,F.Gianness等[12]做了很多工作,将右旋肉碱前体物转化成左旋肉碱,转化过程简单易行,对工业化合成左旋肉碱作出了贡献(图4)。
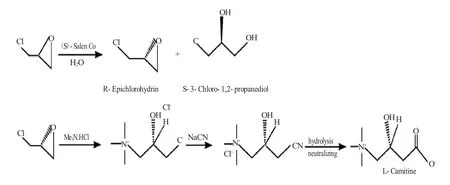
图3 (S)-Salen Co催化剂拆分环氧氯丙烷制左旋环氧氯丙烷Fig.3 Catalyst(S)-Slen Co resolution epichlorohydrin to L-epichlorohydrin
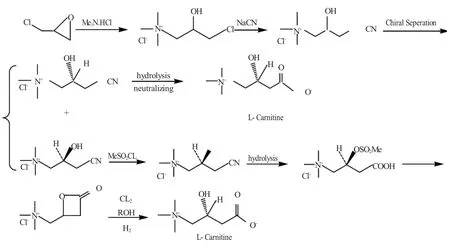
图4 右旋肉碱前体物转化成左旋肉碱Fig.4 Precursor of D-carnitine conversion to L-carnitine
2.2 回收套用
胥波等[13]对合成反应和拆分条件进行了优化,由于拆分的化合物只有一半可利用,而且S-型前体1难以用常法消旋,不但浪费了原料而且构成环境污染,通过设计一种氧化还原消旋化的方法,制备得到消旋的拆分前体,使之可回收再用(图5)。
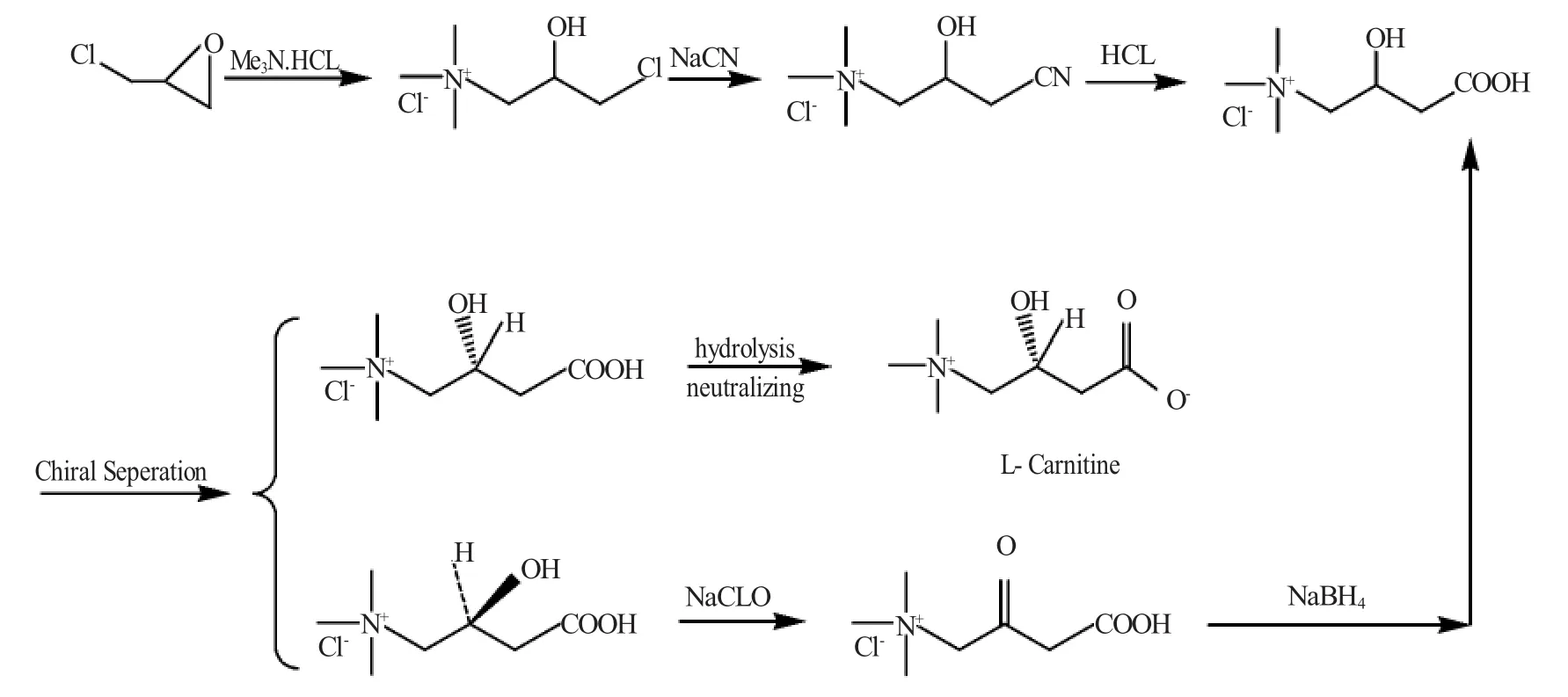
图5 氧化还原消旋法制备消旋的拆分前体Fig.5 Resolution precursor preparation by oxidationreduction racemization
2.3 催化剂循环利用
为了更好的回收和再生利用,Jacobsen等[14]将S-(salen)Co(Ⅲ)催化剂固载到聚苯乙烯树脂和硅胶上,应用于环氧氯丙烷的拆分,多次重复使用后效果依然显著,重复5次后的得到R-环氧氯丙烷的ee值为>99%,转化率为52%。
Kureshy R I等[15]制备了一种双聚体形式的S-(salen)Co催化剂,在反应6 h后,手性环氧氯丙烷的产率为49%,ee值为97%,并且催化剂的重复利用性也比较理想。
研究者们[16-18]制备了各种形式的S-salenCo(Ⅲ)催化剂,从单体S-salen Co(Ⅲ)催化剂一直到各种聚合形式的S-salen Co(Ⅲ)催化剂的出现(图6)。由于S-salen Co(Ⅲ)催化剂的价格昂贵,如何引入价廉、具有更高催化活性和高重复利用性的催化剂仍是当前乃至今后该领域研究工作的重点。
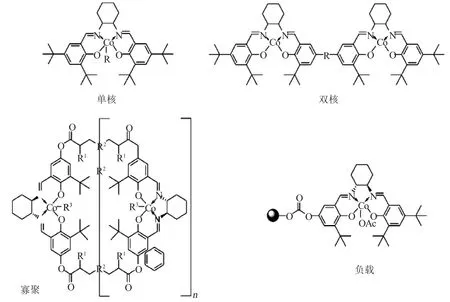
图6 S-salen Co(Ⅲ)单体及聚合形式催化剂Fig.6 Monomer and composite S-salen Co(III)
2.4 拆分剩余物利用
王朝阳等[19]通过外消旋的环氧氯丙烷经Salen-Co催化剂催化拆分水解,得到R-3-氯-1,2-丙二醇,经缩合、取代、醇解得到光学纯的左旋的丙叉甘油醇,产率为59.4%。该路线可以合成左旋丙叉甘油醇和右旋丙叉甘油醇,其合成路线见图7所示。这也为S-3-氯-1,2-丙二醇的利用提供了思路。

图7 外消旋环氧氯丙烷Salen Co催化拆分水解过程Fig.7 Resolution of L-epichlorohydrin by S-salen Co(III)
2.5 生物化学法
Choi,W.J.等[20]筛选到一株产环氧水解酶的黑曲霉菌株,对消旋体的环氧氯丙烷进行手性拆分,生成S-环氧氯丙烷。
Kim,H.S.等[21]利用 Rhodotorula glutinis 酵母中的产环氧水解酶基因构建了Pichia pastoris酵母工程菌发酵产酶。在对消旋体的环氧氯丙烷水解过程中,发现酶浓度的增加可显著缩短反应时间,添加表面活性剂可提高S-环氧氯丙烷的ee值至100%。
许辉辉等[22]从土壤中筛选到1株能产环氧氯丙烷水解酶的微生物(黑曲霉)菌株C375,当拆分时间为10h,S-环氧氯丙烷的对应体过量值达99.0%,产率为18.6%。
Kabat等[23]通过用(R)-环氧氯丙烷与格氏试剂反应经三甲胺取代,阴离子交换后氧化制得左旋肉碱。
考虑将微生物法与化学合成法相结合,通过将S-环氧氯丙烷构型反转为R-环氧氯丙烷,避免使用氰化物路线应该是未来左旋肉碱生产的发展方向(图8)。

图8 (R)-环氧氯丙烷与格氏试剂反应,制左旋肉碱Fig.8 L-carnitine preparation by reaction of(R)-epichlorohydrin and Grignard reagent
2.6 其它工业原料
M.Paolo Casati等[25]以双乙烯酮为原料,将双烯酮氯化后立即与拆分剂L-苯基氨基乙酸甲酯结合,然后还原拆分,再经两步反应就制得左旋肉碱(图9),但文献报道的收率不高(<5%),主要原因是拆分率不高,要得到光学纯度好的拆分体必须反复重结晶,收率损失较大。双乙烯酮,即3-羟基丁烯酸-β-内酯,纯度98%的价格15000元·t-1,与工业环氧氯丙烷相比价格略便宜。目前,国内生产也可以满足供应,从无毒化考虑,如果拆分正确,也是可以考虑的发展方向。

图9 M.Paolo Casati等制左旋肉碱工艺过程Fig.9 Technology for L-carnitine by M.paolo Casati
LannellaV[3]和李 全等[25]采用氯乙酸乙酯为原料,先合成r-氯乙酰乙酸乙酯,继续反应得到消旋体肉碱,以左旋二苯甲酰-D-酒石酸为拆分剂,制备了左旋肉碱盐酸盐(图10),但收率仅为5%。过程中无须使用氰化物和离子交换树脂。
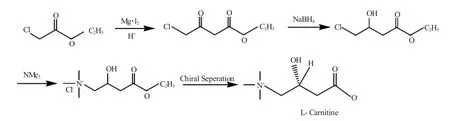
图10 LannellaV等制左旋肉碱真盐酸盐工艺过程Fig.10 Technology for L-carnitine hydrochloride by LannellaV
3 手性原料与化学合成
随着手性技术的进步,手性化合物的种类和产量逐渐增加,产品价格也随之下降,这为以手性化合物为原料制备左旋肉碱提供了可能。M.E.Jung等[26]首先以Vc为原料经10步反应制得了L-肉碱,总收率<10%,K.Bock等[27]分别以L-抗坏血酸和L-阿拉伯糖为原料成了左旋肉碱(图11、12)。

图11 M.E.Jung等以L-抗坏备的制左旋肉碱工艺过程Fig.11 Technology for L-carnitine with L-ascorbic acid by M.E.Jung

图12 M.E.Jung等以伯糖为原料制左旋肉碱工艺过程Fig.12 Technology for L-carnitine with arabinose acid by M.E.Jung
目前,全球VC原料药生产能力约为15万t,除荷兰DSM公司在苏格兰的达瑞工厂拥有2.3万t生产能力外,其余12.7万t生产能力主要集中在我国的东北制药、石药集团、华北制药、江山制药以及淄博鲁维食品生物有限公司等5家企业,产业集中度一直较高。随着国内又有一新企业投资年产2万tVC项目,VC国内产能严重过剩,新项目的上马无疑使得VC供应进一步加大,预计价格还有下跌空间。目前,内销价格下降至42元·kg-1。
F.D.Bellamy[28]以D-苹果酸为原料,经6步反应合成了左旋肉碱(图13),收率可达35%~40%,是目前收率较高的合成路线。
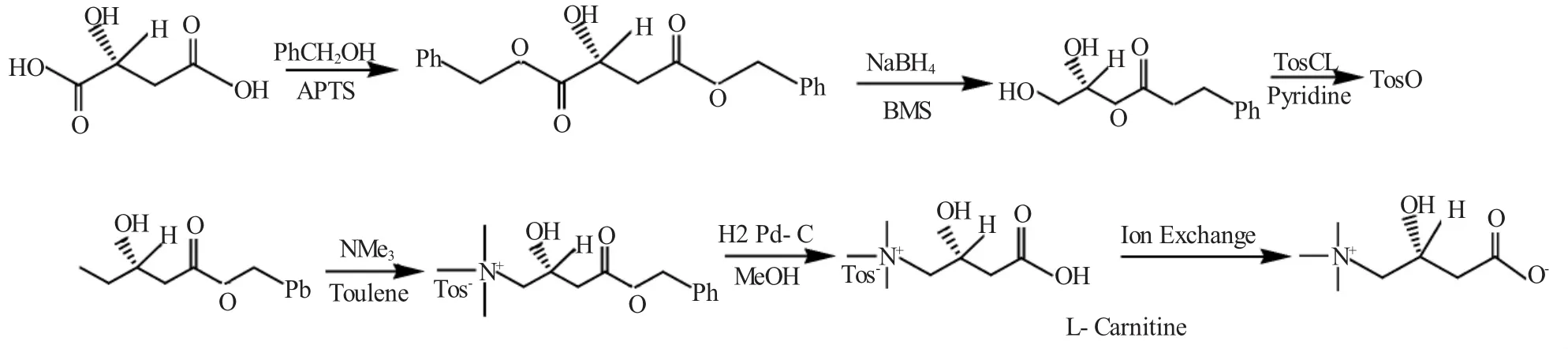
图13 F.D.Bellamy以D-苹果酸为原料制左旋肉碱工艺过程Fig.13 Technology for L-carnitine with malic acid by F.D.Bellamy
4 不对称合成
不对称合成是“一个有机反应,其中底物分子整体中的非手性单元由反应剂以不等量地生成立体异构产物的途径转化为手性单元”。反应剂可以是化学试剂、催化剂、溶剂或物理因素。目前,不对称合成在药物合成和天然产物合成中都有十分重要的地位。但无疑,现在最完善的不对称合成技术,要数存在于生物体内的酶。能否实现像酶一样高效的催化体系,是对人类智慧的挑战。
M.Kitamura[29]以氯乙酰乙酸乙酯为原料经不对称催化氢化制得高光学纯度的(R)-4-氯-3-羟基丁酸乙酯,进而转化为左旋肉碱(图14)。他们采用0.05(mol)%的Ru(OCOMe)2[(S)-binap]为催化剂,在10MPa,100℃下反应5min即可制得所需的(R)-产物,光学收率为97%,产率可达97%。

图14 M.Kitamura以氯以酰乙酸乙酯为原料制左旋肉碱工艺过程Fig.14 Technology for L-carnitine with acetylperchlorate by M.kitamura
5 结论
左旋肉碱的市场需求增加是无疑的,加快开发合成新技术,扩大生产能力是当今主要任务,采用便宜的原料,减少反应步骤,使用无毒试剂,非昂贵的催化剂以及拆分分离另一半旋光体的利用等成为左旋肉碱合成的研究重点。
[1]金抒,汪昌国.L- 肉碱的合成[J].合成化学,2000,8(2):107-123.
[2]Hamari,Y.:JP 59 231 048,1984.
[3]Iannella,V.;process for the preparation ofL-Carnitine hydrochloride and ofL(-)Carnitine inner salt[P].EP:141 408,1985.
[4]Kikuchi,H.:DE 3 536 093,1986.
[5]Kato,G.;Hosein,E.A.:Synthesis ofisomers ofacetylcarnitylcholine and other carnitine derivatives[J].Can.J.ofChem.,1969,47:1177-1187.
[6]Morishita,T.:Kawamura,M.;Akutsu,S.,et al.JP:62 286 959,1987.
[7]Müller,D.M.;Strack,E.;Lorenz,I.:racematsplaltungvonD,L-Camphersulfonsaure[J].J.Prakt.Chem.,1975,317(4):689-693.
[8]Voeffray,R.;Perlberger,J.C.;Tenud,L.:L-Carnitine.NovelSynthesis and Determination of the Optical Purity[J].Helv Chem.Acta,1987,70:2058-2064.
[9]张红素.L- 肉毒碱的合成与应用[J].贵州化工,2001,26(4):15-17.
[10]Schaus,S.E.;Brandes,B.D.;Larrow,J.F.;et.al.Highlyselective hydrolytic kinetic resolution of terminal epoxides catalyzed by chiral(salen)Cocomplexes[J].J.Am.Chem.Soc.,2002,124(7):1307-1315.
[11]沈大冬,朱锦桃.L-(-)-肉碱的合成[J].中国医药工业杂志,2006,37(12):801-802.
[12]Giannessi,F.;Bolognesi,M.L.;Tinti,M.O.,et al.process for manufacturing L- (-)-Carnitine from a waste product having opposite configuration[P].CA:2 111 898,1994.
[13]胥波,程国侯.R-卡尼丁的合成和改进[J].化学世界,2000,(9):459-472.
[14]AnnisDA,JacobsenEN.,Polymer-supportedchiralco(salen)complexes:Synthetic applications and mechanistic investigations in the hydrolytic kinetic resolution of terminal epoxides[J].J.Am.Chem.Soc.,1999,121(17):4147-4154.
[15]Kureshy,R.I.;Singh,S.;Khan,N.U.H.;et.al.improved catalytic activity of homochiral dimeric Cobalt-Salen Complex in hydrolytic kinetic resolution of terminal racemic epoxides[J].Chirality,2005,17:590-594.
[16]Ready,J.M.;Jacobsen,E.N.Apractical oligomeric[(salen)Co]catalyst for asymmetric epoxide ring-opening reactions[J].Angew Chem.Int.Ed.,2002,41(8):1374-1377.
[17]White,D.E.;Jacobsen,E.N.Newoligomeric catalyst for the hydrolytic kinetic resolution of terminal epoxides under solvent-free conditions[J].Tetrahedron:Asymmetry,2003,14(22):3633-3638.
[18]卢定强,涂清波,凌岫泉,等.手性环氧氯丙烷的制备及其药物应用[J].有机化学,2009,29(8):1209-1216.
[19]王朝阳,王燕,宋光伟,等.合成左旋和右旋叉甘油醇的新方法[J].应用化学,2008,25(11):1375-1377.
[20]Choi,W.J.;Huh,E.C.;Park,H.J.;et al.kinetic resolution for optically activeepoxidesbymicrobialenantioselectivehydrolysis[J].BiotechnolgyTechniques,1998,12(3):225-228.
[21]Kim,H.S.;Lee,J.H.;Park,S.;et al.biocatalytic preparation of chiral epichlorohydrins using recombinant pichia pastoris expressing eoxidehydrolaseofrhodotorula glutinis[J].Biotechnologyand Bioprocess Engineering,2004,(9):62-64.
[22]许辉辉,陈月圆,胡忠策,等.手性拆分环氧氯丙烷菌株的筛选、鉴定及产酶条件研究[J].微生物学杂志,2009,29(2):33-38.
[23]Kabat MM,Daniewski A R,Burger W.A convenient synthesis of R-(-)-carnitine from R-(-)-epichlorohydrin[J].Tetrahedron:Asymmetry,1997,16(8):2663-2665.
[24]Paolo Casati,M.;Claudio Puganti,M.:process for the preparation of L-Carnitine[P].US:4 664 852,1987.
[25]李全,黄锐,李万亥,等,左旋肉毒碱盐酸盐新的合成方法[J].中国药物化学杂志,1995,5(4):276-278.
[26]Jung,M.E.;Shaw,T.J.:total synthesis ofR-Glycerol Acetonide and the Antiepileptic and Hypotensive Drug(-)-r-Amino-B-hydroxybutyric Acid(GABOB):Use of Vitamin C as a Chiral Starting Material[J].J.Am.Chem.Soc.,1980,192:6304-6311.
[27]Bock,K.;Lundt,I.;Pedersen,C.:SynthesisofS-andR-4-Amino-3-hydroxybutyric Acid(GABOB)and S-and R-Carnitine fromArabinoseorAscorbicAcid[J].Acta.Chem.Scand.,1983,B37(4):341-344.
[28]Bellamy,F.D.;Bendoux,M.;Dodey,P.:A newshort and efficient synthesis of both enantiomers of carnitine[J].Tetrahedron Lett.,1990,31(50):7323-7326.
[29]Kitamura,M.,Ohkuma,T.,Takaya,H.;et al.A practical asymmetric synthesisofcarnitine[J].TetrahedronLett.,1988,29(13):1555-1556.
