G蛋白偶联受体56胞外端融合蛋白的表达、纯化及其多克隆抗体的制备①
2011-02-06赵去非韩红辉刘俊晨潘新华钱杜
赵去非 韩红辉 刘俊晨 潘新华 汪 磊 钱杜 冰
(华东师范大学生命医学研究所,上海 200241)
G蛋白偶联受体56胞外端融合蛋白的表达、纯化及其多克隆抗体的制备①
(华东师范大学生命医学研究所,上海 200241)
目的:制备G蛋白偶联受体56(G protien-coupled recepter 56,GPR56)的高效抗体,为其功能及分子机制的深入研究提供灵敏、高效的免疫学检测工具。方法:以肝癌细胞株MHCC-97H的cDNA为模板,利用PCR技术扩增GPR56 N端序列(661~1 073 bp),并构建重组表达载体pGEX4T-1-GPR56N。阳性克隆经酶切、测序鉴定正确后,转化大肠杆菌BL21进行诱导表达。表达产物经Western blot初步鉴定后,用GST磁珠分离纯化,纯化后蛋白与免疫佐剂混合直接免疫家兔制备抗血清。阳性血清用ELISA、Western blot、免疫组织化学等技术对细胞或组织中的GPR56进行鉴定和分析。结果:成功构建重组表达载体pGEX4T-1-GPR56N,GPR56N与GST的融合蛋白(GST-GPR56)在原核系统中进行了高效的可溶性表达,制备的兔抗人GPR56抗体经Western blot和免疫组织化学分析结果表明,该抗体可同时对人源性和鼠源性的GPR56进行特异性检测。结论:成功对GPR56蛋白N端序列进行了原核表达和纯化,制备的抗GPR56多克隆抗体具有较高的特异性,为GPR56功能及分子机制的深入研究奠定了坚实的基础。
GPR56;GST;原核表达;多克隆抗体
G蛋白偶联受体(GPCRs)是真核生物中最大的一类跨膜受体家族,目前已报道的GPCRs多达2 000余种。这些结构各异功能丰富的GPCRs通过与相应的配体结合,能够将细胞外的各种生物信息跨膜传递到细胞内,引起细胞内相应信号通路的变化,最终完成对细胞生理功能的调节,从而引起包括细胞生长、分化、凋亡、迁移以及肿瘤等生长在内的一系列生物学功能[1,2]。其中,G蛋白偶联受体超家族中粘附亚家族所含成员超过30个[3],该家族有以下两个特点:①胞外段即N端很长,含有很多不同的功能区域;②具有富含半胱氨酸的GPCR水解位点(简称GPS)。因此,G蛋白偶联受体粘附亚家族在细胞间的粘附,以及细胞基质与细胞内的信号转导过程中发挥了非常重要的作用[4,5]。
GPR56是GPCRs粘附家族中的重要成员之一,属于GPCRs中类分泌素家族。它除了具有粘附家族成员普遍具有的特征之外,在胞外区段还含有一个类粘蛋白功能域。近期对GPR56功能研究表明,它可能在人体机能紊乱、肿瘤发生等疾病中发挥重要作用。最新研究发现,GPR56在迁移性黑色素瘤中的表达下调,通过相关的体内实验证明,GPR56对黑色素瘤的生长和转移有明显的负调控作用[6,7]。
本文通过PCR的方法从人cDNA文库中克隆出GPR56N端约400 bp大小的基因片段,并将其连入表达载体进行原核表达,融合蛋白经蛋白纯化后免疫家兔得到多克隆抗体,制备得到的阳性血清可用于Western b lot、免疫组织化学等技术,能够同时对人类和小鼠来源的细胞和组织中的GPR56进行特异性检测,为GPR56的功能和作用机制的深入研究提供了良好的研究工具。
1 材料与方法
1.1 主要试剂和仪器 rTaq酶、4×dNTP预混液、限制性内切酶SalⅠ、SacⅠ、NotⅠ、T4DNA连接酶均购自大连宝生物工程有限公司。pGEX4T-1,大肠杆菌DH5α和BL21菌株为本实验室保存。琼脂糖凝胶DNA回收试剂盒、质粒DNA小量提取试剂盒购自天根生物公司。基因测序和引物合成由上海博尚生物技术有限公司完成。异丙基硫代-β-半乳糖苷(IPTG)购自德国Merck公司。弗氏佐剂购自美国Sigma公司。ELISA试剂盒购自美国BD生物公司。人 肝 癌 细 胞 株 Huh-7、SMMC-7701、MHCC97L、MHCC97H、SK-Hep1、BEL-7402等均购自中国科学院上海细胞库。GPR56标准抗体购自Abcam(ab77515)。临床组织芯片购自上海芯超生物科技有限公司。
1.2 方法
1.2.1 GST-GPR56重组蛋白的表达、纯化及鉴定根据NCBI提供的GPR56的DNA序列,应用生物信息学软件primer5.0设计上下游引物,扩增人源GPR56基因中661~1 073 bp片段。其上游引物及下游引物均设计为SalⅠ酶切位点,上游引物为5′-GCACCAGGAGGAGAGCCTGGCTCAG-3′,下游引物为5′-CGCTCTGCTCCTCCTCCTGCCGGGA-3′。 以肝癌 细胞MHCC-97H的cDNA为模板进行PCR扩增,PCR扩增条件为:94℃预变性5分钟;94℃变性30秒,55℃退火30秒,72℃延伸 45秒 (30个循环);72℃再延伸8分钟。琼脂糖凝胶电泳并回收扩增的目的片段。回收片段及pGEX4T-1载体经SalⅠ酶切后,以适当比例将目的片段与载体连接并转化大肠杆菌DH5α,阳性克隆经测序证明插入片段序列正确后抽提质粒,转化大肠杆菌BL21。400 ml低钠LB中加入2.5ml活化菌液,摇至OD600在0.4~0.6。加诱导剂IPTG(0.5mmol/L),低温25℃诱导表达6小时。取大量表达后的菌液4℃4 000 r/min离心15~30分钟;加含PMSF(终浓度 0.2 nmol/L)的 PBS 10m l重悬菌体,超声破碎后,加0.5%Triton X-100,4℃混合30分钟,12 000 r/min离心30分钟,将上清与GST磁珠混合,4℃孵育2小时。用含 0.1%Triton的PBS洗磁珠(洗掉非特异吸附),4℃冰箱混合10分钟,3 000 r/min离心5分钟,重复洗四次,最后一次离心留少许上清。用谷胱甘肽洗脱液洗脱。取GST蛋白和GST-GPR56融合蛋白各2μl,SDS-PAGE电泳后用抗GST抗体检测目的蛋白。
1.2.2 兔抗GST-GPR56N融合蛋白抗体的制备将一定量重组GPR56N-GST融合蛋白与等体积弗氏完全佐剂充分混匀并乳化后,每只家兔皮下多点注射500μg,4周后剂量减半进行再次免疫(不完全佐剂),4周后同样条件加强免疫,1周后颈动脉取血,血浆于37℃放置2小时,4℃沉淀过夜后,离心分离血清,分装后置-20℃保存。
1.2.3 兔抗人GPR56N抗体效价的测定 ELISA检测GPR56抗血清效价:检测板用GST-GPR56融合蛋白(1mg/L)包被,每孔100μl,4℃过夜。每孔加入200μl封闭液,37℃封闭2小时。每孔加入100μl以1∶4梯度稀释的抗血清(阴性对照为正常兔血清,空白对照为封闭液),37℃孵育30分钟。加入HRP标记羊抗兔IgG,37℃孵育30分钟。TMB显色后,酶标仪以450 nm波长读值。
1.2.4 兔抗人GPR56融合蛋白抗体特异性的Western blot分析 将含有hGPR56胞外段序列的真核表达质粒和对照空质粒(pCDNA3.1)脂质体法转入293T细胞,使其在293T细胞中过表达,收集细胞后加入适量SDS上样buffer,100℃煮沸十分钟,经SDSPAGE分离,并转移至PVDF膜上,以3%脱脂奶粉于室温封闭1小时后,加入1∶1 000稀释的兔抗GPR56融合蛋白抗血清,室温温育2小时,以PBST室温洗膜3次,每次 10分钟,之后,加入 1∶2 000稀释的HRP标记的羊抗兔IgG作为二抗温育1小时,洗膜3次,每次10分钟。显影曝光。
1.2.5 兔抗人GPR56抗体的免疫组织化学分析将人肝癌临床组织芯片样品和BALB/c模型小鼠动脉血管组织石蜡切片,常规脱蜡,置0.01mol/L柠檬酸盐缓冲液(pH 6.0)中抗原修复,分别滴加0.3%H2O2甲醇溶液,室温避光孵育10分钟,经BSA封闭后,用制备的抗GPR56多抗湿盒内孵育30~60分钟,洗片,显微镜下控制DAB显色(2~5分钟),自来水冲洗25分钟,苏木精复染,封片,镜检、观察。
2 结果
2.1 原核表达载体pGEX4T-1-GPR56的构建与鉴定经PCR扩增得到GPR56N端片段(661~1 073 bp)大小约为400 bp(图1)。目的片段经SalⅠ酶切后,连入pGEX-4T-1质粒,并转化DH5α。抽提质粒后采用目的片段781位置上SacⅠ和载体中NotⅠ位点进行酶切,酶切片段大小为300 bp左右。如图2中质粒1、2为阳性克隆,与预期大小一致。
2.2 融合蛋白GST-GPR56的诱导表达及表达形式分析 经测序鉴定正确的质粒,转化BL21后IPTG诱导4小时,超声破碎后用GST磁珠纯化可溶性融合蛋白。表达出的GST、GPR56 N端融合蛋白分子量约为41 kD。GST抗体Western blot(图3)检测目的蛋白,结果表明融合蛋白分子量与预期基本一致。
2.3 ELISA检测兔抗人GPR56抗体效价 用重组GPR56N-GST蛋白包被检测板,ELISA检测兔抗人GPR56血清的效价为1∶10 000,Western blot分析中有效的稀释比例为1∶1 000。
2.4 Western blot检测兔抗人GPR56抗体特异性与对照未转入GPR56N的细胞(图4,泳道2)相比,转入pEGFP-N2-GPR56质粒的293T细胞(图4,泳道1),经我们制备的抗体检测,在40 kD左右明显出现一条特异性的蛋白条带,其分子量与GPR56N端融合蛋白预期大小基本一致,表明抗体对GPR56的特异性结合能力(图4)。

图1 GPR56 N端片段PCR扩增结果Fig.1 PCR amplification of GPR56 N-term inal
2.5 兔抗人GPR56抗体检测不同肝癌细胞系中GPR56的表达 收集人肝癌细胞系Huh-7、SMMC-7701 、MHCC97L 、MHCC97H 、SK-Hep1 、BEL-7402 的细胞裂解物,利用所制备的抗体进行Western blot检测时发现,不同肝癌组织中GPR56的表达出现明显差异(图5),且所示条带与所购买的商业化GPR56抗体(Abcam)的检测结果基本一致。
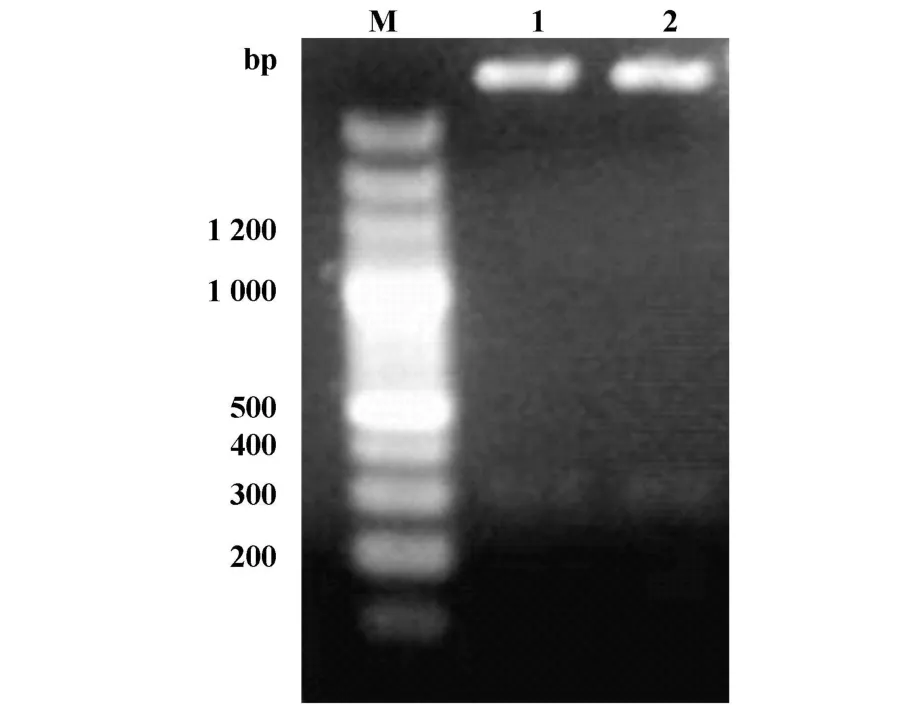
图2 pGEX4T-1-GPR56N酶切检测Fig.2 Identification of recombinantp lasmid pGEX4T-1-GPR56N

图3 GPR56N端融合蛋白Western blot分析Fig.3 W estern blot analysis for GPR56N term inal fusion p roteins

图4 兔抗人GPR56抗体鉴定Fig.4 Identification of the rabbit anti-GPR56 polyclonal antibody by Western b lot

图5 多克隆抗体anti-GPR56识别不同细胞系中的GPR56蛋白Fig.5 Identification of endogenous GPR56 from different cell lines using polyclonal antibody anti-GPR56
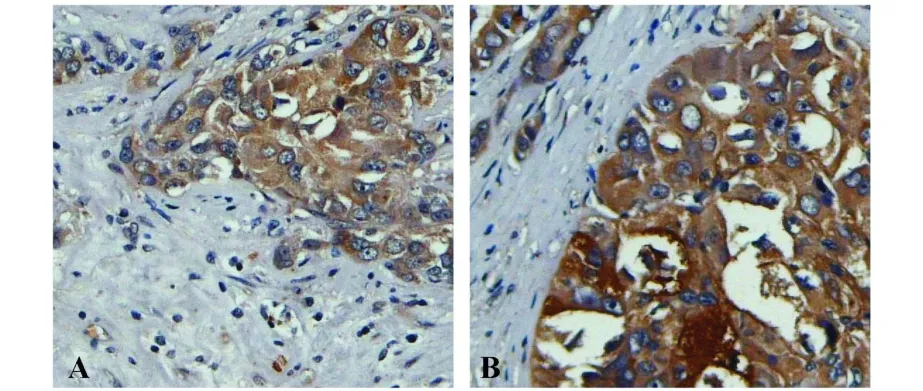
图6 GPR56抗体对肝癌临床组织芯片中的人源性的GPR56的检测Fig.6 Immunohistochemistry analysis exp ression of GPR56 in liver cancer tissuem icroarray using polyclonalantibody anti-GPR56
2.6 兔抗人GPR56抗体检测临床组织芯片中GPR56的表达 为进一步验证该自制兔抗人GPR56的有效性,我们选取自制抗体与购买的GPR56抗体,对肝癌临床组织芯片中人源性的GPR56进行了检测(图 6)。从图中可知,我们自制的兔抗人GPR56抗体(图6B)与购买的GPR56抗体(图6A)在组织切片中的着色部位基本相同,证明我们所制备的兔抗人GPR56抗体的特异性。
2.7 免疫组织化学检测GPR56在鼠动脉血管中的表达 利用RT-PCR的方法我们也发现GPR56在血管内皮细胞中表达丰富(图7),并有数据表明,人、小鼠和大鼠中GPR56的同源性达到88%。因此,我们取小鼠动脉血管,用免疫组化的方法检测小鼠血管中鼠源GPR56的表达情况(图 8)。同样发现GPR56在小鼠动脉血管中的表达较为丰富,提示我们GPR56可能在血管新生和发育过程中扮演着重要角色。

图7 GPR56在内皮细胞中的表达Fig.7 Expression of GPR56 in endothelial cell

图8 免疫组化检测GPR56在鼠动脉血管中的表达Fig.8 Immunohistochem istry analysis expression of GPR56 in mouse arterial blood vessel using polyclonal antibody anti-GPR56
3 讨论
大约40%~50%的临床药物都以GPCRs为治疗靶点,因此对于GPCRs功能及分子机制的研究已经成为了目前的热点[8]。GPCRs粘附家族作为其重要的家庭成员,其功能受到越来越多的关注,然而到目前为止大部分家庭成员,尤其是一些孤儿受体的功能仍不清楚。GPR56是近年研究较多的粘附家族成员之一,目前已发现其在肿瘤发生、恶化过程中发挥了至关重要的作用。有文献报道,GPR56的作用机制是通过与细胞表面的CD9/CD81形成一个多分子复合体,从而发挥作用[9]。最近证实,一种普遍表达的细胞外基质蛋白转谷氨酰胺酶(TG2)可能为GPR56的配体。有文献证明,TG2能够抑制血管新生和肿瘤生长,TG2被敲除的小鼠更容易发生肿瘤,它能与整合素、纤维连接蛋白等基质蛋白形成大的复合物,从而抑制肿瘤生长和迁移[10-13]。因此开展对GPR56详细功能机制的研究具有十分重要的理论价值和应用前景。
抗体在蛋白质检测及功能研究中都有着广泛的应用,制备高效价的抗体是研究基因表达及其功能的重要工具。又由于G蛋白偶联受体是一种具有7次跨膜结构的细胞膜蛋白,且胞外端结构复杂并伴随有较高程度的糖基化修饰,同时胞外端的结构还起到了识别特异性配体的作用,因此这些G蛋白偶联受体的特殊结构造成了其抗体制备的困难。本文以GPR56蛋白N端为目标,在原核表达系统中重组表达了GPR56-GST融合蛋白,并以该蛋白为免疫原,成功制备了特异性高和效价良好的兔抗人GPR56多克隆抗体。该抗体可同时识别内源性及外源性的GPR56,并能够用于 ELISA、Western blot以及免疫组织化学的检测,为今后深入研究GPR56的表达分布、细胞内定位及其与其它蛋白质间的相互作用提供了一个有用的检测与鉴定工具。由于小鼠和人GPR56蛋白具有一定的同源性,免疫组织化学染色显示该多抗不仅能够识别人源性GPR56,还能够识别小鼠体内GPR56,可用于对小鼠组织GPR56蛋白表达和定位研究,具有比较广泛的应用价值。该抗体的获得不仅能够解决GPR56蛋白检测的问题,还可能对相应配体结合机制的研究提供帮助,具有重要的应用前景,同时为进一步研究GPR56在多种疾病发生、发展过程中的作用和分子机制提供了必要的工具。
1 Bockaert J,Pin JP.Molecular tinkering of G protein coupled receptors:an evolutionary success[J].EMBO,1999;18:1723-1729.
2 Pierce K L,Premont R T,Lefkowitz R J.Seven-transmembrane receptors[J].Nat RevMolCell Biol,2002;3:639-650.
3 Fredriksson R,Gloriam D E,Hoglund PJetal.There existat least 30 human G-protein coupled receptors with long Ser/Thr-rich N-termini[J].Biochem Biophys Res Commun,2003;301:725-734.
4 Hayflick JS.A family ofheptahelical receptorwith adhesion-like domains:amarriagebetween two super fam ilies[J].Recept Signal Transduct Res,2000;20:119-131.
5 Van Lier RA,EichlerW,Hamann Jetal.The sevenspan trnasmembrane receptor CD97 has a cellular ligand(CD55,DAF)[J].Exp Med,1996;184:1185-1189.
6 Shashidhar S,Lorente G,Nagavarapu Uetal.GPR56 is a GPCR that is overexpressed in gliomas and functions in tumor cell adhesion[J].Oncogene,2005;24:1673-1682.
7 Xu L,Begum S,Hearn JDetal.GPR56,an atypicalG protein-coupled receptor,binds tissue transglutaminase,TG2,and inhibitsmelanoma tumor growth and metastasis[J].Proc Natl Acad Sci USA,2006;103:9023-9028.
8 Fredriksson R,Schioth H B.The repertoire of Gprotein coupled receptors in fully sequenced genomes[J].Mol Pharmacol,2005;67:1414-1425.
9 Little K D,HemlerM E,Stipp CSetal.Dynam ic regulation of a GPCR-tetraspanin-G protein complexon intact cells:central roleofCD81 in facilitating GPR56-Galphaq/11association[J].MolBiolCell,2004;15:2375-2387.
10 Lorand L,Graham R M.Transglutaminases:crosslinking enzymes with pleiotropic functions[J].Nat Rev Mol CellBiol,2003;4:140-156.
11 Iismaa SE,BeggG E,Graham RM.Cross-linking transglutaminaseswith G protein coupled receptor signaling[J].SciSTKE,2006;353:34-36.
12 Akimov SS,Krylov S,Fleischman LFetal.Tissue ransglutaminase isan integrin-binding adhesion coreceptor for ibronectin[J].JCell Biol,2006;148:825-838.
[收稿2010-11-29 修回2011-01-27]
(编辑 许四平)
Expression,purification and polyclonal antibody p reparation of G protein-coupled receptor 56(GPR56)extracellular domain fusion protein
ZHAOQu-Fei,HANHong-Hui,LIUJun-Chen,PANXin-Hua,WANGLei,QIANMin,DUBing.EastChinaNormal University,InstituteofBiomedicalScience,Shanghai200241,China
Objective:To prepare ahigh efficacious and sensitive polyclonal antibody against the N-terminal of human G protein-coupled receptor 56(GPR56)for the further functionalassay.Methods:The cDNA of human liver cancer cell line MHCC-97H was used as the templateto amplify the N-terminal of GPR56 by PCR.Then the target gene was cloned into pGEX4T-1 to construct recombinant plasmid pGEX4T-1-GPR56N.After enzyme analysis and sequencing,the vector was transformed into E.coli BL21 and induced by IPTG.Finally,the GPR56 and GST fusion proteinwas purified by GSTbeads to prepare the rabbitantiGPR56 polyclonalantibody.And the specificity of antibody was appraised by Western blotand immunohistochemistry assay.Results:The recombinant protein GST-GPR56N was expressed successfu lly in E.coli.Western blotand immunohistochem istry analysis demonstrated that the polyclonal antibody can recognize the overexp ressed or endogenousGPR56 specifically both in human andmouse tissues.And the titer of anti-GPR56 polyclonalantibody inWestern blotting assaywas about 1∶1 000.Conclusion:The fusion protein GPR56-GST was highly expressed in prokaryotic system.And the antibody was proven to have high titer and good specificity for the study of GPR56.
GPR56;GST;Prokaryotic expression;Polyclonal antibody
R392.33
A
1000-484X(2011)05-0450-05
10.3969/j.issn.1000-484X.2011.05.016
①本文受上海市科委生物医药领域重点科技攻关专项(09JC1405200)和中央高校基本科研业务费专项资金资助
赵去非(1985年-),女,生物医学硕士;
及指导教师:杜 冰(1979年-),男,博士,讲师,主要从事免疫学方面的研究,E-mail:bdu@bio.ecnu.edu.cn。
·临床免疫学·