3种口腔修复金属材料表面白色念珠菌早期黏附的实验研究
2011-02-02崔凌云张玉梅
崔凌云,张玉梅,黄 萍
(第四军医大学口腔医学院,陕西西安 710032)
3种口腔修复金属材料表面白色念珠菌早期黏附的实验研究
崔凌云,张玉梅,黄 萍
(第四军医大学口腔医学院,陕西西安 710032)
目的:比较镍铬合金、钴铬合金和纯钛3种口腔修复常用的金属表面对白色念珠菌早期黏附的影响。方法:在对镍铬合金、钴铬合金和纯钛3种金属试样表面能测试的基础上,进行体外白色念珠菌黏附实验。采用菌落形成计数法测定试样表面在1、3、24 h的细菌黏附量,采用荧光染色法观察材料表面死菌与活菌比例。结果:镍铬合金、钴铬合金、纯钛的表面能分别为,36.6、34.04、48.09 mJ/m2。纯钛组表面各时间点的细菌黏附量均少于镍铬合金组和钴铬合金组,其表面的死菌比例也明显大于其他两组。结论:纯钛与镍铬合金和钴铬合金相比表面黏附的白色念珠菌量明显较少,从而减少义齿修复后义齿性口炎并发症的产生。
修复材料;白色念珠菌;细菌黏附;表面自由能;激光共聚焦扫描显微镜
[牙体牙髓牙周病学杂志,2011,21(2):90]
[Chinese Journal of Conservativedentistry,2011,21(2):90]
随着口腔修复技术的发展,镍铬合金、钴铬合金 和纯钛等金属材料在口腔内的应用越来越广泛。口腔环境中存在的多种微生物之间保持着微妙的菌群平衡,当环境发生改变时,有些菌群就会大量繁殖,导致口腔疾病的发生,其中以白色念珠菌和热带念珠菌的致病性最强。口腔内细菌黏附到牙齿、口腔黏膜、义齿材料表面的能力有很大差异。修复体材料表面黏附细菌会造成义齿性口炎、龋病和牙周病等修复后常见的并发症,对于老年人和免疫力低下的人群,会造成严重的全身感染[1-6]。所以,义齿修复后材料表面细菌黏附性就显得尤为突出。修复体戴入口腔内短时间就会黏附细菌并且形成生物膜,而早期的细菌黏附对以后的细菌增殖有很大影响。本研究观察了3种修复金属表面24 h内的白色念珠菌黏附性,为临床合理选择提供依据。
1 材料和方法
1.1 材料和仪器
镍铬合金(Stellite N9镍基铸造合金)、钴铬合金(Stellite C3钴基铸造合金)(上海司太立有限公司);商业纯钛(TA2,西北有色金属院提供);白色念珠菌、沙氏培养基、PBS缓冲液(第四军医大学口腔医学院检验科提供)超声清洗器(VITA公司,德国);接触角测定仪(EasyDrop Standard,KRUSS,德国);AO/EB(吖啶橙/溴化乙锭)染色剂(北京拜尔迪生物技术有限公司);激光共聚焦显微镜(FV1000,OLYMPUS,日本)。
1.2 实验方法
1.2.1 试件制作
常规包埋、铸造并线切割镍铬合金、钴铬合金、纯钛成为10 mm×10 mm×1 mm大小试样,按照600、800、1 000、1 200、1 500 目碳化硅水磨金相砂纸顺序抛光。以10 mm×10 mm盖玻片为对照组,所有试样均依次使用丙酮、无水乙醇和蒸馏水超声清洗各15 min,高温高压消毒后备用。
1.2.2 接触角及表面能测定
随机选取镍铬合金、钴铬合金和纯钛试样,置于EasyDrop Standard接触角测量系统置物台,分别用水和甘油采用滴液法测量试件表面的接触角并计算表面自由能。
1.2.3 菌液配制
取白色念珠菌菌种接种于沙氏琼脂培养平板,于37℃普通培养箱有氧环境培养24 h。挑取培养平板表面的菌落置于沙氏液体培养基中,摇匀后使用酶标仪确定菌液浓度为1.0×107CFU/mL。
1.2.4 细菌黏附实验
取镍铬合金、钴铬合金和纯钛试样各19个,分别置于1 mL菌液中,培养1、3、24 h后,每个时间点各取出6个试样,PBS漂洗后置于1 mL PBS中超声振荡1 min,将振荡后的PBS倍比稀释1 000倍后,涂培养平板,进行菌落计数。
1.2.5 荧光染色
在24 h随机取出1个试样,进行AO/EB染色剂染色15 min后,置于激光共聚焦显微镜下观察死菌活菌比例。
1.3 统计分析
采用SPSS 17.0统计软件对试样表面接触角的测量值及试样上黏附的菌落数进行单因素ANOVA统计分析,检验水准α=0.05。
2 结果
2.1 材料表面接触角及表面能(表1)
记录室温下水和甘油在3种试样表面的接触角并计算自由能。
表12 种液体在试样表面的接触角和自由能(±s)

表12 种液体在试样表面的接触角和自由能(±s)
试样 接触角(°)表面自由能(mJ/m2)总表面能 极性分量 色散分量镍铬合金水甘油68.12 ±2.28 58.76 ±1.10 36.6 20.04 6.19钴铬合金 84.82 ±1.72 68.12 ±5.51 34.04 30.17 2.95纯钛51.28 ±5.92 48.21 ±1.82 48.09 14.18 2.93
2.2 细菌黏附率结果
统计培养1、3、24 h后试样表面的菌落数。计算3种材料表面细菌黏附率,计算公式如下。
随着培养时间的延长,各组试样表面的细菌黏附率都有不同程度的增长。在各个时间点内纯钛表面的细菌黏附率都明显少于镍铬合金和钴铬合金表面(P<0.05)。而在1 h时,钴铬合金表面的细菌黏附率大于镍铬合金(P<0.05),在3 h和24 h时,镍铬合金表面的细菌黏附率和钴铬合金没有明显差异(P>0.05),在3个时间点内,3种材料表面的细菌黏附率均低于16%(图1)。

图1 各组试样于菌液中培养1、3、24 h时的白色念珠菌黏附百分率
2.3 荧光染色观察
将在菌液内培养24 h的试样经过AO/EB荧光染色剂染色后,在激光共聚焦显微镜下观察,绿染的为活菌,红染的为死菌。可见在镍铬合金表面的白色念珠菌生长比较舒展,菌丝量多且长,死菌比例较小(图2a);在钴铬合金表面生长的白色念珠菌个体略多于镍铬合金,但菌丝量稍少,死菌比例大于镍铬合金(图2b);纯钛表面的白色念珠菌黏附量明显少于其他2组,细菌生长状况一般,仅见少量菌丝,且死菌比例较高(图2c)。
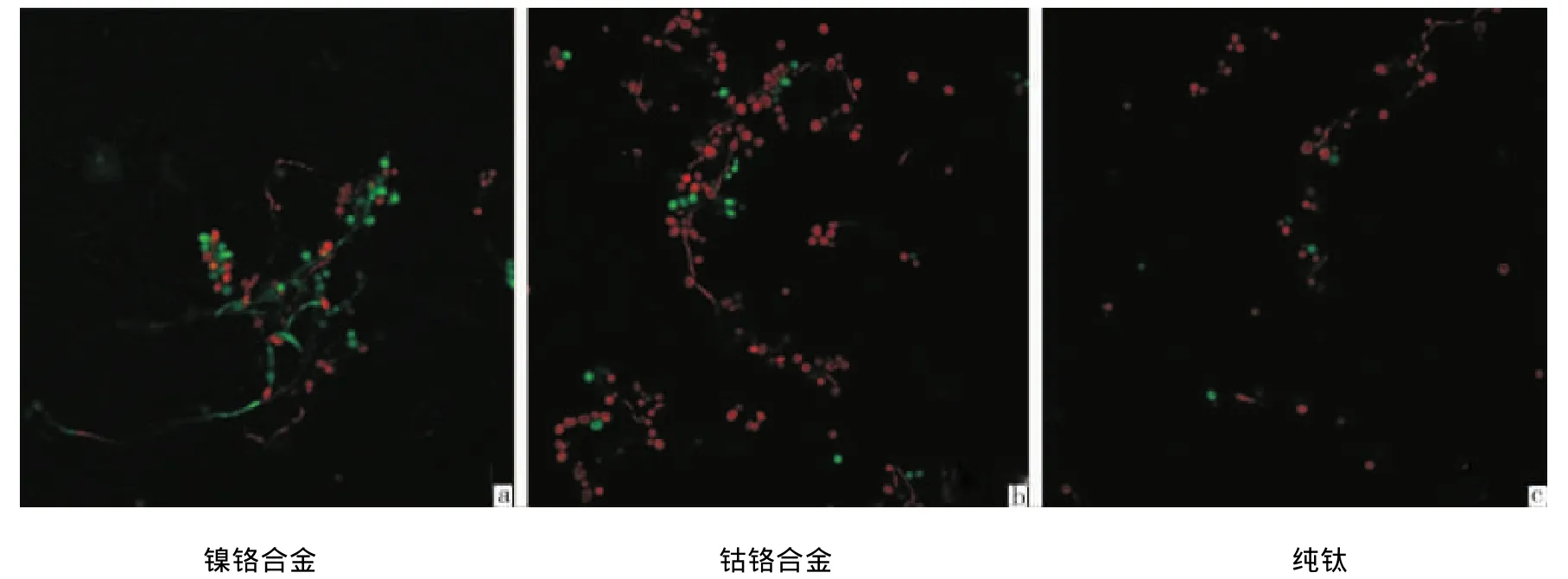
图2 3种金属表面白色念珠菌黏附24 h后荧光染色照片(×40)
3 讨论
口腔是一个多种微生物共存的菌群平衡环境,修复体的戴入会引起微环境的改变,有些菌群就会大量繁殖,引起各种口腔疾病的发生[2]。念珠菌作是口腔常驻菌群,在健康老年人口腔内检出率高达59%[7]。因此本实验选择口腔内最常见的白色念珠菌作为研究菌株。
细菌黏附到材料表面是一个复杂的过程,可以分作4个期:第1期细菌借助布朗运动,沉积或液体流动到达牙面或修复体表面;第2期细菌靠物体分子间的引力、表面自由能和表面电荷等作用,附着到牙面或材料表面;第3期细菌借助本身产生物质和由宿主来的物质比较牢固地黏附于牙面或材料表面;第4期黏附细菌生长、繁殖形成牙菌斑[8]。材料的表面性状如表面成分及表面自由能等与细菌黏附的难易程度密切相关。
表面自由能是判断分子间或界面间相互吸引力的直接指标之一,然而关于表面自由能在细菌黏附过程中的作用尚无定论。在细菌的早期黏附过程中,一般认为,表面自由能低的细菌易于与表面自由能低的物体表面结合,反之亦然[9]。Weerkamp等[10]发现口腔中存在的大部分细菌都有较高的表面自由能。在Nejadnik等学者研究牙釉质和羟基磷灰石的表面时观察到,酸性氟化物可升高釉质的表面自由能,而唾液降低釉质表面自由能,即表面自由能的下降有利于细菌黏附[11]。同样,李鸣宇等也认为,氟化物是通过升高牙釉质的表面自由能来达到影响细菌黏附的效果[12]。Chen等(2006)在实验中发现,接触角大的材料表面黏附的细菌量大于接触角较小的材料[13]。我们认为造成对表面自由能对细菌黏附影响不一的原因,很可能和材料不同相关。
本结果显示3种材料接触角的排序是:纯钛<镍铬合金<钴铬合金。自由能的大小顺序则相反:纯钛>镍铬合金>钴铬合金。与此同时,细菌黏附率结果显示:纯钛<镍铬合金<钴铬合金。由此可见,接触角越大,自由能越小的金属材料,表面越利于细菌黏附。
Chandra等[14]认为,白色念珠菌生物膜的形成分为早、中、晚三个阶段。早期为0~11 h,以微菌落的形成为代表,0~2 h为初始阶段,以胞体散在分布为主,3~4 h可形成微菌落,形成早期的生物膜,之后微菌落逐渐增多,12~30 h,生物膜基本完成,30~72 h,形成成熟的生物膜。有学者认为,白色念珠菌的生物膜呈三维立体结构,其构架中需要菌丝态的白色念珠菌互相沟通,并且认为白色念珠菌的生物膜中存在负荷感应系统,该系统通过细菌胞体间信号影响,高浓度的成熟生物膜上清液可以抑制白色念珠菌从酵母态向菌丝态转化[15]。
本研究中也同样观察到,在1 h阶段,材料表面形成的菌量较少,至3 h阶段,菌量明显增加,24 h时黏附在材料表面的菌量基本呈稳定状态,说明口腔内细菌在3 h即完成早期黏附。从24 h荧光染色后的图片可以观察到,镍铬合金组表面的白色念珠菌菌丝态明显,并且菌丝呈活菌状态,生长状况良好(图2a);钴铬合金组的死菌活菌总量均较多,该试样表面也有部分白色念珠菌呈现菌丝态(图2b);但纯钛试样表面的白色念珠菌菌量总数较少,并且未观察到明显的菌丝(图2c),因此钛表面可抑制白色念珠菌的黏附,并且减缓了白色念珠菌生物膜的形成。而综合3种材料的细菌黏附率来看,3种材料在24 h之内,黏附率最高不超过16%,可以认为3种材料都较好地延缓细菌黏附。
纯钛在室温下,其表面就可以很快形成一层致密的氧化膜[16],该成分中的TiO2具有良好的抗菌效果。TiO2是一种半导体结构,其能带结构由充满电子的低能满带和没有电子的高能空带组成,满带和空带之间的禁带宽度为带隙能。当光辐射TiO2时,满带上的电子被激发到空带上,满带上即形成空穴,从而满带和空带上分别形成了高活性的带正电荷的光生空穴和带负电荷的光生电子,电子和空穴产生强烈的氧化还原反应,即电子-空穴对,其对表面黏附的细菌直接发生化学反应,破坏细菌的细胞壁膜,电子 -空穴对还可对表面的H2O、OH-以及 O2反应,生产羟基等自由基[17]。自由基与细胞壁、细胞膜的组成成分发生生化反应,破坏细菌结构,从而起到杀菌的作用[18]。
综上所述,纯钛较镍铬合金和钴铬合金具有更好的抗细菌黏附特性,这可能与其较高的表面自由能以及其表面的TiO2成分有关。从避免和减少修复后因细菌产生的并发症发生的方面考虑,临床修复体选用纯钛材料优于选取镍铬合金和钴铬合金。
[1]Quiynen M,DE Soete M,VAN Steenberghed.Infectious risks for oral implants:a review of the literature[J].Clin Oral Implants Res,2002,13(1):1 -19.
[2]周琳.Parylene涂敷技术用于赝复硅橡胶表面改性的研究[D].第四军医大学硕士学位论文,2010.
[3]李笑梅.口腔修复材料的表面粗糙度及表面自由能对微生物黏附的影响[J].第二军医大学学报,2001,22(5):487-489.
[4]赵英姿,肖纯凌,宫雁冰,等.口腔白色念珠菌与龋病流行因素的相关性分析[J].广东牙病防治,2010,18(9):479-483.
[5]Kimura LH,Pearsall NN.Adherence of Candida albicans to human buccal epithelial cells[J].Infect Immun,1978,21(1):64-68.
[6]Nikawa H,Hamada T,Yamamoto T.Denture plaque-past and recent concerns[J].Jdent,1998,26:299 -304.
[7]Kleinegger CL,Lockhart SR,Vargas K,et al.Frequency,intensity,species,and strains of oral Candida vary as a function of host age[J].J Clin Microbiol,1996,34(9):2246-2254.
[8]van Loosdrecht MC,Lyklema J,Norde W,et al.Influence of interfaces on microbial activity[J].Microbiol Rev,1990,54(1):75-87.
[9]余志芬,张向宇.细菌黏附的研究进展[J].国际口腔医学杂志,2009,36(4):448 -450.
[10]Weerkamp AH,Uyen HM,Busscher HJ.Effect of zeta potential and surface energy on bacterial adhesion to uncoated and saliva- coated human enamel anddentin[J].Jdent Res,1988,67(12):1483-1487.
[11]Nejadnik MR,vander Mei HC,Busscher HJ,et al.Determination of the shear force at the balance between cacterial attachment anddetachment in weak-adherence systems,using a flowdisplacement chamber[J].Appl Environ Microbiol,2008,74(3):916-919.
[12]李鸣宇,张国伟,刘正.镧、铈、氟对葡糖基转移酶和口腔主要致龋菌黏附的影响[J].上海口腔医学,1998,7(3):133-135.
[13]Chen W,Liu Y,Courtney HS,et al.In vitro anti-bacterial and biological properties of magnetron co-sputtered silver-containing hydroxyapatite coating[J].Biomaterials,2006,27:5512 -5517.
[14]Chandra J,KuhndM,Mukheriee PK,et al.Biofilm formation by the fungal pathogen Candida albicans:development,architecture,anddrug resistance[J].J Bacteriol,2001,183(18):5385-5394.
[15]史文娜,孙淑娟.白念珠菌生物膜的研究[J].生命的化学,2008,28(5):658 -661.
[16]陈建治.钛表面氧化膜的形成与活化.[J]国外医学口腔医学分册,2006,33(1):48-50.
[17]Wong YWH ,Yuen CWM,Leung MYS,et al.Selected applications of nanotechnology in textiles[J].AUTEX Research Journal,2006,6(3):1 -8.
[18]徐丽丽,綦晓峰,陈玉清.纳米二氧化钛抗菌材料的研究与应用进展[J].山东陶瓷,2007,30(5):26-29.
Comparison of Candida albicans adhesion among threedental prosthetic metals
CUI Ling-yun,ZHANG Yu-mei,HUANG Ping
(School of Stomatology,The Fourth Military Medical University,Xi'an 710032,China)
AIM:To compare three commonly useddental prosthetic metals in respect of the adhesion of Candida albicans.METHODS:Adhesion assays of Candida albicans were performed on nickel-chromium alloy,cobalt-chromium alloy and pure titanium specimens in vitro by testing the surface energy.The amount of Candida albicans adhered on the samples was evaluated by counting colony forming at 1h,3h,24h respectively.The ratio of living bacteria todead bacteria on the surface of the specimen was investigated by fluorescence staining.RESULTS:The surface energy of nickel-chromium alloy,cobalt-chromium alloy and pure titanium was 36.6mJ/m2,34.04mJ/m2and 48.09 mJ/m2,respectively.The amount of Candida albicans adhered on pure titanium was significantly lower than that on nickel-chromium alloy and cobalt-chromium alloy at all time points.The proportion ofdead bacteria on pure titanium was significantlygreater than that on the other two alloys.CONCLUSION:Compared to nickel-chromium alloy and cobalt-chromium alloy,pure titanium is more effective in reducing bacterial adhesion,thus reducing the occurrence of complications likedenture stomatitis afterdenture restoration.
dental prosthetic materials;Candida albicans;bacterial adhesion;surface free energy;confocal laser scanning microscopy
R783.1
A
1005-2593(2011)02-0090-04
2010-11-29
国家自然科学基金资助项目(81070862)
崔凌云(1985-),女,汉族,河南焦作人。硕士生(导师:张玉梅)
张玉梅,E -mail:wqtzym@fmmu.edu.cn
