血清饥饿法对人牙髓细胞周期同步化的研究
2011-02-02吴补领麻丹丹
刘 斐,吴补领,高 杰,黄 欣,麻丹丹,陈 婷
(南方医科大学南方医院口腔科·南方医科大学口腔医学院,广东广州 510515)
血清饥饿法对人牙髓细胞周期同步化的研究
刘 斐,吴补领,高 杰,黄 欣,麻丹丹,陈 婷
(南方医科大学南方医院口腔科·南方医科大学口腔医学院,广东广州 510515)
目的:探讨不同的血清饥饿方法和饥饿时间对人牙髓细胞(HDPCs)细胞周期的影响。方法:血清直接饥饿和梯度饥饿处理人牙髓细胞。倒置显微镜观察细胞形态;CCK-8检测血清饥饿处理对HDPCs增殖能力的影响;流式细胞术检测细胞周期验证HDPCs同步化的效果。结果:血清直接饥饿处理或梯度饥饿处理后其G0/G1期HDPCs的比例均显著高于一般培养组(P<0.05),但血清直接饥饿组和梯度饥饿组间无显著性差异(P>0.05)。用含5 mL/L FBS的DMEM培养基培养48 h能获得较满意的结果,G0/G1期细胞百分比达85.95%。结论:血清饥饿法能有效地使人牙髓细胞同步于G0/G1期;5 mL/L FBS血清饥饿处理细胞48 h可取得较好的细胞周期同步化效果。
血清饥饿法;人牙髓细胞;细胞周期同步化;G0/G1期
[牙体牙髓牙周病学杂志,2011,21(2):67]
[Chinese Journal of Conservativedentistry,2011,21(2):67]
随着对损伤牙髓组织修复性研究的日益深入,大多数的药物实验要求在诱导前保持细胞周期的同步性,以得到一个更为客观真实的实验结果。血清饥饿法是一种对细胞干扰较小,较少影响细胞周期发育进程并能够将细胞周期停滞于G0/G1期的同步化方法[1-2]。目前,尚无关于 HDPCs成熟有效的血清饥饿同步化方法的报道。本研究旨在寻找对HDPCs实施血清饥饿同步化方法的最佳条件,从而为研究HDPCs增殖周期及牙髓组织损伤修复机制提供实验基础。
1 材料和方法
1.1 主要材料和仪器
胰蛋白酶、胎牛血清FBS、DMEM(Gibco公司,美国);CCK-8(同仁公司,日本);流式细胞仪、PI细胞周期流式检测试剂盒、倒置显微镜(OLYMPUS,日本)。
1.2 方法
1.2.1 细胞培养与鉴定
取因正畸需要新鲜拔除的年轻健康者前磨牙,无菌条件下劈冠取出牙髓,用PBS液反复冲洗,组织块法进行原代培养(培养液为含有100 mL/L FBS、青霉素 100 U/mL、链霉素 100 U/mL的DMEM培养基,pH=7.2),每2~3d换液。待细胞铺满培养瓶底后用2.5g/L胰蛋白酶(含EDTA)消化后1∶3传代培养。倒置相差显微镜观察HDPCs的生长情况和形态特征,流式细胞仪检测其表面标志物 CD105、CD29、CD34、CD33、CD45 的表达情况。
1.2.2 血清饥饿处理的细胞形态学观察
将3~5代HDPCs细胞接种于6孔板上,待细胞达到 80%汇合,加入含不同浓度(0、5、100 mL/L)血清的DMEM培养基处理细胞,分别与处理后不同时间(0、24、48、72 h)在倒置显微镜下调整视野,观察不同时间段细胞形态并拍照。
1.2.3 CCK-8 法检测细胞生物活性
将消化所得的3~5代HDPCs以1.0×104/孔密度接种于96孔板,每孔体积100 μL,复孔4个,隔天换液。待细胞长至80%汇合后,PBS冲洗3遍,分别加入含 0、1、3、5、100 mL/L FBS 的dMEM培养基,分别于培养 12、24、48、72、96 h 时每孔依次加入10 μL CCK-8 溶液,37 ℃孵育 2 h,酶联免疫检测仪测定(波长490 nm)每孔的吸光度值。每个实验重复3次,取均值。
1.2.4 流式细胞仪测定细胞周期
取第3~5代HDPCs以7.0×104/孔密度接种于6孔板上,每孔培养液2 mL,复孔4个,隔天换液。待细胞汇合至80%后,PBS洗3遍,加入含0、5、100 mL/L FBS的DMEM培养基。分别培养0、24、48、72 h后同时将饥饿48 h后的细胞去原培养液,换含100 mL/L FBS的DMEM培养液再正常培养24 h。然后将各组细胞用PBS冲洗2遍,离心(4 ℃、1 000 r/min,5 min),加入 500 μL PBS 将细胞重悬,注入预冷的700 mL/L的乙醇2 mL 4℃过夜固定,上机前再次离心(800 r/min,6 min),弃乙醇固定液,冷 PBS洗,5%PI染液0.5 mL,4 ℃孵育30 min上机检测。每个实验重复3次,取均值。
1.3 统计学分析
用SPSS13.0统计学软件进行统计分析,多组数据间的比较采用方差分析,两两比较用LSD检验,两组数据间的比较采用两独立样本t检验。检验水准 α=0.05。
2 结果
2.1 原代细胞形态学观察和表面标志物鉴定
培养第5天时可在倒置显微镜下观察到细胞从组织块中游走,呈放射性生长,1周后形成生长晕。成纤维样细胞形态为主,呈星形或长梭形,胞浆丰富,细胞核椭圆居中,核仁清晰可见。14d时相邻组织块的细胞生长出现汇合,传代后的牙髓细胞经过连续培养呈复层生长特性。流式细胞分析结果显示CD105、CD29呈(+)表达,表达率分别为97.67%、98.33%;CD34、CD33、CD45 呈(- )表达,表达率分别为 0.13%、0.31%、0.33%。证明所培养的细胞为间叶组织来源。
2.2 血清饥饿处理后细胞形态学分析(图1)
由图1可见,镜下观察血清饥饿法对细胞周期同步化处理初期(24、48 h)并未对细胞的形态产生明显影响,但随处理时间的延长(72 h),逐渐出现细胞生长抑制,形态发生改变,大部分细胞变圆,极性消失,细胞间出现碎片增多,细胞凋亡以及失去贴壁,脱落坏死的情况。其中血清饥饿两浓度组在各时间观察点并未见明显差异,但与正常培养组(100 mL/L FBS)相比有显著差异性。
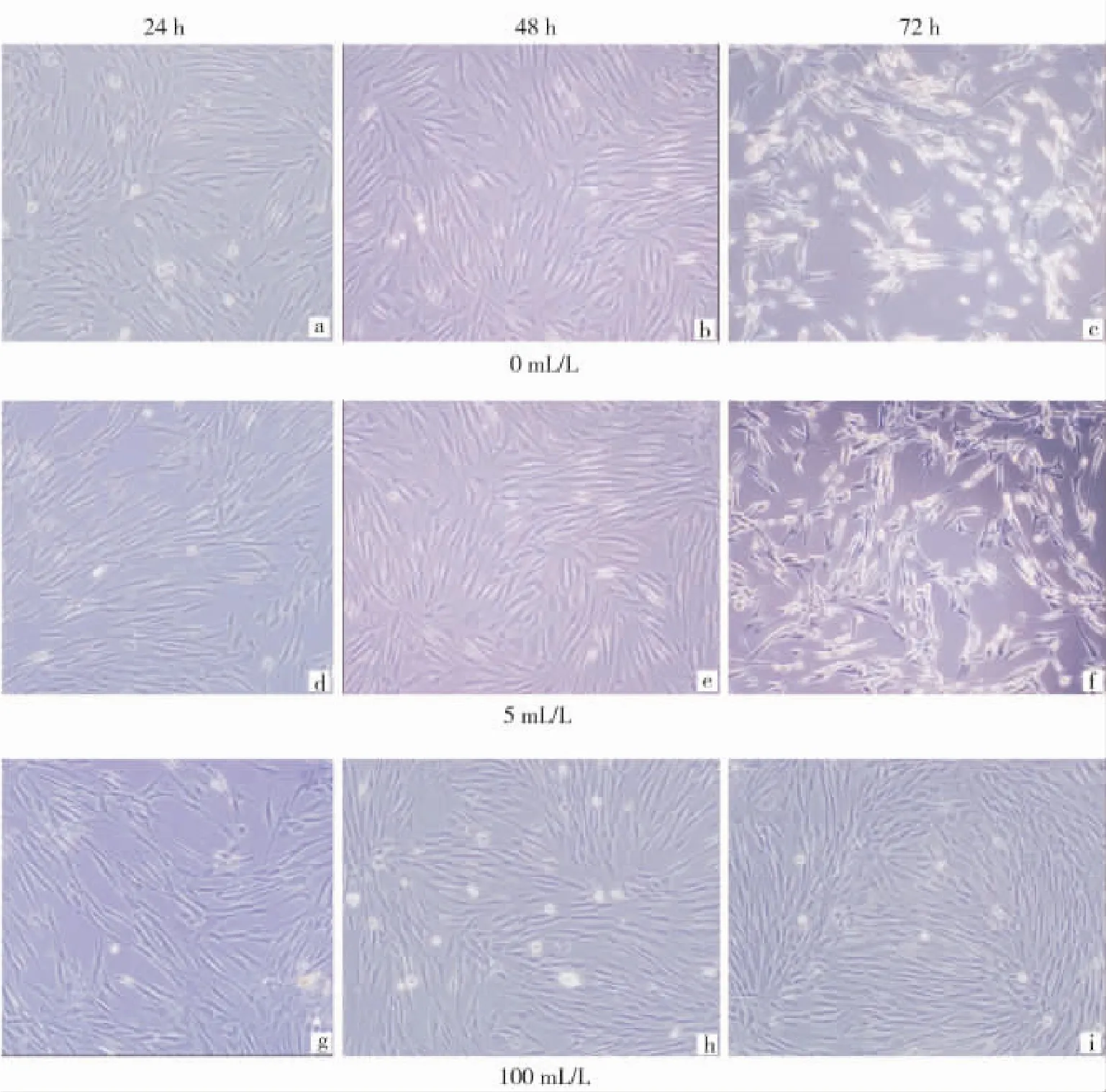
图1 不同浓度FBS处理HDPCs不同时间的形态学图谱(×100)
2.3 CCK-8 检测结果(图2)
由图2可见,应用CCK-8检测梯度血清饥饿和正常培养对HDPCs生长情况的影响,以OD值为纵坐标,饥饿时间为横坐标绘制生长曲线。结果显示,在培养至12 h时,各组细胞均有少量增殖,且无血清组和梯度饥饿组先缓慢增加,并较正常培养组稍高。随着培养时间的延长至24 h时,无血清组和梯度饥饿组OD值开始平稳下降,组间差异不明显(P>0.05),但较正常培养组相比,有显著性差异(P<0.05)。
2.4 细胞周期分析(图3,表1)
如图3和表1所示,血清饥饿组的G0/G1期HDPCs均高于正常培养组。与正常培养组相比5 mL/L FBS饥饿24 h后,大多数的HDPCs的细胞周期停止于G0/G1期,S期和G2/M期比例下降(P<0.05)。处理48 h时G0/G1的比例为85.95%,与正常培养组具有统计学差异(P<0.05)。随处理时间延长,G0/G1的比例下降,饥饿48 h后再恢复FBS正常培养的细胞G0/G1的比例与正常培养组相比无显著性差异(P>0.05)。

图2 不同浓度FBS处理HDPCs不同时间的细胞活力分析
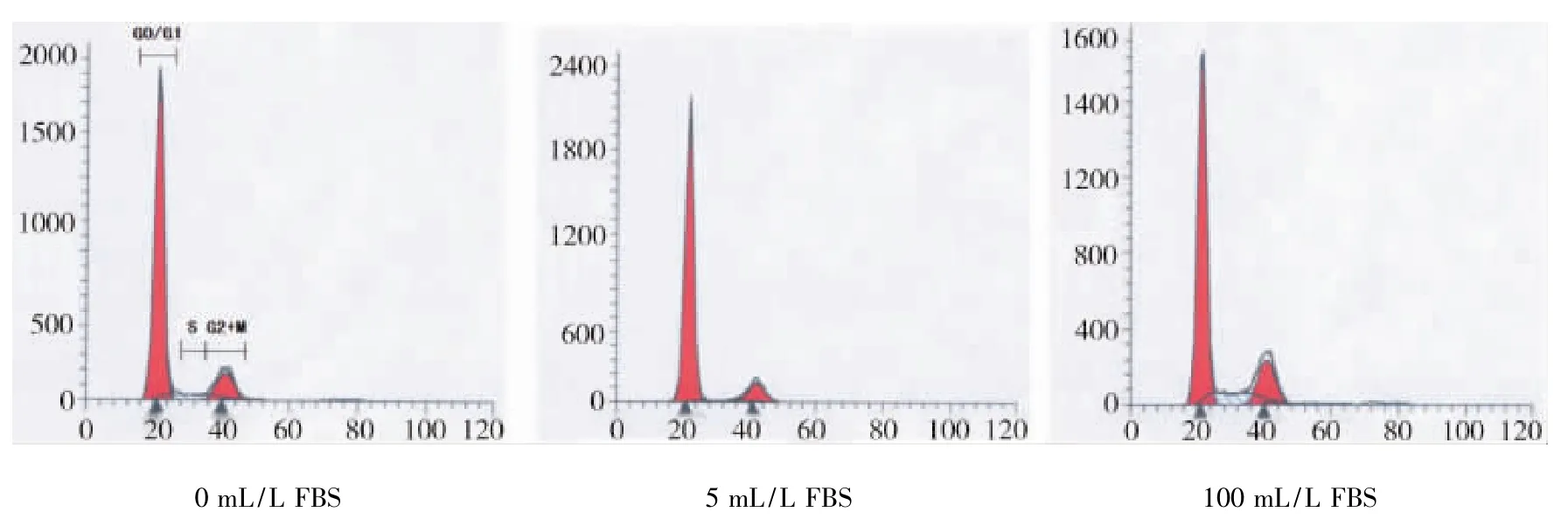
图3 48 h时各个浓度的血清对细胞周期影响的流式分析
表1 HDPCs血清饥饿不同时间的细胞周期分析表(n=3,±s)

表1 HDPCs血清饥饿不同时间的细胞周期分析表(n=3,±s)
*与正常培养组相比P<0.05
细胞周期 正常培养 5 mL/L FBS饥饿处理(h)24 hg0/G1 71.06 ±1.2 77.1 ±0.9* 85.95 ±1.4* 81.6 ±2.1*24 48 72 恢复FBS培养2.63 ±1.1 79.85 ±0.8 S 13.76 ±0.6 4.5 ±0.4* 3.39 ±0.5* 6.5 ±1.5 7.51 ±0.4g2/M 15.18 ±0.7 18.3 ±0.8 10.67 ±0.9 11.8 ±1.3 1
3 讨论
细胞的分裂周期分为G1期、S期、G2期和M期,在分裂的最末时相时细胞将选择进入G0期或者新的细胞周期。正常情况下,大多数的HDPCs处于分裂的G0期,在受到损伤刺激时才进入新的细胞周期。本研究采用血清饥饿法建立了HDPCs同步化于G0/G1期的方法,在短期内获得大量可用于后续实验的G0/G1期细胞,并将G0/G1期细胞和凋亡细胞的比例控制在可接受的范围内。一般来讲,血清饥饿法所采用的胎牛血清浓度一般为0~5 mL/L。在实验过程中,我们通过形态观察和CCK-8法筛选出5 mL/L FBS饥饿处理的细胞在形态学和细胞增殖活力比较中与对照组最为相近。其中在CCK-8法检测细胞的生长曲线时发现在饥饿诱导的初期(12 h),梯度饥饿组的OD值较对照组稍高,我们猜测其原因可能为细胞对外界刺激的预适应反应,为一种代偿性反应表现。而对各实验组的HDPCs进行流式细胞周期分析后发现饥饿处理48 h后的同步化效果最佳,G0/G1期的同步化达到85.95%,较对照组71.06%相比有明显提高。而且在恢复正常培养24 h后G0/G1期比率与对照组相比无明显差异。
当血清浓度较低时,细胞生长因缺乏足够的血清生长因子而处于饥饿状态,抑制了细胞周期蛋白依赖激酶CDK2、CDK4的表达,大量原处于S和G2/M期的细胞分别进入静止状态,细胞周期停滞于G0/G1期[3-5]。对于大多数的细胞而言,血清饥饿的时间一般在两个细胞倍增时间之内,太短太长都不能达到理想的同步化效果。在本实验中,5 mL/L FBS饥饿处理48 h和72 h后的细胞同步率较处理48 h低,其中处理72 h组的坏死和凋亡细胞的比例也较48 h高。由此证明进一步延长饥饿时间不仅不能有效的增高细胞的同步率,细胞还会因为缺乏营养而受到损伤,核内DNA碎片增多[6],引起细胞的凋亡[7],对实验结果产生负面影响。所以在血清饥饿时必需考虑的因素有细胞的特性,血清的浓度以及同步化的时间。此外有文献证明细胞的传代次数,细胞的生长状态以及融合率都会对细胞周期的分布产生影响[8]。
目前用于细胞周期同步化的方法有很多种,如温度休克、血清饥饿、照射、胰酶消化、药物抑制、机械振动收集分裂细胞[9-11]等等。最常用的是汇合培养,药物阻滞和血清饥饿法[12],而对损伤或正常的牙髓组织进行药物诱导筛选实验时最好采用血清饥饿法,以防止药物之间的干扰对实验结果产生影响。
综上所述,血清饥饿法能有效的对人牙髓细胞进行周期同步化,本实验所选用的5种不同浓度的胎牛血清培养基在细胞周期同步化能力方面有一定的差异,其中以5 mL/L FBS培养48 h为最佳,可以较好的使大多数的HDPCs进行细胞周期同步化,并控制实验过程中坏死、凋亡细胞对实验结果的影响,为将来进一步进行体外研究外源性刺激对牙髓组织的影响及其作用机制提供更多的实验基础。
[2]Khammanit R,Chantakru S,Kitiyanant Y,et al.Effect of serum starvation and chemical inhibitors on cell cycle synchronization of caninedermal fibroblasts[J].Theriogenol,2008,70(1):27 -34.
[3]Shin JS,Hong SW,Lee SL,et al.Serum starvation inducesg1 arrest through suppression of Skp2-CDK2 and CDK4 in SK-OV-3 cells[J].Int J Oncol,2008,32(2):435 -439.
[4]Alfieri R,Barberis M,Chiaradonna F,et al.Towards a systems biology approach to mammalian cell cycle:modeling the entrance into S phase of quiescent fibroblasts after serum stimulation.[J].BMC Bioinformatics,2009,10(s12):S16.
[5]Ching JK,Rajguru P,Marupudi N,et al.A role for AMPK in increased insulin action after serum starvation[J].Am J Physiol Cell Physiol,2010,299(5):1171-1179.
[6]Dalman A,Eftekhari-Yazdi P,Valojerdi M,et al.Synchronizing cell cycle ofgoat fibroblasts by serum starvation causes apoptosis[J].Reproddomest Anim,2009,45(1):46 -53.
[7]Miranda Mdos S,Bressan FF,Zecchin KG,et al.Serum-starved apoptotic fibroblasts reduce blastocyst production but enabledevelopment to term after SCNT in cattle[J].Cloning Stem Cells,2009,11(4):565-573.
[8]Goissis MD,Caetano HV,Marques MG,et al.Effects of serumdeprivation and cycloheximide on cell cycle of low and high passage porcine fetal fibroblasts[J].Reproddomest Anim,2007,42(6):660-663.
[9]Lima-Neto JF,Fernandes CB,Alvarenga MA,et al.Viability and cell cycle analysis of equine fibroblasts cultured in vitro[J].Cell Tissue Bank,2010,11(3):261-268.
[10]Koo OJ,Hossein MS,Hong SG,et al.Cell cycle synchronization of canine ear fibroblasts for somatic cell nuclear transfer[J].Zygote,2009,17(1):37 -43.
[11]Khammanit R,Chantakru S,Kitiyanant Y,et al.Effect of serum starvation and chemical inhibitors on cell cycle synchronization of caninedermal fibroblasts[J].Theriogenology,2008,70(1):27-34.
[12]deBarros FR,Goissis MD,Caetano HV,et al.Serum starvation and full confluency for cell cycle synchronization ofdomestic cat(felis catus)foetal fibroblasts[J].Reproddomest Anim,2010,45(1):38-41.
Effects of serum starvation on cell cycle synchronization in humandental pulp cells
LIU Fei,WU Bu-ling,GAO Jie,HUANG Xin,MAdan-dan,CHEN Ting
(Department of Stomatology,Nanfang Hospital,Southern Medical University,Guangzhou 510515,China)
AIM:To examine the effects of serum starvation on cell cycle synchronization of humandental pulp cells(HDPCs)by treating HDPCs withdifferent starvation methods and starvation times.METHODS:HDPCs were treated with serumdirect starvation andgradient starvation.The morphological changes of HDPCs were observed by an inverted microscope.CCK-8 assay was used to investigate the effects of serum starvation on cell proliferation,and cell cycledistribution of HDPCs wasdetected by flow cytometry(FCM).RESULTS:HDPCgrowth was significantly inhibited by serum starvation.Treatment of HDPCs with serumdirect starvation orgradient starvation resulted in a significant increase of cells arrested atg0/G1 stage in comparision with the controlgroup(P <0.05),but there was no significantdifference between the serumdirect starvation andgradient starvationgroups.HDPCs cultured indMEM containing 5 mL/L fetal bovine serum(FBS)for 48h showed the most satisfactory result,with 85.95%of HDPCs atg0/G1 phase.CONCLUSION:Serum starvation can efficiently arrest HDPCs atg0/G1 stage,and the optimum result can be achieved with 0.5%FBS serum and a culture period of 48h.
serum starvation;HDPCs;synchronization of the cell cycle;G0/G1 stage
R780.2
A
1005-2593(2011)02-0067-05
2010-11-23
教育部博士点新教师基金项目(20094433120004)广东省科技计划项目(2008B011300018-8)
刘斐(1986~),女,汉族,湖南岳阳人。硕士生(导师:吴补领)
吴补领,E -mail:bulingwu@yahoo.com.cn
