拟南芥温敏雄性不育突变体atms1的获得及表型分析
2011-01-31戴文懿孙亚梅周树敏袁晓君韦嘉励
戴文懿, 孙亚梅, 高 贝, 周树敏, 袁晓君, 韦嘉励, 张 卫
(上海大学生命科学学院,上海200444)
植物由于无法自由移动,因此必须在进化过程中发展一系列能力来适应多变的环境因素以繁衍后代.对植物生长繁殖影响重大的环境因素主要有温度、光周期、光强、光质、湿度、土壤中的水分和养分等[1-4].目前,在环境因素对植物生长发育控制或影响的基础研究领域,进展最快的是利用模式植物水稻和拟南芥进行的研究,其中水稻作为最重要的农作物之一,已在水分或养分的缺乏、盐胁迫等对植物生长的影响,以及光照对植物开花控制等方面获得了重要的研究进展.温度是影响植物生长繁殖最重要的环境因素,早先人们对温度影响植物生长发育的研究集中在植物如何抵御极端温度(低至冰点温度以下,高至40℃以上)的伤害方面,并且对于起源于寒温带植物的春化现象也有了突破性的进展[5].近几年,对于非极端温度以外的常温(或者非胁迫温度)对植物各个生长发育时期影响的研究也取得了一定的进展.Weigel实验室率先对常温下若干拟南芥开花突变体的表型进行了观察,并探讨了一些控制开花的关键基因在不同温度下的转录表达.他们发现,像FT等控制开花的关键基因在低温16℃和常温23℃下的转录表达水平显著不同;自主途径控制开花基因,如FCA等,在介导温度变化对拟南芥开花的影响方面起着主导作用[6-10].Kumar等[11]发现某种类型的核小体组蛋白可以感知外界温度的变化,并在转录水平调控植物适应外界温度条件的变化.这些研究进展,预示着常温控制植物生长发育的研究可能在近期会有重大突破.
在农业生产中,对非胁迫范围内的温度,即常温变化敏感的雄性不育作物已经被广泛用于杂交作物的生产中[12].以杂交水稻为例,目前在我国的超级杂交稻生产中,育性转换临界温度低的温敏雄性不育系已经作为主要的雄性不育系被广泛用于杂交稻的制种.这类温敏雄性不育系在较低温下可育,而在常温(即指适合水稻生长发育的温度范围)和高温下不育,因而在常温下被用于杂交制种,而在低温下用于育性恢复、自交繁殖不育系的种子.在作物杂交优势利用中,温敏雄性不育系具有无需保持系、几乎可以任意选择恢复系、制种术简便、较易选配出优良的杂交组合等优点.但是,这类温敏核不育水稻存在育性漂移的问题[5,12],并且在目前所有的杂交作物中,尚未有温敏雄性不育基因克隆鉴定的报道,也不清楚育性调控的分子基础,这些都极大制约了对温敏雄性不育系的开发利用.
拟南芥作为模式植物的优良特性已为广大植物遗传学的研究者所共识.从目前雄性不育领域的研究发展来看,水稻和拟南芥在该领域具有非常相近的遗传学途径和基因组分,因此,利用拟南芥开展温敏雄性不育的研究可能是非常好的突破口.本实验室筛选到了1株经甲基磺酸乙酯(EMS)化学诱变的拟南芥温敏雄性不育突变体atms1,并就不同温度对其育性和花粉花药形态学等方面的影响进行了研究.
1 材料和方法
1.1 材料来源
野生型拟南芥(Arabidopsis thaliana)为生态型Columbia(Col-0),拟南芥atms1为本实验室用EMS诱变得到的温度敏感雄性不育株系.
1.2 实验方法
1.2.1 植物种植
拟南芥种子播种在V(黑土)∶V(蛭石)∶V(珍珠岩)=1∶6∶0.25的混合土中,4℃春化2~4 d后,以塑料薄膜覆盖;然后,在20℃,湿度为60%~70%,光照强度为50 μEm-2·s-1,16 h光照/8 h黑暗的条件下培养,种子萌发后揭去薄膜;待植物抽薹后移至人工气候培养箱中,分别以16,23和27℃3种温度培养10 d.
1.2.2 花药育性观察
待拟南芥抽薹后分别放到16,23和27℃的人工气候培养箱中培养,培养10 d后每隔3 d取一次花,约3~6朵,共取3次.用亚历山大染色方法染色固定,观察花粉育性.
1.2.3 石蜡切片
取花序中不同发育时期的花苞,用FAA固定液固定,经乙醇系列脱水和二甲苯透明后,浸蜡并包埋,用旋转式切片机做连续横切片,切片厚度为4~6 μm,硼酸-甲苯胺蓝染色,中性树胶封片.在LEICA DM2500光学显微镜下观察并拍照.
1.2.4 植物果荚观察方法
按V(冰乙酸)∶V(酒精)∶V(丙三醇)=1∶1∶1的比例混合配置透明液,将果荚放入透明液中煮沸,约10 min后将果荚取出观察.
1.2.5 突变体的背景纯化与遗传分析
以拟南芥野生型Col-0为父本,突变体为母本进行回交得到F1代,F1代自交后得到F2代.种植并观察F2代表型,统计F2代中可育植株与不育植株的比例.
2 实验结果与分析
2.1 atms1的可见表型观察和育性分析
atms1是经化学诱变剂EMS诱导拟南芥野生型Col-0种子,并从建立的突变体库中筛选得到的雄性不育植株,它与野生型拟南芥(以下简称野生型)的形态学比较如图1所示,育性分析比较如图2所示.当环境温度为23℃时,野生型植株正常生长,生长40 d抽薹后的atms1与野生型相比在整株形态上没有显著差异(见图1(a)).从果荚来看,野生型的果荚大,种子发育全部正常(见图1(d)),而atms1的果荚小于野生型,且种子发育出现空瘪现象,如图1(f)的箭头所示.雄蕊中部分花丝比野生型短小,花器官解剖结果如图1(h)和图1(i)所示.亚历山大染色及育性统计结果显示:野生型花粉粒的不育率接近0,而atms1花粉粒的不育率约为40%(见图2(b)、图2(d)和图2(e)).当野生型的花粉和atms1的雌蕊杂交后,atms1产生了肥大的果荚,形态大小和23℃环境中生长的野生型植株产生的果荚无明显差别,内有30~40粒种子.这些结果说明该atms1是雄性不育,并且只是部分雄性不育.
在27℃培养10 d后,野生型仍能产生正常果荚,但atms1产生的果荚短小且内无正常种子(见图1(g)).通过对花药的进一步观察,发现atms1的花药与野生型相比,颜色呈黄褐色且表面光滑无花粉粒(见图1(b)和图1(c)),而且atms1的雄蕊花丝较短,使得雄蕊的花药无法与雌蕊的柱头触碰(见图1(j)).亚历山大染色育性统计结果显示:野生型花粉粒的育性基本正常,atms1花粉粒的不育率达到80%左右(见图2(c)和图2(f)).此外,当把atms1从23或27℃移到16℃的环境条件下培养1周后,植株又能结出正常果荚(见图1(e)),且花粉粒染色及育性统计结果与野生型相同(见图2).
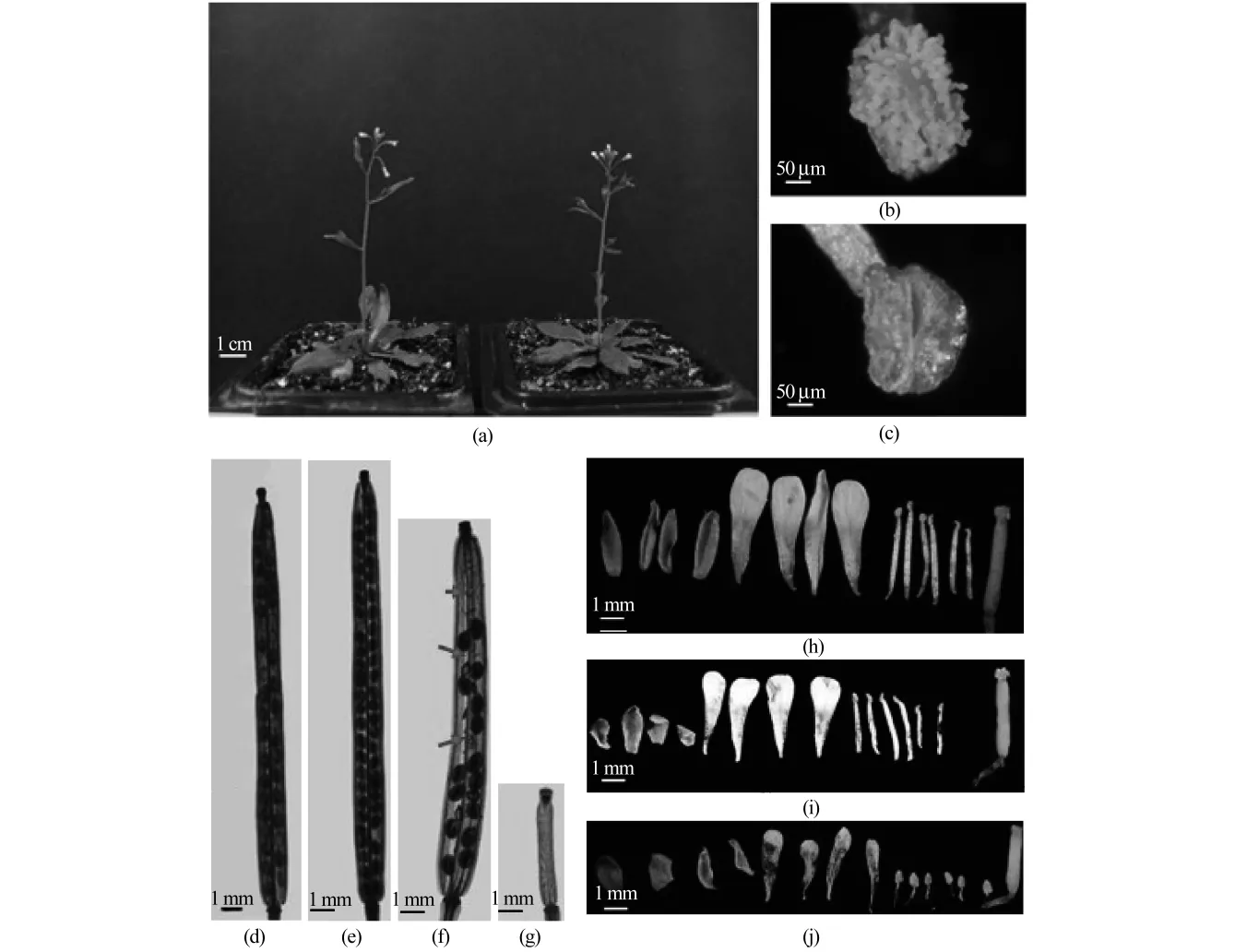
图1 野生型与atms1的植株、花药、果荚和花的形态学比较Fig.1 atms1 plant,anther,silique and flower compared with wild type
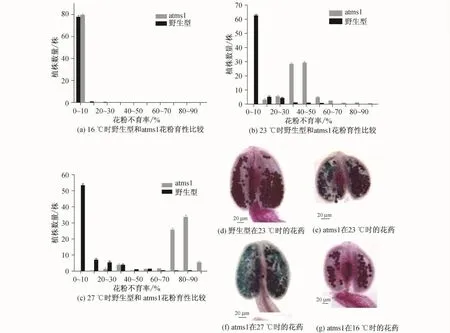
图2 野生型和atms1在不同温度下的花粉育性统计和花药图Fig.2 atms1 pollen fertility statistics and anther compared with wild type
2.2 不同温度下atms1花药的发育
花药发育是一个非常精细复杂的过程,受到多种基因的调控.Paul等[13]将花药发育分为14个时期.花药在不同发育时期具有特定的组织结构特征以及细胞学特征.通过对不同环境温度条件下atms1花药发育的研究显示:当环境温度为16℃时,atms1花药发育的14个时期与野生型表型相同,花药发育完全正常;在环境温度为23和27℃条件下处理10 d后,在花粉母细胞进行减数分裂前,atms1与野生型花药的发育未出现差异,而当花粉母细胞减数分裂后,atms1的花药发育出现明显的差异.23℃处理10 d后,atms1花粉母细胞减数分裂后的表型与野生型花药相似(见图3(a)~图3(j)).27℃处理10 d后,atms1花药中花粉母细胞胼胝体和野生型相比明显单薄(见图3(k)).虽然atms1的花粉母细胞也能分裂产生四分体(见图3(l)),但是到了单核花粉粒阶段,atms1花药的绒毡层明显比野生型肥厚,且在绒毡层细胞中出现大液泡,如图3(m)箭头所示.在双核花粉粒阶段,atms1的绒毡层仍处于肥厚且含大液泡的状态(见图3(n)),而野生型的绒毡层此时已退化,并形成致密的一圈(见图3(d)).同时在此发育阶段,atms1中同一朵花的各个花药所处的发育时期也出现显著差异,甚至同一个花药的4个花药室的发育都不同步.正常条件下,当花药发育到成熟花粉期,野生型的花药壁开裂,大量花粉粒被释放(见图3(e)).但在23℃处理10 d后,atms1产生的花粉粒较少,且有少量的花粉粒败育,如图3(j)箭头所示;而27℃处理10 d后,atms1的绒毡层在该时期尚未完全降解,花药中还残存少量绒毡层细胞,如图3(o)箭头所示.由于atms1花药绒毡层的发育明显滞后于同时期的野生型花药,导致其不能产生正常的花粉粒,从而影响到授粉、受精等后续事件的正常进行,进而影响了植株的育性.
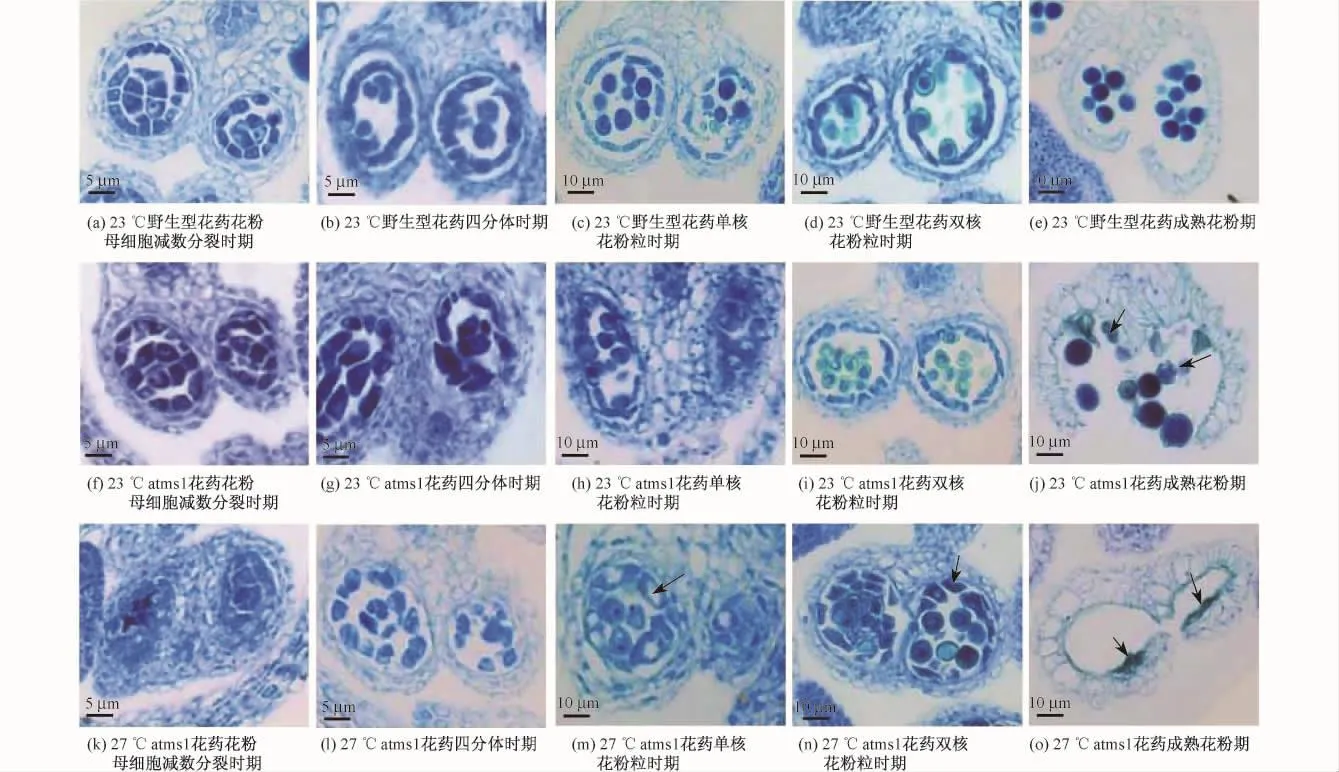
图3 野生型和atms1的花药发育Fig.3 Development of anthers in atms1 compared with wild type
随着温度的升高,atms1花药绒毡层发育的滞后性越来越严重,23℃时仅有小部分绒毡层发育滞后,所以atms1表现为半不育;而在27℃时,几乎所有的绒毡层均表现为发育滞后,植株不能产生正常成熟的花粉粒,进而导致atms1几乎完全不育.
2.3 atms1的遗传背景纯化与遗传分析
atms1与野生型Col-0回交后,F1代表型正常,植株可育,说明该突变体受隐性基因控制.F1代自交得到的F2代群体中出现育性分离,在27℃时,可育植株164株,不育植株56株.经卡方测验,二者比例为3∶1,符合孟德尔遗传定理,因此,可以初步确定突变体atms1的温敏雄性不育表型受单个隐性核基因控制.
3 讨论
目前,非胁迫温度(常温)敏感型雄性不育系在杂交作物生产中起着越来越重要的作用,鉴定控制这类雄性不育的基因,并且探究其作用机理具有重要的科学意义和巨大的应用前景,但是目前仍然没有任何一种作物的常温敏不育基因被克隆鉴定.模式植物拟南芥中,目前只有myb33/myb65双突变体具有常温敏雄性不育特征的报道.本实验室分离到的温敏雄性不育突变体atms1的育性变化正是属于该范畴:在相对于拟南芥的低温16℃培养时,atms1表现出和野生型几乎一致的可育性;在常规的实验室培养温度(23℃)时,atms1的花粉不育率上升为40%,而其果荚的育性降为60%;在高温27℃时,atms1的花粉不育性上升至80%,果荚则接近完全不育.
与野生型相比,当温度低于23℃时,atms1的花药没有显著的表型,而当温度升高至27℃时,atms1的花药也出现了显著的表型:其绒毡层发育与同时期的野生型相比要滞后;有些花药室的绒毡层在花药壁破裂时仍然保持不降解;atms1花粉母细胞的胼胝体单薄,细胞形状扭曲,个别细胞开始有降解的迹象;atms1花药的各个花药室发育不同步.由于绒毡层对花粉发育至关重要,许多绒毡层发育突变体都有花粉母细胞、或者晚期的小孢子、或者更晚期的花粉在发育过程中逐渐降解的表型.27℃时atms1的花药切片结果显示,其绒毡层发育时期明显滞后于花粉发育时期,这种表型与myb33/myb65双突变体非常相似.综合atms1花粉和花药的表型,可以判断atms1的基因突变所导致的缺陷影响的是绒毡层的发育,因此atms1是一个绒毡层发育的突变体.
关于受外界环境温度控制和影响植物生殖能力变化方面的研究,目前还处于起步阶段,有关的基因克隆鉴定十分罕见,即使是基础研究进展最快的拟南芥研究,至今已见报道的也只有3个温敏雄性不育基因被克隆鉴定.2009年,De Ye实验室报道了一种拟南芥高温敏感雄性不育突变体tms1[14].他们发现,tms1在常规温度下育性表现和野生型并无不同,而在胁迫高温30℃下处理2 d后,其育性急剧下降.正如预计,他们发现TMS1基因编码一种热休克蛋白,这类蛋白基因的敲除,会使植物的某些发育过程对热胁迫的抵抗力显著下降.但是,这类高温敏感雄性不育突变体只在高温时才出现显著的表型,体现了一种植物对热胁迫的反应.
关于控制植物在常温下表现为雄性不育的突变体基因已被克隆鉴定的报道,至今为止只有Millar等[15]发现的拟南芥myb33和myb65基因.myb33/ myb65双突变体在常规拟南芥的实验室培养温度下出现半不育特征,而在低温16℃下育性得到大部分的恢复.值得注意的是,myb33和 myb65都编码GAMYB家族的转录因子,这暗示了转录水平的调控在常温敏雄性不育中,如同外界温度对开花的控制一样,可能也起着举足轻重的作用.此外,由于myb33/myb65双突变体的细胞质内出现过多的液泡,而使绒毡层也同样出现了体积膨大的表型,因此,atms1和myb33/myb65是否属于同种调控途径的突变体值得进一步探讨.
[1] SIMPSONG G,DEANC.Arabidopsis,the Rosetta Stone of flowering time[J].Science,2002,296(5566):285-289.
[2] MOURADOVA,CREMERF,COUPLANDG.Control of flowering time:interacting pathways as a basis for diversity[J].Plant Cell,2002,14(S1):111-130.
[3] SCOTTR,HODGER,PAULW,et al.The molecular biology of anther differentiation[J].Plant Sci,1991, 80(1/2):167-191.
[4] GOLDBERGR B,BEALST P,SANDERSP M.Anther development:basic principles and practical applications[J].Plant Cell,1993,5(10):1217-1229.
[5] 申岳正,薛光行.光敏不育水稻育性转换光温互作模式研究[J].中国农学通报,1994,10(2):18-21.
[6] SURESHKUMARB,DETLEFW.Temperature induced flowering in Arabidopsis thaliana[J].Plant Signaling&Behavior,2006,1(5):227-228.
[7] LEMPEL,BALASUBRAMANIANS,SURESHKUMARS,et al.Diversity of flowering responses in wild Arabidopsis thaliana strains[J].PLoS Genet,2005,1(1):e6.
[8] BALASUBRAMANIANS,SURESHKUMARS,LEMPEJ,et al.Potent induction of Arabidopsis thaliana flowering by elevated growth temperature[J].PLoS Genet,2006,2 (7):e106.
[9] SURESHKUMARB,SRIDEVIS,JANNEL,et al.Potent induction of Arabidopsis thaliana flowering by elevated growth temperature[J].PLoS Genet,2006,2(7):e106.
[10] BLÁZQUEZM A,AHN JH,WEIGELD.A thermosensory pathway controlling flowering time in Arabidopsis thaliana[J].Nature Genetics,2003,33:168-171.
[11] KUMARS V,WIGGEP A.H2A.Z-containing nucleosomes mediate the thermosensory response in Arabidopsis[J].Cell,2010,140(1):136-147.
[12] 邱振国.光温敏核不育水稻研究及利用进展[J].安徽农业科学,2006,34(20):5228-5230,5243.
[13] PAULM S,ANHTHUQ B,KOENW K N,et al.Anther developmental defects in Arabidopsis thaliana male-sterile mutants[J].Sex Plant Reprod,1999,11:297-322.
[14] YANGK,XIAC,LIUX,et al.A mutation in Thermosensitive Male Sterile 1,encoding a heat shock protein with DnaJ and PDI domains, leads to thermosensitive gametophytic male sterility in Arabidopsis[J].Plant Journal,2009,57(5):870-882.
[15] MILLARA A,GUBLERF.The Arabidopsis GAMYB-like genes,myb33 and myb65 aremicroRNA-regulated genes,that redundantly facilitate anther development[J].Plant Cell,2005,17:705-721.
