羟基红花黄色素A对缺血/再灌注大鼠肺线粒体通透性转换功能的影响*
2011-01-30戴雍月邱晓晓倪世容郝卯林
戴雍月, 邱晓晓, 汪 洋, 倪世容, 郝卯林
(温州医学院病理生理学教研室,浙江温州325035)
肺缺血/再灌注(ischemia/reperfusion injury,IR)损伤可在肺栓塞溶栓、心肺转流、肺移植等临床多种情况下发生,其发生机制尚未完全阐明。研究发现,肺I/R期间常出现不同程度的细胞凋亡,在诱导因素(如氧自由基、Ca2+超载)的作用下,多种基因(如 p53、bcl-2/bax、Fas/FasL、IEGs、c- myc等)、多种蛋白酶(如核酸内切酶、caspases)、辅酶(如CytC)及核因子(如核因子-κB)等对IR损伤中的细胞凋亡均有调控作用[1]。近年来研究认为,线粒体的功能改变在细胞凋亡的发生中亦起关键性作用,其证据是:在细胞核出现凋亡性改变之前,常常先有线粒体跨膜电位(ΔΨm)的下降,并伴有线粒体内膜通透性增大及能量合成障碍[2]。本研究建立在体肺I/R模型,观察其过程中线粒体通透性转换(mitochondrial permeability transition,MPT)功能的变化,并首次应用红花的主要有效成分羟基红花黄色素A(hydroxysafflor yellow A,HSYA)进行干预,旨在观察它对I/R肺的干预效应并探讨其可能的作用机制。
材料和方法
1 动物和材料
健康清洁级SD大鼠50只,雌雄不拘,体重250-300 g,由温州医学院动物实验中心提供(SYXK浙2005-0061)。脱氧核糖核苷酸末端转移酶介导的X-dUTP缺口末端标记法(terminal deoxynucleotidyl transferase-mediated X -dUTP nick end labeling,TUNEL)凋亡检测试剂盒购自Roche;Ⅰ抗兔抗大鼠CytC、AIF多克隆抗体由Santa Cruz生产(河北博海生物工程开发有限公司分装);Ⅱ抗山羊抗兔IgG购自北京中杉生物技术有限公司;PVDF膜购自Bio-Rad(杭州宝成公司代理);BCA蛋白定量试剂盒、增强化学发光试剂盒购自Pierce(上海吉泰新绛生物科技有限公司代理);HSYA由四川维克奇生物科技有限公司生产,型号Q-5451,规格20 mg/支。
2 实验分组与动物模型制备
参照Vural等[3]介绍的方法复制在体肺I/R模型:5%水合氯醛(7 mL/kg)腹腔注射麻醉,气管内插管连接泰盟HX-300动物人工呼吸机控制呼吸,潮气量每次4-6 mL,呼吸频率60-80次/min。经左第5肋间进入胸腔,游离左侧肺门留置阻断带,在呼气末阻断左肺门(包括血管、支气管)45 min为缺血期,随后开放阻断带恢复供血和通气形成再灌注期。健康SD大鼠50只,随机分为5组,每组10只:假手术对照组(对照组)、缺血/再灌注1 h组(I/R 1 h组)、缺血/再灌注3 h组(I/R 3 h组)、HSYA干预+I/R 1 h组(SI 1 h组)和HSYA干预+I/R 3 h组(SI 3 h组)。对照组游离左肺门后,不阻断左肺门,观察3 h 45 min后留取标本;将HSYA 20 mg粉末稀释至20 mL生理盐水中,SI 1 h、SI 3 h组分别在缺血前20 min和再灌注即刻经尾静脉注射HSYA(2.0 mg/kg),其余步骤同IR组;对照组、I/R 1h和I/R 3h组分别注射同等体积生理盐水。
3 检测指标
3.1 肺湿干重比(wet to dry weight ratio,W/D)测定 取1 g左右左上肺组织称重为湿重,70℃电热恒温干燥箱中烤24 h后称重为干重,两者之比即为W/D。
3.2 肺光学显微镜检查及损伤组织学定量评价取左肺下叶1 cm ×1 cm ×1 cm大小组织块,4%多聚甲醛固定,行常规石蜡包埋、切片,HE染色,在200倍视野的光镜下连续观察10个视野,计算损伤肺泡数[肺泡内含红细胞或(和)中性粒白细胞2个以上]占计数肺泡总数的百分比,即肺泡损伤数比值,作为肺损伤定量评价指标(the index of quantitative assessment of histological lung injury,IQA)。
3.3 肺组织电镜观察 冰蜡块上取左肺门旁0.1 cm ×0.1 cm ×0.1 cm 大小的组织 2 -3 块,2.5%戊二醛前固定,1%锇酸后固定,乙醇丙酮系列梯度脱水后Epon812包埋,超薄切片,醋酸硝酸铅双重染色,透射电镜下观察肺组织超微结构。
3.4 肺组织细胞凋亡检测 采用TUNEL法,按试剂盒提供的方法操作,凋亡的细胞核呈棕黄色。计算5个高倍视野(×400)下的凋亡细胞数,凋亡指数(apoptotic index,AI)=检测到的凋亡细胞数÷5个高倍视野检测到的细胞总数×100%。
3.5 肺组织线粒体提取 采用差速分级离心法分离线粒体,将1小块肺组织置预冷的0.25 mol/L蔗糖溶液中,去除可见的支气管及血管,在STE(0.25 mol/L 蔗糖、10 mmol/L Tris、1 mmol/L EDTA,pH=7.5)液中剪成肉糜,于匀浆机匀浆后,在高速低温离心机(HITACHI 20PR520型)上离心,600×g离心7 min和1 600×g离心5 min,弃沉淀,取上清液经12 500×g离心10 min后,弃上清液,沉淀即为肺组织线粒体[4]。线粒体置于重悬液(不含酶)中,用考马斯亮蓝蛋白测定法测定其蛋白含量。制备好的线粒体悬液用以线粒体通透性转换功能的检测,破膜后用于线粒体细胞色素C(cytochrome C,CytC)、凋亡诱导因子(apoptosis- inducing factor,AIF)的检测。
3.6 CytC和AIF蛋白含量测定 采用免疫印迹法(Western blotting)。称取冻存肺组织约100 mg,放入预冷的1 000 μL细胞裂解液中,冰浴剪碎、匀浆,4℃、3 000 r/min离心3 min,超声裂解5 s×4次,12 000 r/min离心5 min,吸取上清,分装,-80℃保存,留1管用BCA蛋白定量试剂盒测定蛋白浓度。以每个样品的总蛋白为20 μg上样,进行SDS-PAGE凝胶电泳,电转移至PVDF膜30 min,Ⅰ抗4℃过夜,辣根过氧化物酶(horseradish peroxidase,HRP)标记的Ⅱ抗山羊抗兔IgG室温孵育1 h,反复洗膜、显色,暗室中X胶片感光、显影、定影。Quantity One凝胶软件分析系统(Bio-Rad)测定吸光度值,以目的蛋白条带吸光度值和内参照吸光度的比值代表蛋白的含量。
3.7 MPT孔开放情况检测 用线粒体膨胀测定液(120 mmol/L KCl,20 mmol/L MOPS,10 mmol/L Tris-HCl,5 mmol/L KH2PO4,pH7.4)将线粒体稀释至蛋白浓度为0.25 g/L,于25 ℃、20 mmol/L CaCl2作用于线粒体,通过紫外分光光度计检测其在520 nm处的吸光度值(A520)。该值的下降反映线粒体肿胀程度,提示MPT孔的开放情况。
4 统计学处理
结 果
1 肺组织W/D及IQA
与对照组相比,各I/R组和 SI组的 W/D、IQA值均升高(P<0.01);SI各组与I/R组相同时点比较(即SI 1 h与I/R 1 h比,SI 3 h与I/R 3 h比),则有显著下降(P<0.01)。肺组织HE染色,光镜下显示:对照组肺间质及肺泡结构保持完整未见明显炎症细胞;I/R各组肺间质增宽水肿,炎症细胞浸润,肺泡内可见较多红细胞渗出,损伤明显尤其是I/R 3 h组;各SI组与相同时点的I/R组比,肺间质水肿程度减轻,炎症细胞浸润及红细胞渗出也明显减少,肺泡结构比较完整,见表1、图1。
表1 各组W/D和IQA比较Table 1.Comparison of lung W/D and IQA of rats in each group(±s.n=10)

表1 各组W/D和IQA比较Table 1.Comparison of lung W/D and IQA of rats in each group(±s.n=10)
**P <0.01 vs control group;##P <0.01 vs I/R 1 h group;△△P< 0.01 vs I/R group at the same time point.I/R 1 h:ischemia/reperfusion 1h;I/R 3 h:ischemia/reperfusion 3 h;SI 1 h:hydroxysafflor yellow A(HSYA)+I/R 1 h;SI 3 h:HSYA+I/R 3 h;W/D:wet to dry weight ratio;IQA:the index of quantitative assessment of histological lung injury.
Group W/D IQA Control 5.18 ±0.37 14.74 ±4.35 I/R 1 h 6.03 ±0.23** 37.72 ±3.54**I/R 3 h 6.32 ±0.25**## 47.35 ±4.76**##SI 1 h 5.45 ±0.20**△△ 17.64 ±3.85**△△SI 3 h 5.71 ±0.26**△△ 20.76 ±4.97**△△
2 肺组织超微结构改变
对照组毛细血管内皮细胞、Ⅰ型、Ⅱ型肺泡上皮细胞结构完整,细胞器无明显损伤。I/R各组肺组织损伤明显,其程度随再灌注时间延长而加重,血管内皮细胞水肿变性、线粒体空泡化、核染色质边集、核膜皱缩、胞浆浓缩,基底部与弹力板分离呈“拱桥”样变,炎症细胞附壁增多;肺泡Ⅱ型上皮细胞微绒毛脱落明显,核固缩,胞浆浓缩,胞浆内板层小体数量疏松、排空增多;肺泡腔内水肿液、红细胞也逐渐增多,巨噬细胞浸润且吞噬小体丰富。SI 1 h组细胞结构异常改变不明显。SI 3 h组较I/R 3 h组损伤明显减轻,见图2。
3 肺组织细胞凋亡情况
对照组偶见肺组织细胞少量凋亡,I/R各组细胞凋亡较对照组明显增加(均P<0.01),且随再灌注时间延长呈动态变化:I/R 3 h组高于I/R 1 h组;各SI组细胞凋亡与各I/R组同一时点比较明显减少,其凋亡指数差异显著(P<0.01)。TUNEL染色阳性细胞(胞核呈棕黄色)主要为肺泡上皮细胞和血管内皮细胞,见表2、图3。
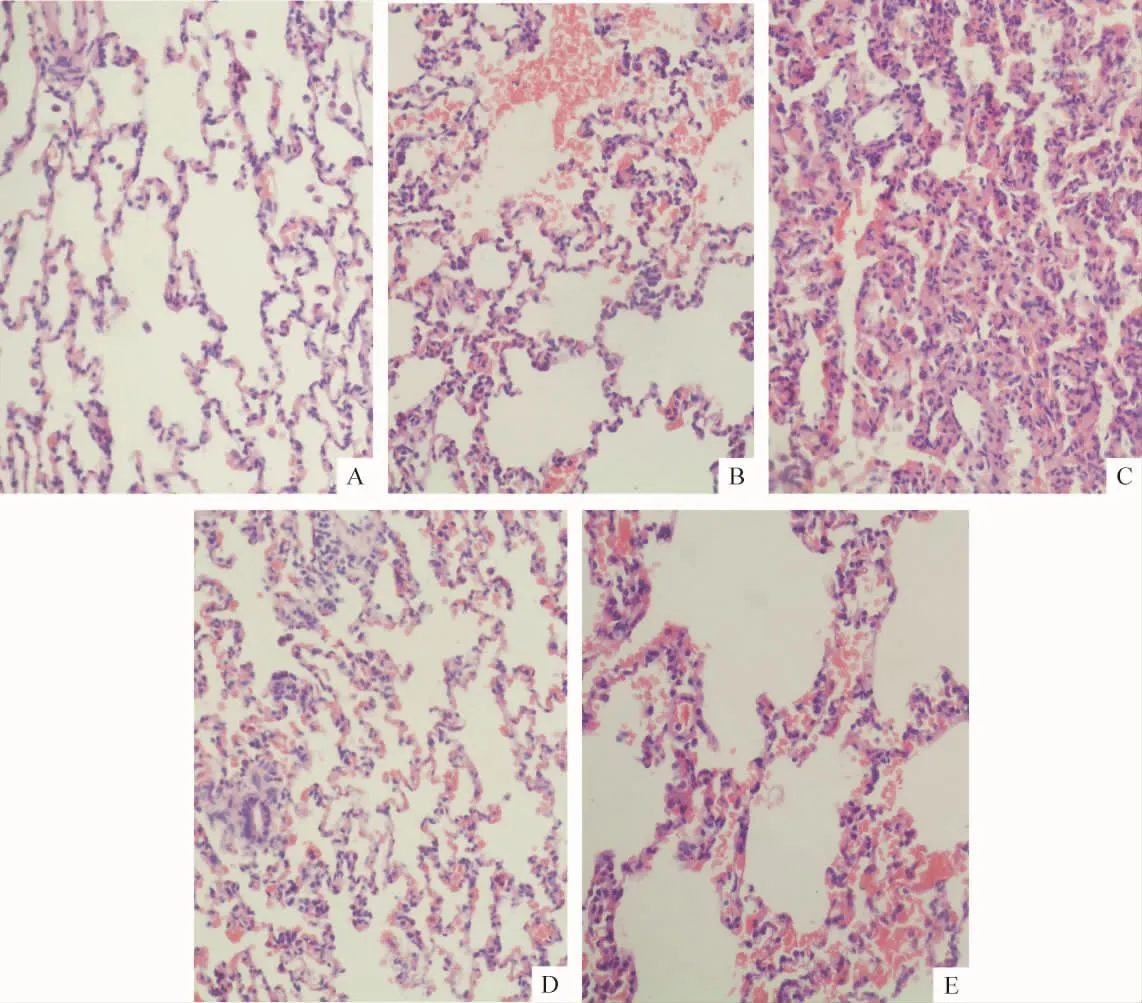
Figure 1.Histology of the left lungs of rats in each group under light microscope(HE staining,×200).A:control group;B:ischemia/reperfusion 1 h(I/R 1 h)group;C:I/R 3 h group;D:HSYA+I/R 1 h(SI 1 h)group;E:SI 3 h group.图1 各组左肺组织光镜下结构

Figure 2.Ultrastructure changes in lung tissues of rats in three groups(×12 000).A:control group;B:ischemia/reperfusion 1 h(I/R 1 h)group;C:I/R 3 h group;D:HSYA+I/R 1 h(SI 1 h)group E:SI 3 h group.图2 各组肺组织超微结构
表2 各组 AI和A520比较Table 2.Comparison of AI and A520of rat lungs in each group(±s.n=10)

表2 各组 AI和A520比较Table 2.Comparison of AI and A520of rat lungs in each group(±s.n=10)
**P < 0.01 vs control group;##P < 0.01 vs I/R 1 h group;△△P <0.01 vs I/R group at the same time point.I/R 1 h:ischemia/reperfusion 1 h;I/R 3 h:ischemia/reperfusion 3 h;SI 1 h:hydroxysafflor yellow A(HSYA)+I/R 1 h;SI 3 h:HSYA+I/R3 h;AI:apoptotic index;A520:the absorbance at 520 nm.
Control 1.66 ±0.71 0.910 ±0.035 I/R 1 h 8.71 ±1.54** 0.500 ±0.017**I/R 3 h 17.73 ±2.08**## 0.290 ±0.034**##SI 1 h 5.03 ±1.75**△△ 0.800 ±0.034**△△SI 3 h 9.40 ±2.09**△△ 0.400 ±0.033**△△
4 MPT功能测定结果
与对照组相比,其余各组线粒体在520 nm处的吸光度值均下降(P<0.01);SI 1 h组线粒体在520 nm处的吸光度值下降程度小于I/R 1 h组;SI 3 h组线粒体在520 nm处的吸光度下降程度小于I/R 3 h组,见表2。
5 肺组织细胞线粒体内和胞浆内CytC蛋白含量的Western blotting结果
与对照组相比较,其余各组CytC胞浆含量增加而线粒体内含量减少;SI 1 h组、SI 3 h组胞浆内CytC含量分别低于I/R 1 h组和I/R 3 h组(P<0.01),而SI 1 h组、SI 3 h组线粒体内CytC含量则明显高于I/R 1 h组和 I/R 3 h组(P <0.01),见图4。
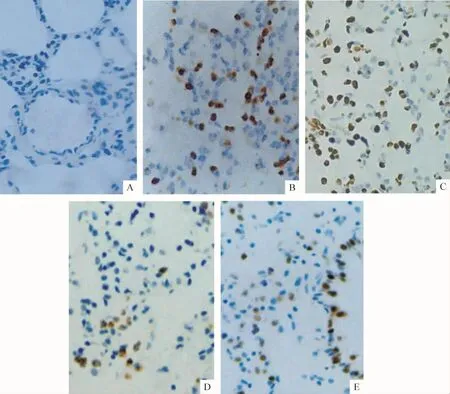
Figure 3.Apoptosis state of pneumocytes in different groups(TUNEL,×400).A:control group;B:ischemia/reperfusion 1 h(I/R 1 h)group;C:I/R 3 h group D:HSYA+I/R 1 h(SI 1 h)group E:SI 3 h group.图3 各组肺组织细胞凋亡情况
6 肺组织细胞线粒体内和胞浆内AIF蛋白含量的Western blotting结果
其变化趋势同CytC,与对照组相比较,其余各组AIF胞浆含量增加而线粒体内含量减少;SI组AIF与I/R组同一时点比较,胞浆内含量减少而线粒体内含量增加,见图5。
7 相关性分析
将肺组织细胞AI与W/D、IQA、胞浆内CytC和胞浆内AIF作相关分析表明,AI与W/D、IQA、胞浆内CytC、AIF之间均呈非常显著的正相关关系(分别r=0.824,r=0.883,r=0.821,r=0.811,均 P <0.01)。

Figure 4.Western blotting analysis for the levels of cytochrome C(CytC).A:control group;B:ischemia/reperfusion 1 h(I/R 1 h)group;C:I/R3 h group;D:HSYA+I/R 1 h(SI 1 h)group;E:SI 3 h group.±s.n=10.**P < 0.01 vs control group;△△P < 0.01 vs I/R group at the same time point.图4 免疫印迹法分别检测线粒体内和胞浆内细胞色素C的情况

Figure 5.Western blotting detecting for the levels of apoptosisinducing factor(AIF).A:control group;B:Ischemia/reperfusion 1 h(I/R 1 h)group;C:I/R 3 h group;D:HSYA+I/R 1 h(SI 1 h)group;E:SI 3 h group.±s.n=10.**P<0.01 vs control group;△△P < 0.01 vs I/R group at the same time point.图5 免疫印迹法分别检测线粒体内和胞浆内凋亡诱导因子的情况
讨 论
细胞凋亡是I/R损伤后细胞死亡的主要方式之一。随着线粒体医学的发展,以及对I/R机制的深入研究,学者们认为,MPT孔在I/R时细胞存活和死亡中扮演着重要角色[5]。MPT孔是横跨在线粒体内外膜之间非选择性高导电性通道,由线粒体膜蛋白的构象改变而形成,被认为是一种蛋白复合体。其组成包括位于线粒体内膜的腺嘌呤核苷酸转位酶、位于线粒体外膜的电压依赖性阴离子通道和位于线粒体基质的环孢菌素 A 受体D[6]。Akao等[7]用培养的心肌研究H2O2诱导的心肌损伤,发现细胞死亡分为不同阶段,启动阶段:包括ROS和Ca2+依赖的线粒体形态改变(膨胀和脊的重塑),但仍能维持Δψm;去极化阶段:MPT诱导Δψm去极化;最后是破裂阶段:基质高度膨胀,线粒CytC释放和线粒体表面膜改变。Kim等[8]在研究肝I/R时也观察到线粒体膜去极化,膜电位下降,线粒体肿胀,释放CytC和AIF,最终引起细胞死亡。目前关于肺I/R中细胞凋亡的研究少见报道。本研究通过复制在体大鼠肺I/R模型,TUNEL法检测结果显示,control组偶见细胞凋亡;I/R 1 h组、I/R 3 h组肺组织细胞(包括肺泡上皮细胞和血管内皮细胞)凋亡明显增加(均P<0.01),随再灌注时间的延长,I/R 3 h组AI明显高于I/R 1 h组(均P<0.01),且凋亡指数(AI)与W/D及IQA均呈显著正相关关系,同时电镜显示,肺组织超微结构破坏随再灌注时间延长逐渐加重,并观察到血管内皮细胞和肺泡Ⅱ型上皮细胞染色质边集,核固缩现象。以上结果均提示,细胞凋亡可能在肺I/R损伤中起重要作用。
正常情况下,CytC主要存在于线粒体内外膜之间的间隙中,在线粒体氧化磷酸化功能中发挥重要作用,而在胞浆少量表达。当缺血缺氧及再灌注等病理因素导致MPT孔异常开放,线粒体氧化磷酸化失偶联,基质肿胀,外膜破裂时CytC与其它促凋亡物质(如AIF)则会释放入胞浆,与凋亡蛋白酶诱导因子-1(Apaf-1)和caspase-9前体结合并活化之,导致caspase-9依赖的caspase-3的激活、DNA断裂和细胞凋亡[9]。本实验MPT功能测定及Western blotting结果均证实了这一点,分光光度计显示I/R后线粒体 A520较control组明显下降,尤其是I/R 3 h组(P<0.01),该值下降反映线粒体肿胀程度,提示MPT孔的开放情况;同时与control组相比较,I/R组CytC和AIF胞浆含量显著增加,而线粒体内含量明显减少。且在做相关分析时发现,AI与胞浆内CytC、AIF之间存在显著的正相关关系(分别 r=0.821,r=0.811,均 P <0.01)。因此,综合前述结果可认为,线粒体通透性转换(MPT)在肺I/R引起的细胞凋亡中扮演着重要角色。有研究表明,I/R过程中,线粒体Ca2+超载,大量氧自由基生成带来的氧化应激效应,腺嘌呤核苷酸的耗竭,以及线粒体膜的去极化是MPT孔开放的关键因素[10]。
红花是传统的活血化瘀类代表药物,红花中含有红花苷、红花素、黄花素和总黄酮、脂肪酸、色素、挥发油以及多炔等多种物质,具有舒张血管、抗凝、提高耐缺氧能力等作用,临床用于治疗缺血性心脏病、脑中风等获得良好疗效[11]。近年来研究发现,红花还能抑制细胞凋亡,减轻心、脑、肠道等脏器缺血再灌注损伤[12,13]。我们在以往的研究中也证实了红花注射液可通过下调促凋亡基因bax的表达,提高Bcl-2/Bax比值以及下调caspase-3基因的表达,减少肺组织细胞凋亡,从而一定程度上保护了缺血再灌注肺组织[14]。本实验首次应用红花的主要有效成分HSYA对肺缺血再灌注进行干预,结果表明,HSYA显著降低了W/D和IQA值(P<0.01),明显减少了肺组织细胞凋亡,SI 1 h与I/R 1 h比,SI 3 h与I/R 3 h比,其凋亡指数有显著差异(P<0.01)。光镜和电镜均证实了HSYA在一定程度上减轻I/R后肺组织结构的损伤。此外,HSYA还能减少CytC和AIF在胞浆内的含量,增加其在线粒体内的含量,且SI各组与同一时相I/R各组比,MPT的程度也明显下降。因此,我们认为,HSYA对I/R肺组织具有保护作用,该作用可能与HSYA抑制I/R诱导的肺组织细胞线粒体膜通透性转换,减少CytC、AIF等凋亡关键物质的释放有关。结合以往的研究结果推测,HSYA保护线粒体的功能可能与下调促凋亡基因bax的表达,提高Bcl-2/Bax比值有关,具体机制有待进一步研究。
[1]Tang X,Gao J,Chen J,et al.Inhibition by corrected ursolic acid of corrected calcium-induced mitochondrial permeability transition and release of two proapoptotic proteins[J].Biochem Biophys Res Commun,2005,337(1):320-324.
[2]肖春林,张国伟.大鼠肝脏缺血-再灌注损伤时肝细胞线粒体膜电位的变化[J].医学理论与实践,2005,18(12):1377-1378.
[3]Vural KM,Oz MC.Endothelial adhesivity,pulmonary hemodynamics and nitric oxide synthesis in ischemia-reperfusion[J].Eur J Cardiothorac Surg,2000,18(3):348 -352.
[4]尚 涛,张建新,李兰芳.提取分离肺脏线粒体的方法研究[J].河北医药,2006,28(4):252-253.
[5]Kim JS,He L,Lemasters JJ.Mitochondrial permeability transition:a common pathway to necrosis and apoptosis[J].Biochem Biophys Res Commun,2003,304(3):463-470.
[6]Halestrap AP.What is the mitochondrial permeability transition pore?[J].J Mol Cell Cardiol,2009,46(6):821-831.
[7]Akao M,O'Rourke B,Teshima Y,et al.Mechanistically distinct steps in the mitochondrial death pathway triggered by oxidative stress in cardiac myocytes[J].Circ Res,2003,92(2):186 - 194.
[8]Kim JS,HE L,Qian T,et al.Role of the mitochondrial permeability transition in apoptotic and necrotic death after ischemia/reperfusion injury to hepatocytes[J].Curr Mol Med,2003,3(6):527 - 535.
[9]Zhan RZ,Fujihara H,Baba H,et al.Ischemic preconditioning is capable of inducing mitochondrial tolerance in the rat brain[J].Anesthesiology,2002,97(4):896 -901.
[10]Javadov S,Karmazyn M,Escobales N.Mitochondrial permeability transition pore opening as a promising therapeutic target in cardiac diseases[J].J Pharmacol Exp Ther,2009,330(3):670-678.
[11]裴 伟.红花注射液治疗冠心病心绞痛[J].医药论坛杂志,2005,26(3):53 -54.
[12]赵 婧,杜建时,韩雪梅,等.大鼠急性全脑缺血再灌注损伤后细胞凋亡及红花保护作用的研究[J].中国试验诊断学,2004,8(1):21 -23.
[13]张 华,陈肖鸣,陈聪德,等.红花对兔肠缺血再灌注损伤后血IL-8和肠组织ICAM-1表达的影响[J].中国病理生理杂志,2009,25(3):585 -587.
[14]戴雍月,徐正祄,王万铁,等.红花注射液对肺缺血再灌注损伤时细胞凋亡及Bcl-2和Bax基因的影响[J].中国动脉硬化杂志,2007,15(6):415-419.
