姜黄素衍生物B50对不同辐射抗拒的同源鼻咽癌细胞增殖及凋亡的作用*
2011-01-30刘嘉伟张剑威杨广鑫陈淑英方乐堃杨惠玲
刘嘉伟, 张剑威, 杨广鑫, 陈淑英, 方乐堃, 梁 广, 肖 健, 杨惠玲△
(1中山大学中山医学院,广东广州510080;2温州医学院药学院,浙江温州325000)
鼻咽癌(nasopharyngeal carcinoma,NPC)在中国珠江三角洲一带发病率居世界第1位,是一种恶性程度较高、易发生淋巴结转移的肿瘤。目前对鼻咽癌的治疗主要以放疗为主,辅以化疗。尽管放疗技术几经改良,但NPC患者5年生存率仍仅有50%-60%,辐射抗拒导致常规放疗后局部复发和远处转移是制约NPC患者5年生存率提高的关键。因此,寻找对放疗后残存辐射抗拒鼻咽癌细胞有效的药物及治疗方法成为了临床治疗鼻咽癌的重点。鼻咽癌细胞系CNE-2R是本室对鼻咽癌细胞系CNE-2采用爬坡式间歇性大剂量X线诱导构建的与CNE-2具有相同遗传背景、不同辐射抗拒的鼻咽癌辐射抗拒细胞模型[1],由于它与临床长期放疗后的残存辐射抗拒细胞具有相似性,故可通过此细胞来筛选对辐射抗拒鼻咽癌有效的治疗方法。
近来研究表明姜黄素(curcumin)可有效地抑制多种肿瘤细胞的增殖与促使凋亡的发生,且能使某些肿瘤细胞的细胞周期停滞于G2/M期[2,3],推测其具有放疗增敏作用。由于人体对姜黄素的吸收及生物利用度低[2],且其分子结构简单,以增强其生物活性为目的的衍生物变构研究吸引了国内外药物研发机构的关注。B50是梁广等[4]改构的姜黄素衍生物之一,它可能具有类似姜黄素的作用特点及机制,初筛表明B50具有广谱抗肿瘤效应,然而B50是否具有逆转辐射抗拒作用尚未见报道。本文拟通过比较B50对同源不同辐射抗拒鼻咽癌细胞增殖、凋亡及线粒体膜电位作用的差异,以探讨其在逆转辐射抗拒鼻咽癌临床治疗中潜在价值。
材料和方法
1 材料
CNE-2由中山大学肿瘤防治中心提供,CNE-2R为本室自行构建细胞株,培养时接种于含胎牛血清10%的双抗RPMI-1640培养基(分别含100 kU/L的青霉素与链霉素)中,置37℃、5%CO2、饱和湿度培养箱中培养,以25 g/L的胰蛋白酶消化传代,取对数生长期细胞进行实验;B50由温州医学院提供,纯度93.4%,溶解于二甲基亚砜(dimethyl sulfoxide,DMSO,Sigma)配成药物母液,常温下避光保存,用时以无血清培养基配成所需浓度的工作液,药物工作液中DMSO体积分数小于0.1%;胎牛血清(fetal calf serum,杭州四季青生物工程材料有限公司);RPMI-1640培养基(Gibco);3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT]和胰酶(华美生物工程公司);Rh123(Sigma);全自动酶标仪(芬兰雷勃MultiskanMK3酶标仪);ELITE流式细胞仪为Beckman产品。
2 MTT法检测细胞活力
收集对数生长期细胞,调整细胞悬液浓度为3×107cells/L,每孔加入 100 μL。5%CO2,37 ℃ 孵育24 h待细胞贴壁,吸去板内培养基残液,于各药物浓度组加入相应浓度 B50(20、10、5、2.5、1.25 μmol/L),实验对照组及空白组加入无血清培养基,以上液体均为每孔加入200 μL,各组重复6孔,实验重复3次。分别孵育 24、48、72 h,此后加入 20 μL/well的MTT溶液(MTT按5 g/L浓度溶于 0.01 mol/L,pH7.2的 PBS,避光 4℃ 保存),继续在 5%CO2、37℃下孵育4 h。轻轻甩出板内液体,每孔加入150 μL DMSO,此后96孔板避光置摇床上低速振荡10 min并用排枪轻轻吹打均匀,使结晶物充分溶解。在酶联免疫检测仪波长570 nm处测量各孔的吸光值。肿瘤活力抑制率=(实验对照组A值-处理组A值)/(实验对照组A值-空白组A值)×100%。
3 集落形成实验检测细胞增殖能力
收集对数生长期细胞,调整细胞悬液浓度为3×105cells/L,每孔滴加1 mL悬液接种于6孔板,24 h后吸去孔内残留培养基,按药物浓度(5、2.5、1.25、0.625、0.3125 μmol/L)分别加入 B50 于相应孔内,药物组每孔加入药液2 mL,对照组每孔加入2 mL无血清培养基,每组重复3孔。药物作用48 h后吸去孔内残液,加入10%胎牛血清培养基3 mL/well继续培养直至对照组出现肉眼可见集落为止。吸去孔内残液后以0.01 mol/L、pH 7.2的PBS冲洗各孔2次,甲醇溶液固定15 min,吉姆萨染色15 min,自来水冲洗3至5次,显微镜下观察细胞集落长成情况,细胞数≥50的为一集落。肿瘤增殖抑制率=(实验对照组集落数均值-处理组集落数均值)/实验对照组集落数均值×100%。
4 流式细胞仪测细胞周期分布
调整B50作用终浓度为2.5 μmol/L,对细胞作用48 h后胰酶消化收集细胞,各待检标本保证细胞总数不少于106个,离心弃上清以75%乙醇固定4℃过夜,第2 d离心弃上清,PBS洗2遍后以含碘化丙啶(propidium iodide/PI)100 mg/L和RNase酶100 mg/L的染色液0.5 mL在4℃下避光染色30 min,染色结束后以ELITE(Beckman)流式细胞仪检测细胞周期。
5 Annexin V/PI双标法测细胞凋亡
调整B50作用终浓度为10 μmol/L,对细胞作用24 h后胰酶消化收集细胞,各待检标本保证细胞总数不少于106个,离心弃上清以PBS洗2遍,将细胞重悬于 binding buffer中,加入 10 μL Annexin VFITC,轻轻混匀,室温避光情况下反应15 min染色,再加入5 μL PI,结束后以 ELITE(Beckman)流式细胞仪检测细胞凋亡,其中将Annexin V染色阳性、PI染色阴性的细胞群归为早期凋亡细胞,而将Annexin V染色阳性、PI染色阳性的细胞群归为晚期凋亡与坏死细胞。
6 Rh123标记测细胞线粒体膜电位
调整B50作用终浓度为10 μmol/L,对细胞作用24 h后胰酶消化收集细胞,各待检标本保证细胞总数不少于106个,离心弃上清以PBS洗2遍,将细胞重悬于Rh123终浓度为100 μg/L的2 mL染液中,37℃下避光染色45 min,结束后以 ELITE(Beckman)流式细胞仪检测细胞线粒体膜电位。
7 统计学处理
采用SPSS 13.0进行统计处理,数据以均数±标准差(±s)表示,连续型数据的组间比较采用方差分析,离散型数据的组间比较采用χ2检验。
结 果
1 B50抑制CNE-2与CNE-2R细胞活力的比较
B50作用24、48、72 h后,CNE -2及 CNE -2R细胞活力的抑制率呈浓度时间依赖性,见图1。采用Bliss算法软件统计得到B50作用于CNE-2及CNE-2R 细胞24 h、48 h、72 h 的 IC50,见表 1,其中 B50作用于CNE-2细胞72 h的IC50低于CNE-2R,两者相比差异显著(n=18,P<0.01)。
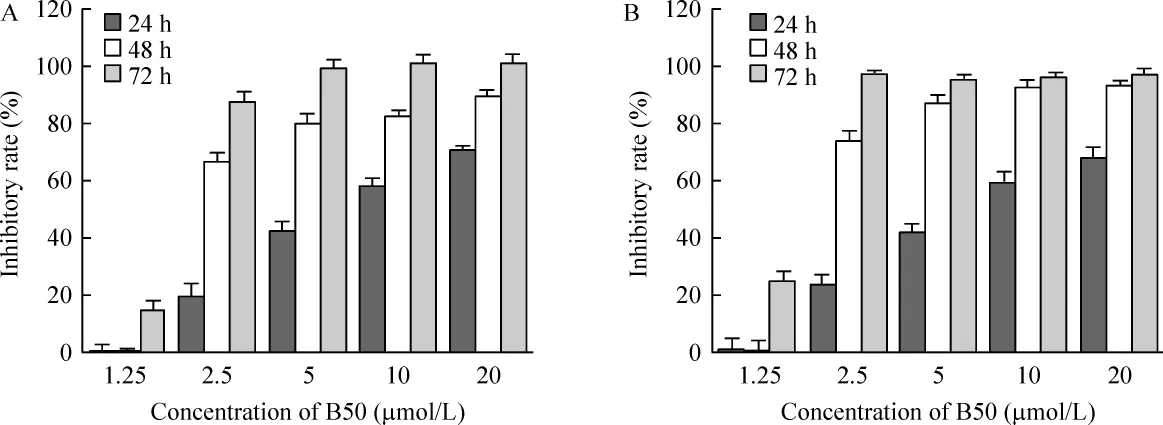
Figure 1.The inhibitory effect of B50 at various concentrations on cell viability of CNE-2 cell line(A)and CNE-2R cell line(B)after 24 h,48 h and 72 h treatment.±s.n=18.图1 不同浓度B50作用24、48、72 h后对CNE-2及CNE-2R的细胞活力抑制率
表1 B50作用于CNE-2及CNE-2R细胞24 h、48 h、72 h后细胞活力的IC50比较Table 1.The IC50of B50 on cell viability of CNE-2 and CNE-2R cell lines after 24 h,48 h and 72 h treatment(MTT assay)(μmol/L.±s.n=18)
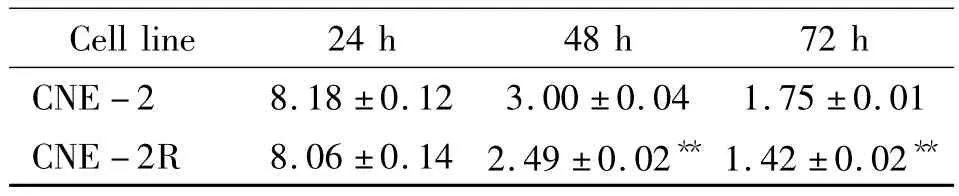
表1 B50作用于CNE-2及CNE-2R细胞24 h、48 h、72 h后细胞活力的IC50比较Table 1.The IC50of B50 on cell viability of CNE-2 and CNE-2R cell lines after 24 h,48 h and 72 h treatment(MTT assay)(μmol/L.±s.n=18)
**P <0.01 vs CNE -2.
Cell line 24 h 48 h 72 h CNE -2 8.18 ±0.12 3.00 ±0.04 1.75 ±0.01 CNE -2R 8.06 ±0.14 2.49 ±0.02** 1.42 ±0.02**
2 B50抑制CNE-2与CNE-2R细胞增殖能力的比较
B50作用24、48、72 h后,CNE -2与 CNE -2R细胞增殖能力的抑制率呈浓度依赖性,见表2。采用Bliss算法软件统计得到B50对CNE-2作用48 h后细胞增殖的 IC50为(0.82±0.01)μmol/L,而其对CNE-2R作用48 h后细胞增殖的IC50为(0.55±0.01)μmol/L,两者相比差异显著(n=3,P <0.01)。
表2 B50作用于CNE-2及CNE-2R细胞48h后细胞增殖的IC50比较Table 2.The IC50of B50 on cell growth of CNE-2 and CNE-2R cell lines after 48 h treatment(colony-forming experiment)(±s.n=3)

表2 B50作用于CNE-2及CNE-2R细胞48h后细胞增殖的IC50比较Table 2.The IC50of B50 on cell growth of CNE-2 and CNE-2R cell lines after 48 h treatment(colony-forming experiment)(±s.n=3)
Concentration of B50(μmol/L)Inhibitory rate of cell growth(%)CNE-2 CNE-2R 5 96.92 ±1.12 99.09 ±0.59 2.5 96.83 ±0.85 98.84 ±0.67 1.25 79.48 ±2.10 95.99 ±1.75 0.625 40.76 ±3.93 64.94 ±2.75 0.3125 -4.20 ±2.60 10.74 ±2.16
3 B50影响CNE-2与CNE-2R细胞周期分布的比较
2.5 μmol/L浓度B50作用48 h后,细胞周期分布呈现明显的G2/M期阻滞,见图2,各期细胞统计见表3,其中B50作用后CNE-2细胞周期中G2/M期比例由12.4%升高至35.7%,CNE-2R细胞由7.1%升高至34.9%,两者相比差异显著(n=3,P<0.01)。
4 B50诱导CNE-2与CNE-2R细胞凋亡的比较
10 μmol/L浓度B50作用24 h后,早期凋亡细胞(右下象限)及晚期凋亡/坏死细胞(右上象限)均有所升高,见图3和表4,其中B50作用后CNE-2细胞早期凋亡率由4.4%升高至14.8%,CNE-2R细胞由3.7%升高至19.5%,两者相比有显著差异(n=3,P <0.01)。

Figure 2.The cell cycle distribution of CNE -2 cell line(A,B)and CNE -2R cell line(C,D)in control group(A,C)and B50 treatment group(B,D).图2 CNE-2及CNE-2R细胞对照组与B50作用组的细胞周期分布
表3 B50作用后CNE-2及CNE-2R细胞的细胞周期改变Table 3.The changes of cell cycle after B50 treatment of CNE-2 and CNE-2R cell lines(%.±s.n=3).

表3 B50作用后CNE-2及CNE-2R细胞的细胞周期改变Table 3.The changes of cell cycle after B50 treatment of CNE-2 and CNE-2R cell lines(%.±s.n=3).
**P < 0.01 vs control.
B50 G1 S G2/M G1 S G2/M CNE -2 32.90 ±1.56 54.67 ±1.26 12.43 ±0.64 35.13 ±2.73 29.53 ±2.43 35.70 ±2.95 Cell line Control**CNE -2R 44.50 ±1.47 48.37 ±1.64 7.13 ±0.38 27.31 ±2.49 38.32 ±2.16 34.90 ±3.72**

Figure 3.The apoptotic distribution of CNE-2 cell line(A,B)and CNE -2R cell line(C,D)in control group(A,C)and B50 treatment group(B,D).图3 CNE-2及CNE-2R细胞对照组与B50作用组的细胞凋亡分布
表4 B50作用后CNE-2及CNE-2R细胞的凋亡改变Table 4.The changes of apoptosis after B50 treatment of CNE-2 and CNE-2R cell lines(%.±s.n=3).

表4 B50作用后CNE-2及CNE-2R细胞的凋亡改变Table 4.The changes of apoptosis after B50 treatment of CNE-2 and CNE-2R cell lines(%.±s.n=3).
**P < 0.01 vs control.
Control Late apoptotic rate and necrotic rate CNE -2 4.40 ±2.31 6.80 ±2.16 14.80 ±2.14** 13.90 ±2.76 Cell line B50 Early apoptotic rate Late apoptotic rate and necrotic rate Early apoptotic rate**CNE -2R 3.70 ±2.34 6.50 ±2.52 19.50 ±2.92** 17.80 ±2.12**
5 B50影响CNE-2与CNE-2R细胞线粒体膜电位的比较
相比对照组,10 μmol/L浓度B50作用24 h后,罗丹明吸收峰下降及左移,见图4,提示线粒体膜电位降低,其中B50作用后CNE-2及CNE-2R细胞线粒体膜电位分别下降了(35.06±1.07)%及(43.17±3.11)%,两者相比差异显著(n=3,P<0.01)。
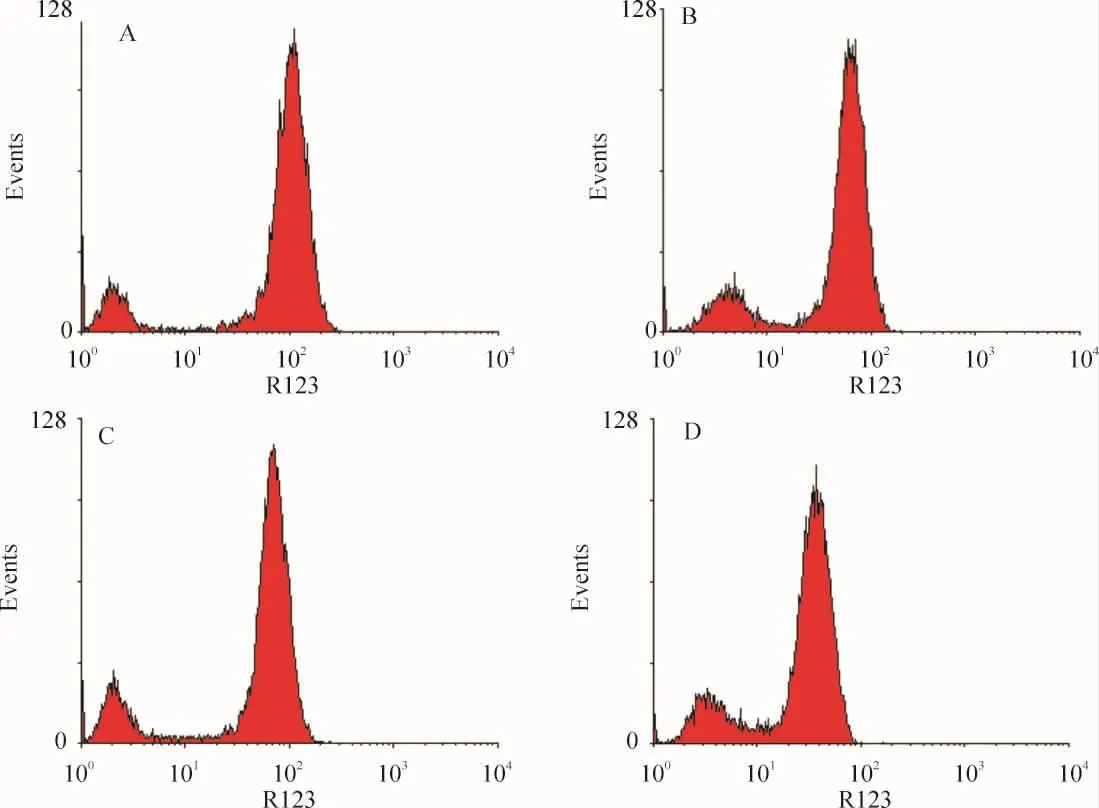
Figure 4.The mitochondrial membrane potential(MMP)distribution of CNE -2 cell line(A,B)and CNE -2R cell line(C,D)in control group(A,C)and B50 treatment group(B,D).图4 CNE-2及CNE-2R细胞对照组与B50作用组的线粒体膜电位分布
讨 论
姜黄素是一种天然酚类色素,广泛存在于姜科姜黄属植物姜黄、莪术、郁金等的根茎中。B50为姜黄素衍生物的一种,结构式为2'-CH3-5'-CH3,其化学结构的修饰主要是以电中性的H取代苯环4'位上的羟基以降低4'羟基的强供电性,并于苯环2',5'位代以甲基,梁广等[4]初筛研究表明,B50具有广谱抗肿瘤效应,尤其对人前列腺癌细胞(PC3)和人子宫颈癌细胞(HeLa)具有更强的生物活性作用。从构效关系上看,B50有望超越姜黄素成为毒性较低,能逆转细胞辐射耐受性及促使肿瘤细胞凋亡的广谱抗肿瘤药。
我们的研究结果显示,B50对鼻咽癌细胞系CNE-2与CNE-2R均具有抑制细胞活力与抑制细胞增殖能力的效应。相比CNE-2,对放疗辐射抗拒的CNE-2R对B50的作用显得更为敏感,提示B50可能通过某些机制调控辐射抗拒鼻咽癌细胞的生物学特性。同时,B50对鼻咽癌细胞系CNE-2具有诱导凋亡效应,且对辐射抗拒细胞系CNE-2R同样具有诱导凋亡效应,推测放疗作用并不影响B50对鼻咽癌细胞的凋亡诱导效应。杨甫文等[5]发现,姜黄素通过线粒体凋亡途径诱导鼻咽癌细胞NCE凋亡,Wong等[6]发现,姜黄素通过抑制核因子κB及激活E-cadherin而起到抑制鼻咽癌细胞的迁移。B50可能同样通过此类通路诱导凋亡,但具体通路可能与姜黄素存在差异。近年来陆续有报道[7]说明线粒体跨膜电位的耗散早于核酸酶的激活,也早于磷酯酰丝氨酸暴露于细胞表面。而一旦线粒体跨膜电位耗散,细胞就会进入不可逆的凋亡过程。本研究中B50可使两细胞线粒体膜电位降低,且CNE-2R中线粒体膜电位降低更为明显,提示B50可能通过线粒体凋亡调控途径促进辐射抗拒鼻咽癌细胞的凋亡。
Pawlik等[8]研究表明,处于G2/M期的细胞对射线最敏感,而G1/S期的细胞相对不敏感,S期末的细胞对射线最不敏感。细胞周期检测显示,B50可有效地将CNE-2细胞停滞在G2/M期,而G2/M调停点被认为是肿瘤细胞对辐射和化疗的敏感期[9],B50对辐射抗拒的细胞系CNE-2R仍具有G2/M期调停作用,这提示B50可能具有逆转鼻咽癌细胞放疗作用后产生辐射抗拒的作用。
目前国内外对鼻咽癌细胞系CNE-2R的相关研究甚少,王旭丹等[1]报道了CNE-2R与CNE-2对X射线辐射抗拒的关系曲线,表明CNE-2R对X射线存在更大的耐受作用,同时该研究还发现CNE-2R与CNE-2间存在微小RNA表达的差异,表现为降低肿瘤辐射抗拒性或化疗耐受性的miRNA表达减少,增加肿瘤辐射抗拒性或化疗耐受性的miRNA表达增多,以及既可增加肿瘤辐射抗拒性或化疗耐受性又可降低肿瘤辐射抗拒性或化疗耐受性的miRNA表达异常,miRNA参与鼻咽癌细胞辐射抗拒及化疗耐受的分子机制可能涉及EGFR-PI3KAkt、Ras-MAPK和ARF-p53等通路及其相关蛋白(如 EGFR、Ras、MAP2K4、P38、E2F1、E2F7、E2F8 和HIF1等)。Feng等[10]研究发现相比 CNE-2细胞,辐射抗拒 CNE-2R细胞中的14-3-3 sigma及Maspin表达下调,同时GRP78与Mn-SOD表达上调。近几年的国内外研究均提及鼻咽癌在放疗作用后产生多药耐药特性,隋晓梅等[11]发现鼻咽癌细胞系CNE-1在接受X线照射后多药耐药基因mdr1的mRNA表达显著升高,其产物P糖蛋白也显著升高,而后者为起到多药耐药的关键蛋白。这提示B50可能通过上述通路及相关微小RNA的表达调控影响鼻咽癌细胞的生物学特性,从而更有效地抑制辐射抗拒鼻咽癌细胞的活力及增殖能力,诱导其凋亡及逆转其辐射抗拒特性。
综上所述,B50可有效地抑制鼻咽癌细胞活力与增殖能力,其中对CNE-2R的作用具有更为显著的效应;B50也可诱导鼻咽癌细胞的凋亡,且可能与线粒体凋亡途径相关;B50能使鼻咽癌细胞周期停滞于G2/M期,从而增强其对放疗的敏感性。因此B50可能对放疗后残存的鼻咽癌细胞具有有效的杀伤作用,减少临床上鼻咽癌放疗根治后的复发及远处转移,并逆转放疗后鼻咽癌细胞的辐射抗拒特性,这对于鼻咽癌的临床治疗,尤其是放疗后的辅助治疗具有可观的应用前景。尽管B50显示出了对鼻咽癌细胞良好的治疗价值,但同时还存在很多值得我们进一步研究的问题,如B50对辐射抗拒CNE-2R细胞具有更为显著杀伤抑制效应的机理,其对细胞G2/M期阻滞的机制,其诱导两细胞凋亡通路间的异同,以及其通过相关微小RNA对鼻咽癌细胞放疗及化疗敏感性的调控机制等,这些将有待我们日后进一步研究。
[1]王旭丹,杨惠玲,郭禹标,等.不同辐射抗拒鼻咽癌细胞微小RNA差异表达的研究[J].中国病理生理杂志,2007,23(6):1045 -1048.
[2]Tang H,Murphy CJ,Zhang B,et al.Curcumin polymers as anticancer conjugates[J].Biomaterials,2010,31(27):7139-7149.
[3]曹 璋,崔 敏,孙 宁.姜黄素对人鼻咽癌CNE-2Z细胞的放射增敏作用及其作用机制[J].现代肿瘤医学,2007,15(9):1232 -1234.
[4]梁 广,田吉来,邵丽丽,等.姜黄素的构效关系及以其为先导物的抗肿瘤化合物研究进展[J].化学通报,2008,71(2):110 -117.
[5]杨甫文,黄金中,林晓岚,等.姜黄素诱导鼻咽癌NCE细胞凋亡机制的研究[J].中华耳鼻咽喉头颈外科杂志,2006,41(8):612 -616.
[6]Wong TS,Chan WS,Li CH,et al.Curcumin alters the migratory phenotype of nasopharyngeal carcinoma cells through up-regulation of E -cadherin[J].Anticancer Res,2010,30(7):2851 -2856.
[7]Grandemange S,Herzig S,Martinou JC.Mitochondrial dynamics and cancer[J].Semin Cancer Biol,2009,19(1):50-56.
[8]Pawlik TM,Keyomarsi K.Role of cell cycle in mediating sensitivity to radiotherapy[J].Int J Radiat Oncol Biol Phys,2004,59(4):928 -942.
[9]Ree AH,Stokke T,Bratland A,et al.DNA damage responses in cell cycle G2phase and mitosis-tracking and targeting[J].Anticancer Res,2006,26(3A):1909 -1916.
[10]Feng XP,Yi H,Li MY,et al.Identification of biomarkers for predicting nasopharyngeal carcinoma response to radiotherapy by proteomics[J].Cancer Res,2010,70(9):3450-3462.
[11]隋晓梅,王若雨,朱勤伟,等.X射线照射对人鼻咽癌细胞株MDR1及P-gp表达影响的研究[J].中华肿瘤防治杂志,2008,15(8):569 -571,586.
