p-ERK1/2-AP-1通路在姜黄素抗大鼠糖尿病神经病理性痛中的作用*
2011-01-30黄葱葱连庆泉
黄葱葱, 陈 果, 吴 艳, 连庆泉, 李 军, 曹 红
(温州医学院附属第二医院麻醉科,温州医学院疼痛医学研究所,浙江温州325027)
糖尿病神经病理性痛(diabetic neuropathic pain,DNP)是糖尿病最常见的慢性并发症之一,至今尚缺乏有效的治疗方法。目前越来越多研究提示MAPK家族及某些转录因子参与了DNP的发生与持续化过程[1]。姜黄素(curcumin,Cur)是从姜黄中提取的酚性色素,具有抗肿瘤、抗氧化、抗炎等广泛药理作用,我们的前期研究发现,在慢性结扎损伤模型(chronic constriction injury,CCI)大鼠模型中姜黄素具有神经保护作用[2],且对MAPK通路及活化蛋白-1(activator protein-1,AP-1)等转录因子的激活具有抑制作用[3],但其在DNP中的作用尚缺乏研究,因此本研究旨在探讨姜黄素对DNP大鼠的痛阈影响及p-ERK1/2-AP-1通路在其中的作用。
材料和方法
1 试剂与仪器
链唑霉素 (S0130,批号B64922)及Cur(28260,批号 1386823)购自 Sigma。抗 p-ERK1/2抗体(4376,兔单抗)购自Cell Signaling Technology。AP-1探针寡核苷酸序列5'-CGC TTG ATG AGT CAG CCG GAA-3'-生物素标记购自上海生工生物工程有限公司。2390型Electronic von Fery触觉测痛仪及II T336型甩尾足底测试仪为IITC产品。
2 动物造模及分组
清洁级雄性SD大鼠96只,体重220-250 g,由温州医学院实验动物中心提供。饲养于20-25℃、昼夜交替环境中,自由摄食摄水,实验前适应环境72 h。参照文献[4]方法制备DNP大鼠模型,除正常对照组外,其余各组在禁食不禁饮12-16 h后腹腔注射链唑霉素(streptozocin,STZ)75 mg/kg。注射STZ后3 d尾静脉非空腹血糖浓度>16.7 mmol/L时为1型糖尿病,14 d后痛阈降低幅度>基础值15%者为DNP造模成功[5]。将大鼠随机分为4组(n=24):正常对照组(control组)、DNP 组、DNP+溶剂(solvent,Sol)组(DNP+Sol组)、DNP+Cur 100 mg/kg组(DNP+Cur组)。DNP+Sol组、DNP+Cur组分别腹腔注射溶剂玉米油或姜黄素,按4 mL/kg,1次/d,持续2周。给药后3、7、14 d测定机械缩足阈值(mechanical withdrawal threshold,MWT)、热缩足潜伏期(thermal withdrawal latency,TWL)及尾静脉非空腹血糖值,随即取出大鼠脊髓腰膨大及L4/L5背根神经节。
3 行为学测定
给药后3、7、14 d测定MWT和TWL的变化。
3.1 机械缩足阈值 置大鼠于透明的有机玻璃箱中,底为1 cm×1 cm的铁丝网,实验前使之适应15 min。手持电子压力传感器(探头为直径0.5 mm的刚性探针)由下向上垂直刺激大鼠后肢足底中部皮肤,匀速而缓慢地增加力度,直致大鼠出现快速缩足、舔足、甩尾等反应为阳性反应,记录此时电子显示器上的数值,单位为g,每次间隔30 s,左右两后肢足底交替测试,每侧3次,第1次数值波动大,故只取后5次的平均值。
3.2 热缩足潜伏期 将大鼠置于底为3 mm厚玻璃板的有机玻璃箱(22 cm×12 cm×22 cm)中,使其适应15 min后用卤素投光灯照射大鼠后肢足底中部皮肤。热辐射刺激仪参数设定:加热头空闲时激光发射强度为20%;加热头测试工作时激光发射强度为60%;切断时间25 s以防测试时间过长对动物造成损伤;触发温度30℃。记录从照射开始至大鼠出现抬腿回避时间即为TWL,每次间隔5 min,左右两侧交替进行,每侧3次,第1次数值波动大,故只取后5次的平均值。
4 免疫组织化学染色
大鼠分别于药物干预后3、7、14 d在4%水合氯醛40 mg/kg麻醉下,经主动脉灌注生理盐水150mL,继而灌注4%多聚甲醛250 mL,取大鼠L4/L5脊髓、背根神经节,石蜡包埋,切片(4 mm)。60℃烤片至石蜡溶解,二甲苯梯度乙醇脱蜡。抗原高压热修复,3%过氧化氢封闭,滴加1∶100 p-ERK1/2的Ⅰ抗,4℃孵育24 h,取出后室温复温20-30 min,加Ⅱ抗37℃孵育30 min后PBS冲洗,DAB显色,苏木素轻度复染3 min,盐酸化酒精酸化5 s,乙醇梯度脱水,二甲苯透明,中性树胶封片,光镜观察。细胞核中出现棕黄色颗粒者为阳性细胞。阴性对照用0.01 mol/L PBS代替Ⅰ抗。采用Nikon E-800型显微照相系统采集图像。每隔5张切片取1张,计数脊髓背角I、Ⅱ层Lissauer区和背根神经节中间区p-ERK的阳性细胞率,反映其表达水平。
5 免疫印迹(Western blotting)法检测
动物在4%水合氯醛40 mg/kg深麻醉下,迅速取出L4/L5脊髓节段与L4/L5背根神经。用玻璃研磨器10倍于组织块的冰冷裂解液将组织机械性地捣碎成匀浆。提取总蛋白并根据BCA法测定样本蛋白浓度后备用。取等量样本加至10%SDS-聚丙烯酰胺凝胶恒压电泳,浓缩胶70 V,分离胶140 V。湿转法将蛋白转移至PVDF膜(聚偏二氟乙烯)。5%脱脂牛奶封闭1 h后加兔抗pERK1/2多克隆抗体(1∶1 000)4℃ 孵育过夜;TBST冲洗,3×15 min,加入碱性磷酸酶标记的羊抗兔Ⅱ抗(1∶1 000),室温摇床孵育1.5 h,用PBS洗涤后进行增强化学荧光(enhanced chemiluminescence,ECL)反应,后显影、定影。X光图片采用Quantity One图像处理系统进行蛋白半定量分析。
6 电泳迁移率变动分析(electrophoretic mobility shift assay,EMSA)
动物在4%水合氯醛40 mg/kg深麻醉下,迅速取出L4/L5脊髓节段与L4/L5背根神经节,新鲜提取胞核蛋白备用。制备非变性6% 聚丙烯酰胺凝胶,并在0.5×TBE、100 V电压下预电泳30-60 min。寡核苷酸探针与核蛋白结合反应在20μL反应体系中,依次加入2 μL 10×结合缓冲液(10 mmol/L Tris,500 mmol/L KC1,10 mmol/L DTT,pH7.5)和 1 μL Poly(dI·dC)(1 g/L),1 μL 5%glycerol,1 μL 1 mmol/L MgCl2,1μL 1%nonidet P - 40、1 μL 0.5 mmol/L EDTA,10 μg核蛋白及 2 μL 双链 AP -1 寡核苷酸探针(20 fmo1),加超纯水至20 μL,混匀后,室温下反应30 min。在上述反应体系中加入上样缓冲液后在0.5×TBE环境中100 V恒压下电泳,至溴酚蓝移动到凝胶2/3-3/4处停止。将含有核蛋白-核苷酸探针复合物和游离探针的凝胶转移至带正电荷的尼龙膜,0.5×TBE,380 mA恒流,转膜60 min。用紫外手提式分析仪(254 nm)在尼龙膜上方大约1 cm处照射10 min,使寡核苷酸探针交联于尼龙膜上。封闭此膜,再加入链霉亲和素偶合辣根过氧化酶室温下摇动孵育15 min。后洗涤、平衡,进行增强化学荧光反应,即可显影、定影。X光图片采用Quantity One图像处理系统进行蛋白半定量分析。
7 统计学处理
采用SPSS 13.0统计软件进行分析,计量资料以均数±标准差(±s)表示,组间比较采用单因素方差分析,组内比较采用重复测量设计的方差分析。
结 果
1 造模前后血糖的变化
大鼠腹腔单次STZ注射前尾静脉血糖值为(4.7±1.2)mmol/L,注射后3 d明显升高至(30.9±6.8)mmol/L(P<0.01),并能持续到注射后28 d[(33.3±3.4)mmol/L],P <0.01。
2 行为学结果
DNP组STZ诱导后14 d,MWT值较造模前明显下降(P<0.05),且持续到STZ诱导后28 d(P<0.05);TWL值较诱导前明显缩短(P<0.05),并持续到STZ诱导后28 d。Cur组姜黄素治疗7 d后行为学即有改善,与DNP组相比,可升高MWT和延长TWL(P<0.05),而DNP+Sol组与DNP组两者之间行为学指标无明显差异,见表1。
表1 各组别不同时点机械痛阈和热痛阈比较Table 1.Comparison of MTL and TWL among different groups(±s.n=24)
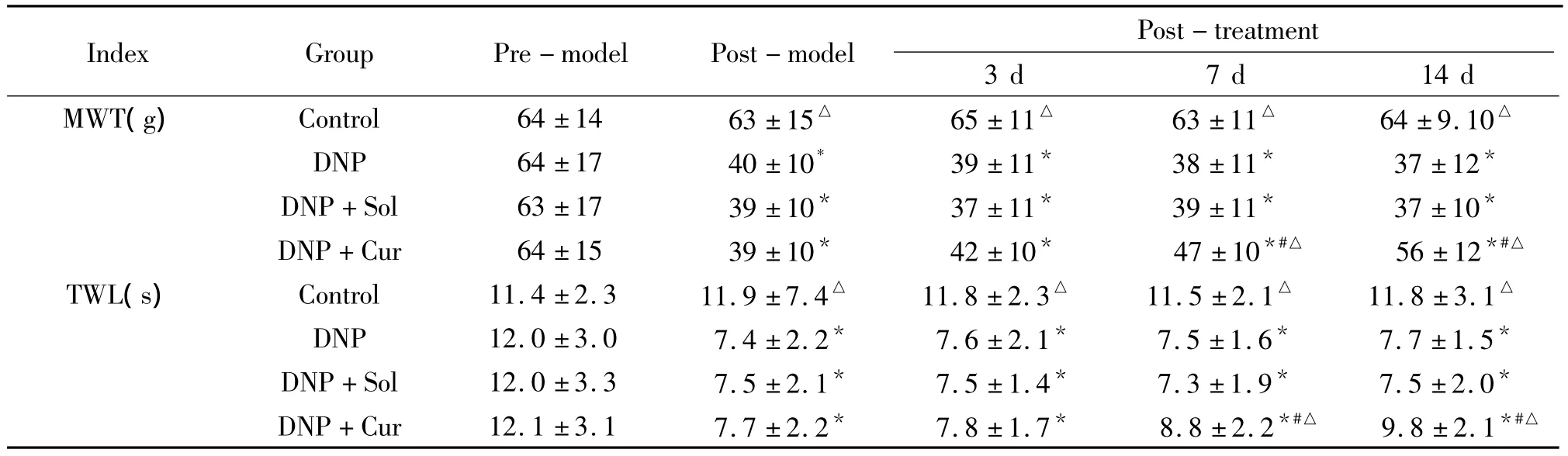
表1 各组别不同时点机械痛阈和热痛阈比较Table 1.Comparison of MTL and TWL among different groups(±s.n=24)
*P <0.05 vs pre-model;#P <0.05 vs post- model;△P <0.05 vs DNP group.
Post-treatment 3 d 7 d 14 d MWT(g) Control 64±14 63±15△ 65±11△ 63±11△ 64±9.10 Index Group Pre-model Post-model△DNP 64±17 40±10* 39±11* 38±11* 37±12*DNP+Sol 63±17 39±10* 37±11* 39±11* 37±10*DNP+Cur 64±15 39±10* 42±10* 47±10*#△ 56±12*#△TWL(s) Control 11.4 ±2.3 11.9 ±7.4△ 11.8 ±2.3△ 11.5 ±2.1△ 11.8 ±3.1△DNP 12.0 ±3.0 7.4 ±2.2* 7.6 ±2.1* 7.5 ±1.6* 7.7 ±1.5*DNP+Sol 12.0 ±3.3 7.5 ±2.1* 7.5 ±1.4* 7.3 ±1.9* 7.5 ±2.0*DNP+Cur 12.1 ±3.1 7.7 ±2.2* 7.8 ±1.7* 8.8 ±2.2*#△ 9.8 ±2.1*#△
3 p-ERK1/2的免疫组化结果
与control组相比,DNP组大鼠在STZ诱导后14 d,脊髓背角及背根神经节p-ERK1/2表达明显升高(P<0.05),Cur治疗14 d后 p-ERK1/2在脊髓(图1)及背根神经节(图2)表达较DNP组有所下降(P<0.05),DNP+Sol组脊髓背角及背根神经节p-ERK1/2的表达与DNP组无显著差异。

Figure 1.p-ERK1/2 expression in dosal horn detected by immunohistochemisty.A-C:p-ERK1/2 expression after 14 d treatment with curcumin(Cur);A:control;B:DNP;C:DNP+Cur.△P <0.05 vs control group;*P <0.05 vs DNP group.图1 免疫组化法检测脊髓背角p-ERK1/2表达
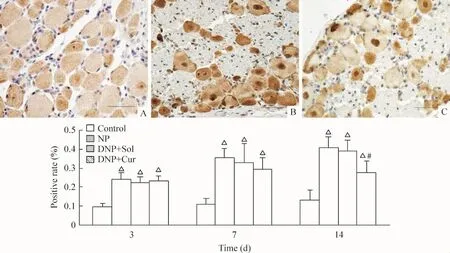
Figure 2.p-ERK1/2 expression in dorsal root ganglion after treatment with curcumin.A -C:p-ERK1/2 expression after 14 d treatment;A:control;B:DNP;C:DNP+Cur.△P <0.05 vs control group;#P <0.05 vs DNP group.图2 给药后背根神经节p-ERK1/2表达
4 p-ERK1/2的Western blotting结果
与正常组比较,STZ诱导后14 d脊髓背角及背根神经节p-ERK1/2表达上调(P<0.05),可持续至STZ诱导后28 d(P<0.05)。给予100 mg/kg Cur腹腔注射14 d后,与DNP组比较可明显降低p-ERK1/2的表达(P <0.05),见图 3、4;DNP+Sol组脊髓背角及背根神经节p-ERK1/2的表达与DNP组无显著差异。
5 AP-1的EMSA结果
与control组比较,STZ诱导后28 d脊髓背角AP-1表达上调(P <0.05),给予100mg/kg Cur腹腔注射14 d后,可明显降低脊髓背角AP-1的表达(P<0.05),见图5,但对背根神经节无影响(P >0.05),DNP+Sol组脊髓背角AP-1表达与DNP组无差异。
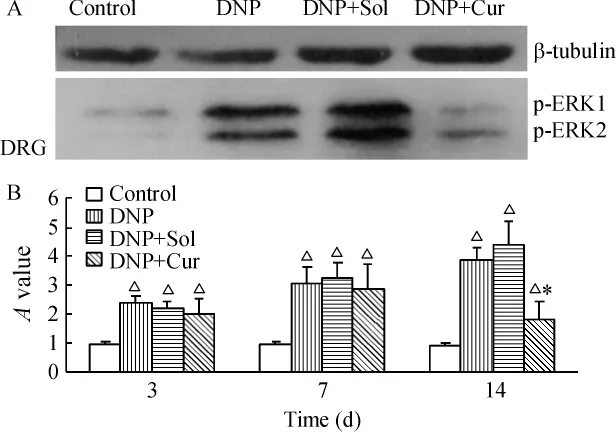
Figure 3.p-ERK1/2 expression in dorsal horn detected by Western blotting.A:p - ERK1/2 expression 14 d after treatment;B:p-ERK1/2 expression at different time points after treatment.△P < 0.05 vs control group;#P <0.05 vs DNP group.图3 Western blotting检测脊髓背角p-ERK1/2表达
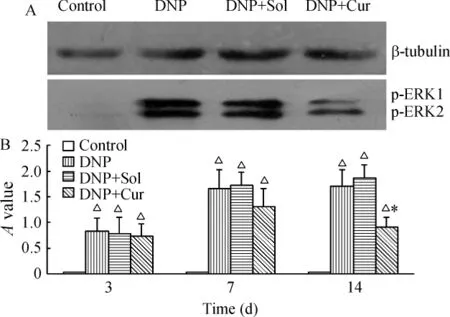
Figure 4.p-ERK1/2 expression in dorsal root ganglion detected by Western blotting.A:p - ERK1/2 expression 14 d after tratment;B:p-ERK1/2 expression at different time points after treatment.△P <0.05 vs control group;*P <0.05 vs DNP group.图4 Western blotting检测背根神经节p-ERK1/2表达
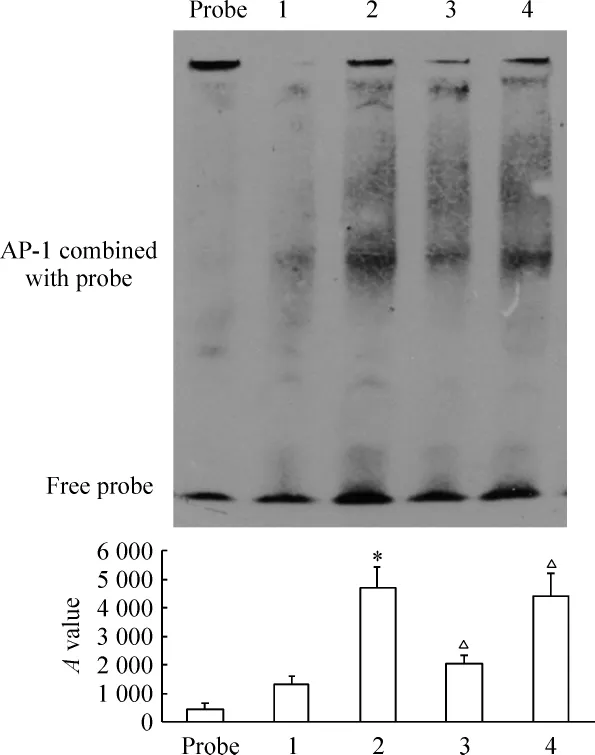
Figure 5.Expression of AP-1 in dorsal horn after 14-day Cur treatment by EMSA.*P <0.05 vs 1 group;△P <0.05 vs 2 group.1:control;2:DNP;3:DNP+Cur;4:DNP+Sol.图5 Cur治疗14 d后脊髓背角AP-1的表达
讨 论
本研究发现Cur治疗14 d后可改善糖尿病神经痛大鼠痛觉过敏的行为学表现,与其抑制糖尿病诱导的p-ERK1/2及AP-1激活呈现一致性。
STZ诱导的糖尿病动物模型,由于其稳定性及重复性好、方法简单、成功率高而被广泛用于制备糖尿病动物模型。临床研究发现,DNP随年龄增加和病程延长而恶化,且与血糖控制水平密切相关[6];但也发现一些血糖控制良好的患者其疼痛仍能持续数年,且部分患者其疼痛发作与血糖波动无一致性[7],认为高糖血症或代谢异常所致的高血糖是DNP神经病变的一个触发因素,是必要但不充分条件,其它下游分子机制如MAPK的激活可能参与了糖尿病神经痛的形成[1,8]。在周围神经损伤的模型中可以观察到脊髓ERK磷酸化而激活,并参与了痛觉过敏形成[9]。而 Purves等[10]研究发现在 STZ 诱导的糖尿病模型中腰段背根神经节出现ERK的激活。MAPK抑制剂U0126逆转了DNP动物模型下接着所致的痛觉过敏则进一步证实了MAPK在疼痛中的关键作用[5]。糖尿病导致元醇通路激活,促进了 DRG中MAPKs的激活[11],MAPK的激活促使转录因子如核因子 κB(nuclear factor- κB,NF - κB)、AP -1、p53等活化转移入核进而改变某些蛋白相关基因的表达,如一氧化氮(nitric oxide,NO)、环氧化酶2(cyclooxygenase 2,COX -2)、内皮素1(endothelin 1 ,ET-1)、黏附分子等表达增加,加重了炎症反应,对DNP的形成和持续至关重要。而ERK的激活还能通过非转录途径如磷酸化相关蛋白、关键受体、离子通道来提高神经元兴奋性,产生痛觉过敏[12,13]。本研究结果表明,正常大鼠脊髓背角和背根神经节中神经元细胞核p-ERK1/2和AP-1表达极少,STZ诱导后14 d大鼠背根神经节和脊髓背角p-ERK1/2表达开始上调,21 d脊髓p-ERK1/2高表达,28 d脊髓AP-1表达升高,此时大鼠的痛觉过敏,痛觉异常表现最为显著,提示p-ERK1/2及AP-1的激活与痛觉过敏呈现相同的趋势,提示激活的p-ERK1/2和AP-1可能参与了DNP的发生、发展与持续化的过程。
Cur具有抗炎、抗氧化应激、抗肿瘤、改善缺血再灌注损伤等药理作用[14,15]。Cur能通过抑制 TNF-α、NO的表达而缓解糖尿病大鼠热痛觉过敏[16]。Cur能下调TGF-β1来抑制大鼠系膜细胞AP-1的活化[17]。Bierhaus等[18]证实 Cur能直接抑制 AP -1与其相应的DNA序列结合而发挥抑制作用。
Cur治疗14 d后可明显下调糖尿病神经痛大鼠脊髓背角及背根神经节中p-ERK1/2和脊髓AP-1的表达。其潜在机制可能是Cur在DNP发生的早期抑制了ERK1/2磷酸化,在DNP的后期则抑制AP-1的激活及其下游的级联反应,如各种炎症因子的表达。
本研究结果提示Cur可对抗糖尿病神经病理性疼痛,抑制了ERK与AP-1的激活,但由于缺乏特异性的ERK拮抗剂,因此我们不能确定Cur对AP-1的抑制作用是通过ERK通路亦或是直接作用于AP-1。同时在应用Cur后,糖尿病大鼠神经痛的行为学改善早于生化指标p-ERK1/2及AP-1表达的改变,提示Cur抗糖尿病大鼠神经痛还可能存在其它途径。
[1]Tsuda M,Ueno H,Kataoka A,et al.Activation of orsal horn microglia contributes to diabetes-induced tactile allodynia via extracellular signal-regulated protein kinase signaling[J].Glia,2008,56(4):378 -386.
[2]何伶俐,曹 红,贺端端,等.姜黄素对大鼠神经病理性痛的影响[J].中华麻醉学杂志,2008,28(9):790-793.
[3]Aggarwal BB,Bhatt ID,Ichikawa H,et al.Curcumin -biological and medicinal properties[A].In:Ravindran PN,Nirmal Babu K,Sivaraman K.eds.Turmeric:the genus Curcuma[M].1st ed.Boca Raton:CRC Press,2007.297-368.
[4]Morrow TJ.Animal models of painful diabetic neuropathy:the STZ rat model[A].In:Crawley JN.eds.Current protocols in neuroscience[M].New York:J.Wiley,2004.Unit 9.18.
[5]Daulhac L,Mallet C,Courteix C,et al.Diabetes- induced mechanical hyperalgesia involves spinal mitogen-activated protein kinase activation in neurons and microglia via N-methyl-D -aspartate-dependent mechanisms[J].Mol Pharmacol,2006,70(4):1246 - 1254.
[6]Li F,Abatan OI,Kim H,et al.Taurine reverses neurological and neurovascular deficits in Zucker diabetic fatty rats[J].Neurobiol Dis,2006,22(3):669 - 676.
[7]Partanen J,Niskanen L,Lehtinen J,et al.Natural history of peripheral neuropathy in patients with non-insulindependent diabetes[J].N Engl J Med,1995,333(2):89–94.
[8]Middlemas AB,Agthong S,Tomlinson DR.Phosphorylation of c-Jun N-terminal kinase(JNK)in sensory neurones of diabetic rats,with possible effects on nerve conduction and neuropathic pain:prevention with an aldose reductase inhibitor[J].Diabetologia,2006,49(3):580 -587.
[9]Zhuang ZY,Gerner P,Woolf CJ,et al.ERK is sequentially activated in neurons,microglia,and astrocytes by spinal nerve ligation and contributes to mechanical allodynia in this neuropathic pain model[J].Pain,2005,114(1-2):149-159.
[10]Purves T,Middlemas A,Agthong S,et al.A role for mitogen-activated protein kinases in the etiology of diabetic neuropathy[J].FASEB J,2001,15(13):2508 -2514.
[11]Zatechka DS Jr,Kador PF,Garcia - Casti˜neiras S ,et al.Diabetes can alterthe signal transduction pathways in the lens of rats[J].Diabetes,2003,52(4):1014 -1022.
[12]Yang SH,Sharrocks AD,Whitmarsh AJ.Transcriptional regulation by the MAP kinase signaling cascades[J].Gene,2003,320:3 -21.
[13]Minchenko AG,Stevens MJ,White L,et al.Diabetes-induced overexpression of endothelin-1 and endothelin receptors in the rat renal cortex is mediated via poly(ADP-ribose)polymerase activation[J].FASEB J,2003,17(11):1514-1516.
[14]Maheshwari RK,Singh AK,Gaddipati J,et al.Multiple biological activities of curcumin:a short review[J].Life Sci,2006 ,78(18):2081 -2087.
[15]舒建昌,吴海恩,皮新军,等.姜黄素抑制肝纤维化大鼠脂质过氧化物的生成及肝脏TGF-β1和PDGF的表达[J].中国病理生理杂志,2007,23(12):2405 -2409.
[16]Sharma S,Kulkarni SK,Agrewala JN,et al.Curcumin attenuates thermal hyperalgesia in a diabetic mouse model of neuropathic pain[J].Eur J Pharmacol,2006,536(3):256-261.
[17]Han JS,Choi BS,Yang CW,et al.Aldosterone-induced TGF-β1expression is regulated by mitogen-activated protein kinases and activator protein-1 in mesangial cells[J].J Korean Med Sci,2009,24(Suppl):S195 -S203.
[18]Bierhaus A,Zhang Y,Quehenberger P,et al.The dietary pigment curcumin reduces endothelial tissue factor gene expression by inhibiting binding of AP-1 to the DNA and activation of NF - kappa B[J].Thromb Haemost,1997,77(4):772-782.
