胰腺大部切除法制作大鼠高血糖模型的实验研究
2011-01-30章乐虹
李 勇 ,章乐虹
1.四川省雅安市人民医院普外科,四川雅安 625000;2.广州医学院第二附属医院普外科,广东广州 510260
目前,糖尿病及其并发症的病因和发病机制尚未完全阐明,进一步深入探讨糖尿病发病机制及治疗方式有赖于理想的动物模型的建立。因而,研究临床糖尿病前期机体的相关变化及代偿情况无疑能为进一步探索糖尿病发病机制、寻找新的治疗方法提供更多的资料。为此,本文设计使用胰腺大部切除法制作大鼠高血糖模型,并对制作方法及相关生化、形态学指标进行监测。
1 材料与方法
1.1 实验动物及分组
实验动物:清洁级SD大鼠60只(雌雄不拘,广州医学院实验动物中心提供),体重(200±30)g。大鼠随机分为三组:胰腺切除加高糖饮食组(P+H组,n=30);胰腺切除组(P组,n=20);假手术加高糖饮食组(H 组,n=10)。
1.2 实验方法
胰腺切除加高糖饮食组(P+H组)行胰腺大部切除术,按3.5 ml/100 g体重,使用10%水合氯醛作大鼠腹腔内注射麻醉后,无菌状态下开腹,切除大鼠胰腺>90%,切除范围包括大网膜、脾脏及十二指肠曲中大部分胰腺组织。术后肌肉注射青霉素5万U/100 g三次,并予高糖饮食饲养(基础饲料为常规饲料,蛋白、脂肪、糖的比例分别为23.4%、4.4%、54.6%,予20%糖水作为饮用水)。胰腺切除组(P组),手术及基础饲料同胰腺切除加高糖饮食组,但饮用水中不加糖。假手术高糖饮食组(H组),开腹后不切除胰腺仅作脾脏切除,其余处理同胰腺切除加高糖饮食组。
1.3 观测指标
血糖变化:三组大鼠均于术后每24小时使用微量血糖仪测定空腹末梢血糖(尾部或耳部针刺取血),连续三次,72 h后每周测量一次直至术后第12周,测量前大鼠禁饮食(清晨起禁食)8 h。术后2 d起,连续二次空腹血糖(FBG)≥7.0 mmo1/L且无连续二次空腹血糖≥16.67 mmo1/L为高血糖模型,出现连续二次FBG≥16.67 mmo1/L为糖尿病模型[1-4]。
血胰岛素及体重变化:每15天断尾取血使用固相放免法(北京东亚免疫技术研究所提供)测胰岛素同时称量体重变化。
糖耐量反应:术后30 d,取三组大鼠测定空腹血糖后即按体重0.5 g/100 g灌喂葡萄糖,随后分别测定0.5、1.0、3.0 h血糖。
HE染色:取正常及病程不同阶段大鼠胰腺、肝、肾组织常规脱水、透明、包埋制成石蜡切片,HE染色,光镜下观察。
免疫组化检测:抗胰岛素抗体,用SABC法(一抗及试剂盒均由武汉博士德公司提供)对大鼠胰腺石蜡切片进行染色,检测beta细胞数量及功能。
1.4 数据处理
2 结果
2.1 血糖变化
三组大鼠血糖随时间的变化关系见表1。其中P+H组20只大鼠术后72 h死亡2只,以后死亡1只(术后肠梗阻),成糖尿病模型(出现连续二次FBG≥16.67 mmo1/L)4只,其余13只均成高血糖模型,成高血糖模型率65%,成糖尿病模型率20%。单纯胰腺切除组(P组)在术后24 h也同样出现明显血糖升高,前48 h空腹血糖与P+H组比较无统计学差异,但术后72 h起血糖即逐渐下降至接近正常水平,未出现糖尿病模型,有三只成高血糖模型,成高血糖模型率15%。假手术高糖饮食组(H组)术后空腹血糖变化不明显,未出现糖尿病模型及高血糖模型。整个实验过程中成模动物无致死性低血糖等的发生,均未使用胰岛素治疗。

表1 三组大鼠胰腺大部分切除后血糖情况(mmol/L)
2.2 空腹血胰岛素水平变化
三组大鼠胰岛素水平随时间的变化关系见表2。P+H组血胰岛素水平最低、H组则最高、P组介于两者之间。两两均数的t检验显示P+H组与P组及H组比较有显著性差异(P<0.01),而P组与H组比较亦低于H组且有统计学差异(P<0.01)。
2.3 糖耐量反应
术后2个月,三组大鼠糖耐量反应结果见表3,示P组对糖刺激耐受低于H组,给糖前两者血糖浓度无显著性差异,但给糖后30、60、180 min P组血糖浓度均高于H组(P<0.01);而P+H组血糖则始终高于另两组。

表2 三组大鼠胰腺大部分切除后血胰岛素变化情况(mU/L)

表3 三组大鼠胰腺大部分切除术后2个月糖耐量试验结果(mmol/L)
2.4 HE染色结果
P+H组(图1)高血糖模型大鼠胰岛有不同程度萎缩、体积缩小,未见明显胰岛纤维化及胰岛分布稀疏等改变,在糖尿病模型大鼠中也出现类似改变。P组(图2)可见胰岛体积增大,胰岛细胞肥大。H组中也见部分大鼠胰岛呈类似改变。

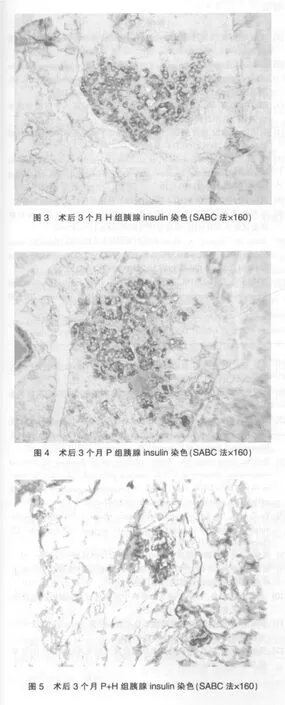
2.5 免疫组化检测结果
P组及H组在术后3个月beta细胞的胰岛素染色较P+H组增强,beta细胞数量亦较后者为多(图3~5)。
3 讨论
国内外糖尿病模型大致分为实验性和自发性糖尿病模型,前者多采用链脲霉素(STZ)等胰岛损伤性药物制备。但是,糖尿病本身的类型多样,除原发性糖尿病外,胰腺损伤、内分泌疾病、药物、感染等多种因素均可致继发性糖代谢异常,而这些病变则难以用前述模型模拟。并且,糖尿病发病过程是一个渐进、连续的过程,出现临床症状的糖尿病已是机体代偿机制不足以弥补各种病理因素作用的累积结果。
3.1 动物糖尿病模型制作方法
目前,国内外对实验动物糖尿病模型的制备多使用化学药物(链脲霉素、四氧嘧啶等)引起胰岛beta细胞损伤来完成,按不同的浓度及给药方式可以模拟出类似体内1、2型糖尿病环境[1-4]。对手术切除法制模在不同的文献报道有差异,有认为手术切除加高糖饮食刺激可制备继发性永久性糖尿病模型,国外报道则多是对有遗传易感性的肥胖大鼠行胰腺大部分切除而获得[2,5,6]。本实验采用胰腺切除加高糖饮食法,对手术切除范围有所改进,因大鼠胰腺分布散在,按常规切除脾脏下至十二指肠部位的胰腺范围不足,且胰腺与脾脏关第紧密,若保留脾脏则可能增加术中损伤血管出血的风险且影响切除范围。因此我们选择切除包括大网膜、脾脏及十二指肠曲中大部分胰腺组织,同时剔除位于胆总管外侧胰腺的手术方式,这样可以确保有足够的切除范围(90%~95%)。手术死亡率为10%,比传统切除范围的死亡率[7](5%)稍高。在使用高糖饮食上,因大鼠高糖饮食配方及制作过程较复杂,故在使用基础饲料的基础上以含20%葡萄糖的自来水作饮用水替代,此饲料中并无高脂食物的影响且制作及使用简单。制模结果看,单纯胰腺切除组(P组)在术后48小时内血糖均明显升高,但术后72 h起又渐下降至接近正常水平,观察3个月内无糖尿病模型产生,出现高血糖模型率仅15%。在随后的糖耐量试验中P组则显示胰岛素储备不足,对糖刺激的耐受力差,这与其它文献报道结果相近[5,7]。这说明大鼠对物理性的胰岛素不足有较强的代偿和调节能力,在常规饮食情况下能较快恢复血糖稳定,但对突发的高糖饮食刺激则缺乏足够的耐受和调控能力。故即使扩大切除范围至90%~95%,单纯胰腺大部切除也只能导致短时间的大鼠血糖升高,因而该方法不适宜作高血糖动物模型制备但可作糖耐量异常的动物模型制备。在胰腺切除加高糖饮食组(P+H组)术后即出现血糖升高,观察3个月内血糖始终维持在较高水平,成高血糖模型率65%,成糖尿病模型率20%,术后胰岛素浓度较另两组均偏低(P<0.05,糖耐量反应也低于假手术高糖饮食组(H组)。表明在胰腺大部分切除的基础上,持续的高糖饮食刺激可抑制大鼠胰岛beta细胞的代偿和调节能力,从而形成高血糖状态。因本实验所测血糖均为空腹血糖且据相关文献[1,2,6,8,9]报道当大鼠血糖浓度持续≥16.67 mmo1/L时即可产生对胰岛细胞的损害作用,故我们也选择以连续两次血糖浓度≥16.67 mmo1/L作为判断是否构成糖尿病的标准。本实验多数大鼠只形成稳定的高血糖模型而未达到糖尿病模型标准,这可能与使用加糖饮水替代的高糖饮食对胰岛细胞的攻击弱于传统高糖饮食以及地域差异和观察时间还不足够长有关。但这一稳定的高血糖大鼠模型正好为研究临界糖尿病前期病理生理改变及可能的药物和治疗方法干预提供良好的实验对象。
3.2 胰腺大部切除及高糖饮食对胰岛细胞的影响
本实验对三组受试对象残余胰腺组织的病理标本及免疫组化分析显示,在单纯胰腺大部切除或单纯高糖饮食作用下,在实验观察期内可见胰岛有不同程度肥大、增生,beta细胞的胰岛素染色增强、增多。而在胰腺大部分切除的基础上加用高糖饮食刺激组(P+H组)则出现相反的改变,部分胰岛有萎缩、体积缩小,beta细胞胰岛素染色也弱于P组及H组,这在成糖尿病模型大鼠中尤为明显。这说明在单纯胰腺物理损伤及适度高糖饮食刺激下,胰岛会通过增生、肥大等方式增加胰岛素分泌以弥补体内胰岛素不足从而维持血糖浓度稳定。但在两种因素同时作用时,胰腺的代偿已不足以维持血糖浓度稳定,机体长期处于高血糖状态,这时残存胰岛超负荷后即显示出高血糖状态对胰岛的毒性作用,因而出现胰岛萎缩、beta细胞减少等改变,出现这一改变后与高血糖状态互为因果、相互促进启动糖尿病的进程。
4 结论
单纯的胰腺大部分切除或适当高糖饮食可刺激胰岛细胞代偿性的增生、肥大,而当两者联合作用使血糖浓度长期处于较高状态时则显示对胰岛细胞的毒性作用,出现胰岛萎缩、beta细胞减少等改变。
独立使用手术切除大部分胰腺的方法难以制作理想的高血糖大鼠模型,但可制作糖耐量异常的动物模型,联合手术切除及高糖饮食刺激可制成稳定的高血糖模型,制作方法可靠,成模率高,但制作糖尿病模型则成模率相对较低。
[1]于德民,吴锐.实验性链脲佐菌素糖尿病动物模型的研究[J].中华糖尿病杂志,1995,3(2):105-112.
[2]Kanda M,Satoh K,Ichihara K.Effects of atorvastatin and pravastatin on glucose tolerance in diabetic rats mildly induced by streptozotocin[J].Biological and Pharmaceutical Bulletin,2003,26:1681-1684.
[3]杨亦彬,张翥,苏克亮,等.链脲佐菌素诱导大鼠糖尿病肾病模型的方法学探讨[J].华西医学,2005,20(2):299-300.
[4]吴清洪,顾为望,袁进.链脲佐菌素诱导建立I型糖尿病大鼠模型[J].动物医学进展,2006,27(8):114-116.
[5]Ogino T,Zhu M,Murakami T,et al.Effect of partial pancreatectomy on beta-cell mass in the remnant pancreas of Wistar fatty rats[J].J Med Invest,1998;45(1-4):103-110.
[6]魏泓.医学实验动物学[M].2版.成都:四川科技出版社,1998:487-490.
[7]吴希美,谢强敏,唐法娣,等.糖尿病动物模型——大鼠胰腺切除后糖耐量试验法的探讨[J].中药药理与临床,1998,14(1):47-48.
[8]Jonas JC,Sharma A,Hasenkamp W,et al.Chronic hyperglycemia triggers loss of pancreatic beta cell differentiation in an animal model of diabetes[J].J Biol Chem,1999,14;274(20):14112-14121.
[9]Weir GC,Laybutt DR,Kaneto H,et al.Beta-cell adaptation and decompensation during the progression of diabetes[J].Diabetes,2001,50(Suppl 1):S154-159.
