苦参碱改构体X抑制鼻咽癌细胞CNE2增殖作用的实验研究
2011-01-30李静雨唐安洲王立升谢利红钟华林
李静雨,唐安洲,王立升,冉 伟,谢利红,钟华林
广西医科大学第一附属医院,广西南宁 530021
鼻咽癌是我国最常见的头颈部肿瘤,尤其在两广地区,发病率更高。目前鼻咽癌的唯一根治性治疗手段是放疗,但是由于肿瘤的远处转移和放射的局部损伤作用,给进一步改善晚期鼻咽癌患者的预后和生活质量带来了困难[1],因此需要越来越多的化疗手段介入。苦参碱是近年受到关注的抗肿瘤成分,并且有研究表明其具有诱导肿瘤细胞凋亡的作用,如鼻咽癌[2]、肝癌[3]、膀胱癌[4]等,并且在临床上的应用也非常广泛,但是它的生物利用率并不是特别高。为了使其活性和生物利用度更高,笔者以苦参碱为先导化合物,通过化学合成方法对其结构进行改造,合成了20个结构新颖的苦参碱衍生物。苦参碱改构体X正是从中初步筛选出的具有抗肿瘤活性的成分,本实验研究了该药对人鼻咽癌细胞CNE2体外增殖的影响,并探讨其机制,此研究尚属首例。
1 材料与方法
1.1 材料
1.1.1 细胞 人鼻咽癌细胞株CNE2由中南大学湘雅中心实验室购得,人脐静脉内皮细胞株购自上海生命科学院,由本实验室接种保存。CNE2细胞和人内皮细胞株培养于含10%灭活胎牛牛血清,100 U/ml青霉素和100 U/ml链霉素的RPMI-1640培养液中,置于37℃、相对湿度90%,5%CO2培养箱内培养,定期观察,用0.25%胰蛋白酶联合0.02%EDTA消化传代。
1.1.2 药物 苦参碱改构体X由广西大学王立升教授惠赠,化学名称14-噻吩基次亚甲基苦参碱。药物先以无水乙醇溶解,然后用生理盐水等体积稀释,过滤除菌,4℃保存。其结构式见图1。
1.1.3 试剂和仪器 RPMI-1640改良型培养液购自hyclone公司,胎牛血清购自杭州四季青公司,胰蛋白酶购自GIBCO公司,噻唑兰(MTT)、PBS、DMSO 购自 Sigma公司,凯基 Annexin V-EGFP细胞凋亡检测试剂盒和凯基细胞周期试剂盒。培养瓶购自corninggs,CKX41型倒置显微镜购自日本Olympus公司,酶标仪(美国RT-2100型)、恒温水浴锅(北京市医疗设备厂)、电热鼓风干燥箱购自上海市实验仪器总厂,-86℃超低温冰箱(美国Forma公司),Eppendorff 58108型高速冷冻离心机(德国Eppendorff公司),2300型CO2培养箱(美国Shellab公司),EPICSXL流式细胞仪(美国贝克曼库尔特公司),SCV4A1型超净工作台(新加坡ESCO公司)。

1.2 方法
1.2.1 细胞形态观察 细胞接种于25 ml培养瓶中,于对数生长期加苦参碱改构体药液,浓度为 25、50、100、200、400 mg/L,24 h后倒置显微镜下观察,放大倍数分别是10×20和10×40。
1.2.2 细胞毒性实验(MTT法)取对数生长期CNE2细胞和人内皮细胞按每孔6×103个细胞接种于96孔板中,于第2天下午加入不同浓度的苦参碱改构体药液,浓度分别为25、50、100、200、400 mg/L,并加入相应比例完全培养基共 200 μl;另设溶剂组、阴性对照组、空白对照组(调零孔),除完全培养基、MTT、二甲基亚砜外,其中溶剂组加无水乙醇的生理盐水等体积稀释液、完全培养基、细胞,阴性对照组加细胞,调零孔只加完全培养基、MTT和二甲基亚砜。每个浓度均设4个复孔,于终止前4 h,每孔加入5 g/L MTT溶液20 μl,继续孵育4h后弃去上清液,加入150μl二甲基亚砜,轻轻振荡10min,使结晶物完全溶解,于570 nm波长处在荧光酶联分析仪上测光吸收值(A 值),计算抑制率(IR)。IR(%)=(对照孔 A 值-实验孔A值)/对照孔A值×100%。
1.2.3 流式细胞仪检测细胞周期分布和细胞凋亡 细胞接种于25 ml培养瓶中,于对数生长期加苦参碱改构体药液,浓度为 25、50、100、200、400 mg/L,并加入相应比例完全培养基至5 ml,24 h后依据试剂盒说明书收集细胞送检。以增殖指数分析细胞的增殖活性:PI=(S期细胞数+G2/M期细胞数目)/三期细胞数目总和。
1.3 统计学方法
采用 SPSS 13.0统计软件进行分析,计量资料均数±标准差(±s)表示。
2 结果
2.1 细胞形态学观察
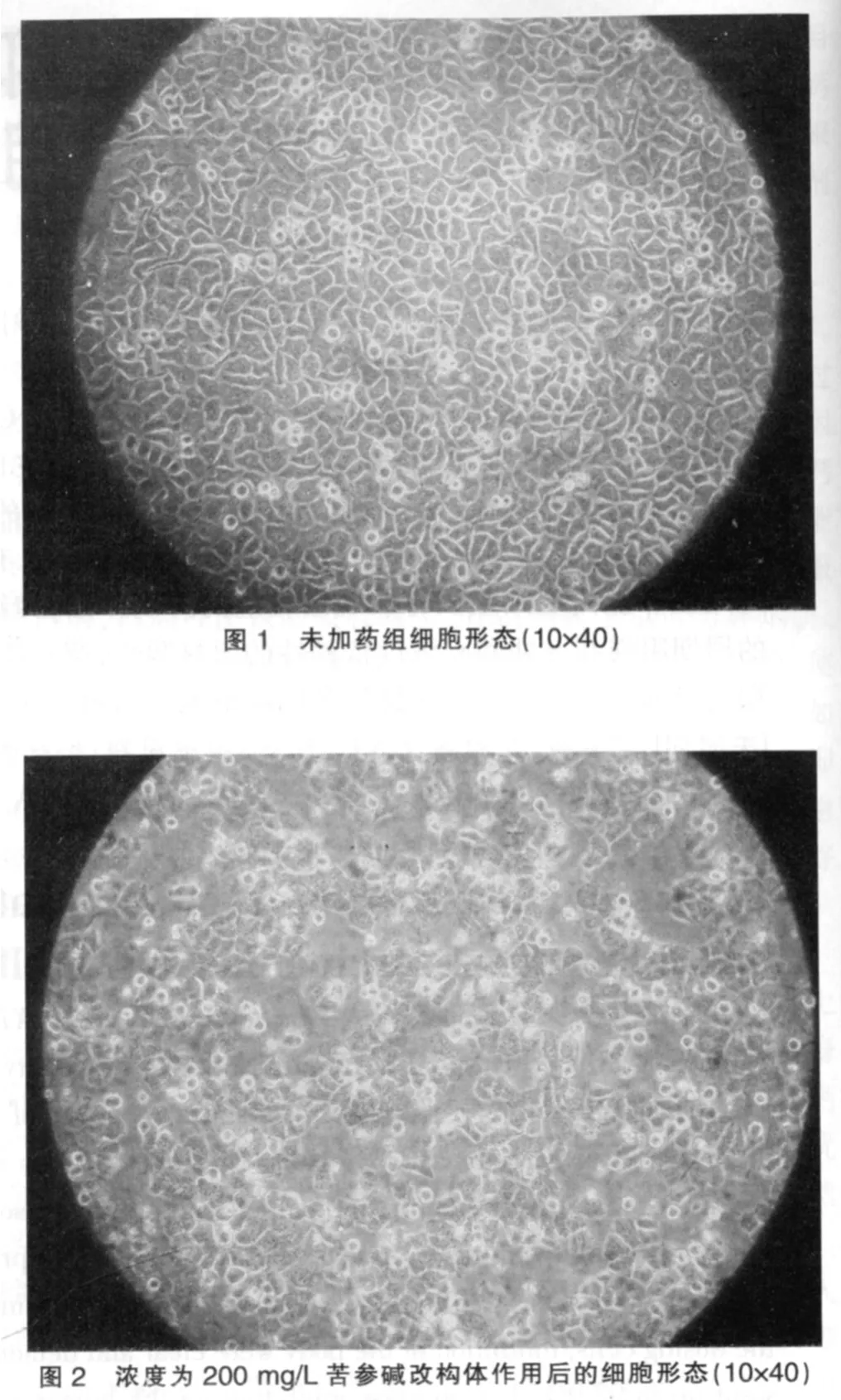
见图 1~3。
如图1所见,未干预细胞贴壁生长,呈延展和扁平,细胞均质而透明,核膜核仁轮廓明显,细胞间结构紧密,生长旺盛。在药物干预之后,如图2、3可见细胞膜完整但出现发泡现象,贴壁细胞出现皱缩、变圆、脱落,随浓度递增表现愈明显。
2.2 细胞毒性试验结果(MTT)
由表1可见随着加药浓度增加,苦参碱改构体对鼻咽癌细胞的生长均具有明显抑制作用,最大可达97.9%,经SPSS[5]可求得改构体对细胞株CNE2的IC50为(106.378±0.825)。而由表2可见,对于人脐静脉内皮细胞苦参碱改构体基本上没有抑制作用,排除溶剂的干扰,其抑制率最大仅7.7%,远远低于同浓度处与CNE2的抑制率,故可以认为苦参碱改构体的具有特异性抗肿瘤作用。
2.3 细胞周期分布
用流式细胞仪分析五个浓度梯度的苦参碱改构体药液对鼻咽癌细胞株CNE2周期改变的影响。其中,对照组S期比例为15.69%、增殖指数为28.7,加药组的S期比例由25~400 μg/ml分别为 19.66%、28.15%、22.60%、29.28%、29.07%,对照组明显低于各个浓度的加药组,可见该药通过细胞周期抑制肿瘤细胞增殖的调控点很可能就在S期。
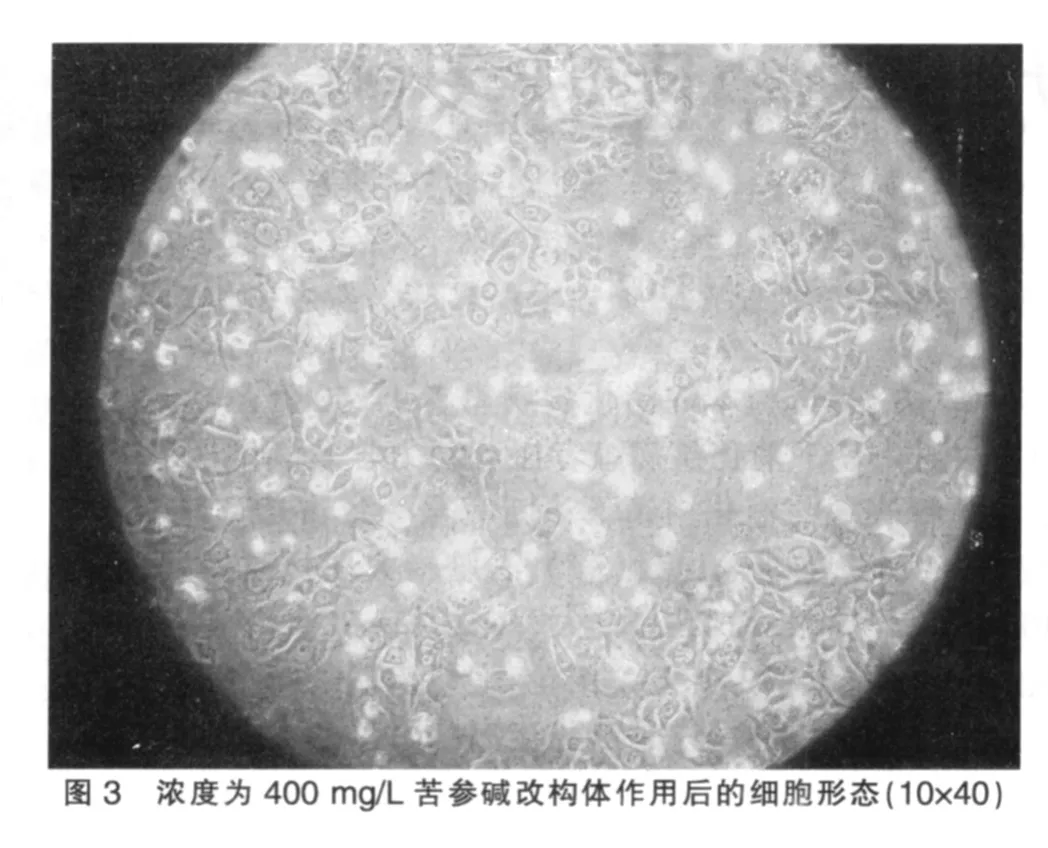
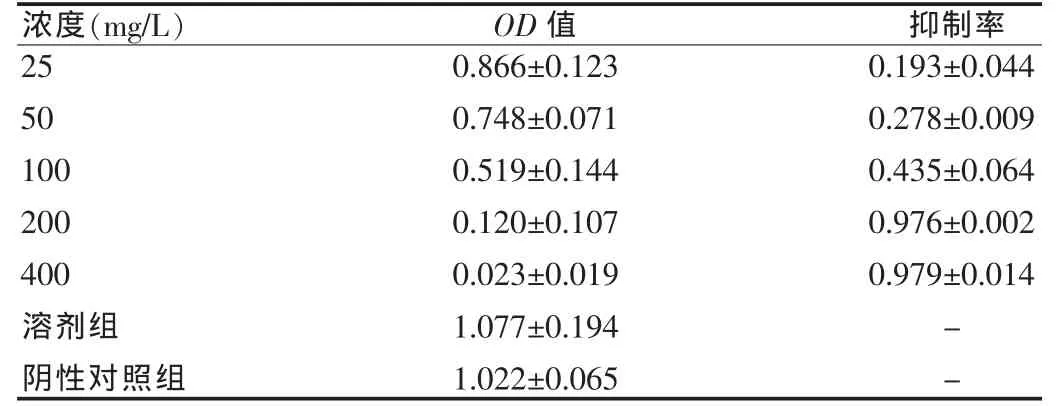
表1 不同浓度苦参碱改构体作用48 h后对人鼻咽癌细胞株CNE2的增殖影响
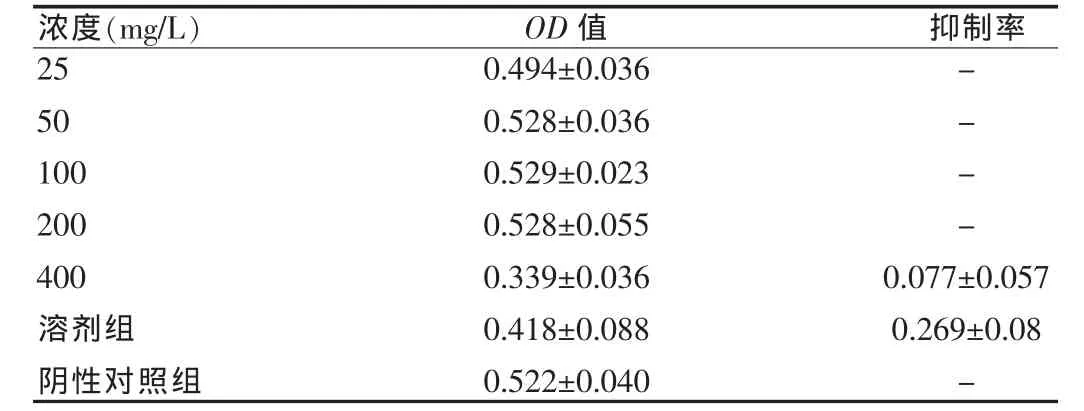
表2 不同浓度苦参碱改构体作用48 h后对人内皮细胞的增殖影响
2.4 流式细胞仪检测细胞凋亡情况
浓度在25、50 μg/ml处已开始出现凋亡,凋亡率分别为27.28%、28.69%;100、200 μg/ml处明显出现凋亡, 细胞凋亡超过了50%;浓度为400 μg/ml时凋亡率已达到89.71%,表现出了很强的抑制作用。
3 讨论
苦参碱是纯天然生物碱类药物,其制剂已广泛用于治疗慢性肝炎和肝纤维化,并表现出了一定的抗癌作用,针对其抗肿瘤特点加强相关衍生物和新制剂的研究,可以充分发挥传统中药的抗肿瘤特性[6]。研究所用苦参碱改构体X由广西大学化学化工学院王立升教授惠赠,实验通过倒置显微镜观察细胞形态变化、MTT检测药物抑制率、流式细胞仪检测细胞周期和凋亡,笔者发现苦参碱改构体有很强的肿瘤抑制作用,并且不损伤正常细胞。李海英等[2]研究苦参碱抗鼻咽癌细胞CNE2作用时,其48 h IC50为710 μg/ml,而此改构体为(106.378±0.825) μg/ml,仅为苦参碱的七分之一,其抗鼻咽癌药效远远强于苦参碱。
细胞周期是细胞的基本生命活动,许多化疗药物就是通过阻滞正常细胞周期的激活靶点,达到抑制肿瘤细胞的分裂增殖的目的[7]。本实验通过流式细胞仪检测细胞加药前后细胞周期时相分布结果显示:苦参碱改构体处理细胞24 h后,各浓度组的细胞周期S期细胞含量与对照组相比明显增加(P<0.05),随浓度递增含量亦随之增加,表现出细胞被阻滞于S期,从而抑制细胞分裂,参与完成其细胞增殖抑制作用。实验通过流式细胞仪检测细胞凋亡结果显示:与对照组相比,各浓度组具有明显的促进凋亡作用(P<0.05),其凋亡率表现出了剂量依赖性,并与细胞周期S期细胞含量大小一致。流式细胞仪结果结合细胞形态变化示此苦参碱改构体有体外诱导鼻咽癌细胞株CNE2凋亡的作用。
细胞周期作为一个抗肿瘤药物作用的新靶点正在被越来越多的研究者关注和认可[8-9],被认为可以最大限度地减少耐药、突变及毒性的发生机会[10],通过本实验笔者发现苦参碱改构体可以明显地阻滞细胞增殖于S期,表现出显著的促细胞凋亡作用,而且不损伤正常细胞。为提高药物的抗肿瘤活性和选择性作用,还需要进一步从分子水平探讨其对细胞周期和细胞调控机制的影响,并找出其具体的作用靶点,从而在整体上了解其作用机制。
[1]罗京伟,徐国镇.鼻咽癌治疗的进展.[J].中华耳鼻咽喉科杂志,2004,39(8):509-512.
[2]李海英,张力.苦参碱抗人鼻咽癌细胞株CNE2细胞的作用及其机制研究[J].浙江中医杂志,2009,44(1):27-29.
[3]程少冰,赵昌林.苦参碱诱导人肝癌细胞株HpG2-2-15凋亡的实验研究[J].时珍国医国药,2010,21(5):1123-1125.
[4]单广夷,盛玉文.苦参碱对人膀胱癌EJ细胞株凋亡的影响及机制[J].山东医药,2010,50(11):43-45.
[5]赵斌,葛金芳,朱娟娟,等.小议在MTT法测细胞增殖抑制率中IC50的计算方法[J].安徽医药,2007,11(9):834-835.
[6]李克雄,徐鹏,徐为公.苦参碱类生物抗癌作用研究进展[J].中国新药杂志,2010,19(21):48-52.
[7]Chovolou Y,Watjen W,Kampkotter A,et al.Downregulation of NF-kB activation in a H4IIE transfectant insensitive to doxorubicin-induced apoptosis[J].Toxicology,2007,232(1/2):88-98.
[8]Schwartz GK,Shah MA.Targeting the cell cycle:a new approach to cancer therapy[J].J Clin Oncol,2005,(23):9408-9421.
[9]Vermeulen K,Van Bockstaele DR,Berneman ZN.The cell cycle:a review of regulation,deregulation and therapeutic targets in cancer[J].Cell Prolif,2003(16):131-149.
[10]McDonald ER,Deiry WS.Cell cycle control as a basis for cancer drug development(Review)[J].Int J Oncol,2000,(16):871-886.
