N-乙酰天门冬氨酸测定在急性脑梗死的临床应用
2011-01-30佘君慧林达伟
佘君慧,林达伟
上海市闸北区中心医院神经内科,上海 200070
随着老年化及各种危险因素的增多,脑梗死成为目前人类发病率、患病率、死亡率和致残率都很高的疾病之一,人们对它的重视及现代诊疗技术的提高,脑梗死的急救成功率大大提高。磁共振波谱(magnetic resonance spectroscopy,MRS)是现今唯一可以用来观察活体细胞代谢的无创伤性检测手段,它能对检测脑部疾病的病理生理变化即神经生物化学的改变进行研究。希望利用MRS早期诊断脑梗死并可指导治疗和判断预后。本实验利用MRS分析技术[1],对急性脑梗死前后N-乙酰天门冬氨酸的值进行测定比较从而对其结果进行分析研究。
1 资料与方法
1.1 一般资料
选取2009年1月~2010年10月我科收住院的90例首发急性脑梗死患者,发病时间在6 h~7 d之间,其中,男56例,女34例;年龄45~85岁,男性平均60.56岁,女性71.91岁。均为右利手。
1.2 诊断标准
90例患者均根据《临床诊疗指南-神经病学分册》(中华医学会编著)制订的脑梗死的诊断依据,初次发病,且发病时间在6 h~7 d,经头部CT或MRI检查可发现梗死灶,并经头颅弥散加权成像(diffusion-weighted imaging,DWI)明确为急性脑梗死。排除标准:病情严重或伴有意识障碍不能配合者。
1.3 检查方法及监测指标
采用Achieva1.5TMRI磁共振扫描仪(荷兰PHILPS公司),标准发射/接收头线圈。所有患者进行常规横断、冠状、矢状位 T1WI(TR/TE:106/1.7 ms)、T2WI(TR/TE:3 526/110 ms) 及DWI(TR/TE:1 772/55 ms)。 采用 H-MRS(成像参数:TR/TE=2 000/288 ms,层厚=1 mm,矩阵=512×512),激励水抑制法采集信号,在急性脑梗死的中心选定1 cm×1 cm×1 cm中心地带,并在对称健侧部位选定同样大小的区域,二维多体素取样。MRS扫描后经软件包进行常规后处理,分别在治疗前(患侧1)、治疗2周后(患侧2)病灶中心区及治疗前健侧对照区(健侧)进行数据采集,自动完成N-乙酰天门冬氨酸谱线下的面积计算。所有患者于治疗前及治疗后2周进行神经功能缺损(美国国立卫生院神经功能缺损评分,NIHSS)测定。
1.4 统计学方法
采用Epidata 2.1进行数据库管理;使用Shapiro-Wilk进行正态性检验,不符合正态分布的数据采用中位数和四分位数范围进行描述,差值的比较采用配对符号秩和检验,检验统计量为S,治疗前患侧NAA和NIHSS不符合二元分布,故采用Spearman秩相关分析二者的相关性。统计学软件采用SAS 9.13。统计学描述为中位数(上四位数范围,下四位数范围)。P<0.05表示差异有统计学意义。
2 结果
治疗前梗死病灶部位(患侧1)的NAA值明显低于治疗前健侧部位(健侧)的NAA值,二者比较差异具有统计学意义(P<0.01);治疗前患侧 NAA 和 NIHSS 的相关性:r=0.122 1,P>0.05),提示NIHSS与NAA无相关性;虽然治疗后 NIHSS与治疗前比较明显下降(P<0.001),但治疗后梗死病灶部位(患侧2)的NAA值与治疗前梗死病灶部位(患侧1)的NAA值比较,差异无统计学意义(P>0.05)。
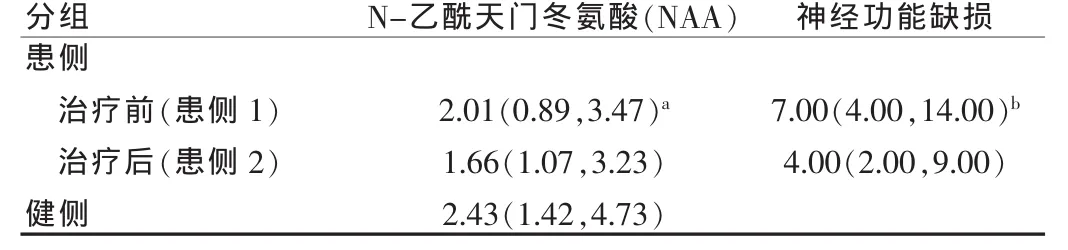
表1 患侧治疗前后及与健侧的比较分析
3 讨论
因为MRS能无损伤地测定活体组织代谢物的相对或绝对浓度以及动力学特性,给出人体正常和疾病状态下的各种生理、生化过程的信息。细胞能量代谢的变化发生在组织学改变之前,因此,MRS出现异常改变一般要比常规MRI检测出病灶更早。Vander Sprenkel首先将MRS用于检查脑梗死病灶代谢改变上,检测乳酸(lactate)、N-乙酰天门冬氨酸、胆碱(choline,Ch)和肌酸(creatine,Cr)等化合物的改变[2-3]。
NAA是一种功能还不十分清楚的氨基酸,而且是只在神经元中特有的化合物[4]。发生急性脑梗死后神经元受损释放出的氨基酸水解酶将NAA分解为天门冬氨酸和乙酸盐[5],NAA浓度下降说明有神经元的死亡,当受损神经元逐步恢复时NAA会再次升高[6-7],NAA可作为功能完善的神经元的标志物。NAA浓度可提供一种有效的测量残余神经元在脑梗死病灶中的活动,从而可提示缺血损伤的严重程度及恢复的可能性。
许多脑梗死的临床研究及实验研究均提示NAA随着病程的进展进行性下降,而且下降的时间及程度存在个体差异,与梗死范围、时间及个体状况有关,所以只要存在神经细胞的死亡,就有NAA的下降,主要与缺血灶的大小及持续时间有关。Duijn等[8]研究发现,梗死灶中的NAA、胆碱和肌酸分别降至对侧半球的23%、46%和37%,本研究中治疗前梗死病灶部位(患侧1)的NAA值明显低于治疗前健侧部位(健侧)的NAA值,表示在急性脑梗死时,病灶侧脑实质中神经元发生完全性缺血、缺氧,导致细胞内代谢功能异常,但此时NAA的值和NIHSS并无相关性,故也提示NAA存在个体差异,可能与年龄、慢性疾病、家族等多种原因导致的神经元损伤相关。经过治疗后虽然神经功能缺损情况NIHSS有明显下降,差异具有统计学意义,但治疗后梗死病灶部位(患侧2)的NAA值与治疗前梗死病灶部位(患侧1)的NAA值比较,差异无统计学意义,提示NAA含量随神经元脱失和不可逆性损伤导致了NAA永久性的降低。但仍有一部分患者治疗后的NAA值较治疗前有明显升高,可能与缺血半暗带(ischemicpenumbra,IP)的存在有关,尚需结合磁共振脑血流灌注及弥散加权成像进行进一步研究。缺血性半暗带是Astrup等首先提出,它的存在受侧支循环、细胞水肿、血压和缺血组织耐受性的影响,具有可逆和可变性[9]。
综上所述,常规MRI能准确提供脑梗死的位置和范围,且对早期脑缺血改变极为敏感[10]。然而,MRI主要提供病变部位、大小和位置的信息,不能提供缺血时脑组织的生物化学改变和影像上出现异常信号区域的严重程度的信息。通过MRI定位再经MRS检测,将功能检查和影像学检测相结合,对NAA等代谢产物浓度的测定能客观和定量反映梗死区神经元的生物化学物质的改变信息,使缺血性损伤严重程度的测量成为可能。近来已有多种临床研究显示,有希望利用MRS早期诊断脑梗死并对卒中病变大小、严重程度和预后作出判断[11-12]。希望利用MRS功能,通过更大规模的临床试验,对超急性期、急性期、恢复期以及根据脑梗死部位及面积的调查,为脑梗死的早期临床诊断及判断预后提出新的思路。
[1]韩鸿宾,谢敬霞,王建利,等.核磁共震新技术研究与临床应用[M].北京:北京医科大学出版社,2001:115-162.
[2]钟士江,谢鹏,方维东,等.超急性脑梗死的磁共振波谱分析[J].重庆医科大学学报,2004,29(4):474-476.
[3]Patsons MW,Li T,Barber PA,et al.Combined1H-MR spectroscopy and diffusion weighted MRI improves the preddiction of stroke outcome[J].Neurology,2000,55(4):498-505.
[4]Bhakoo KK,Williams IT,Williams SR,et al.Proton nuclear magnetic resonance spectroscopy of primary cells derived from nervous tissue[J].J Neurochem,1996,66(3):1254-1263.
[5]Mathews VP,Barker PB,Blackband SJ,et al.Cerebral metabolites in patients with acute and subacute strokes;concentrations determined by quatitative proton MR spectroscopy Mathews[J].AJNR,1995,165:633-638.
[6]Pereira AC,Doyle VL,Howe FA,et al.Reversibi1ity of NAA in cerebral ischaemia:a1H-MRS demonstration of the ischaemic penumbra in man[J].Porc Int Soc Magn Reson Med,1998:217.Abstract.
[7]Arnold DL.Reversible reduction of N-acetyl aspartate after acute central nervous system dam age[J].Proc Int Soc Magn Reson Med,1992:613.Abstract.
[8]Duijin JH,Maston GB,Maudsley AA,et al.Human brain infarction:Proton MR Spectroscopy[J].Radiology,1992,183:711-718.
[9]Demougeot C,Walker P,Beley A,et al.Spectroscpic data following strokerevealtissueabnormalitybeyond the region of T2-weighted hyperintensity[J].JournaloftheneurologicalSciences,2002,199(1-2):73-78.
[10]何雅娜,张权,张云亭,等.脑梗死后运动性失语患者语言中枢的fMRI评价[J].磁共振成像,2010,1(1):6-10.
[11]Howe FA,Maxweil RJ,Saunders DE,et al.Proton spectroscopy in vivo[J].Magn Reson Q,1993,9(1):31-39.
[12]孙学进.磁共振波谱成像技术在脑卒中的应用[J].中华实用医学,2004,6(13):60-62.
