铁氰化钴修饰碳糊电极过氧化氢传感器的研究
2011-01-29刘岳树程爱民金根娣
刘岳树,程爱民,金根娣
(扬州职业大学,江苏扬州225009)
碳糊电极具有残余电流小、制作简单、表面易更新、电位使用范围宽和价格便宜等优点[1],因而广泛应用于无机离子和有机物的测定,还应用于电化学反应机理研究、化学物相分析等。在碳糊中加入一定量的修饰剂制得的化学修饰碳糊电极,不仅测定的灵敏度和选择性进一步提高;而且还可用于富集待测组分。因此,化学修饰碳糊电极是把分离、富集和选择性测定合而为一的理想体系[2]。
许多氧化还原酶催化反应的产物是H2O2,通过测定H2O2的浓度可以间接测定酶催化的底物的浓度[3-5],H2O2的测定方法主要有容量分析法、光谱法、电化学方法[6-10]等。普鲁士蓝及其金属衍生物用于电极的修饰可用于H2O2的测定[11-13]。本文制备了普鲁士蓝以及钴、镍、铜和铋形成的类普鲁士蓝沉淀,并将它们用于修饰碳糊电极,研究了修饰碳糊电极对H2O2的电催化性能。结果发现,铁氰化钴修饰碳糊电极对H2O2的电化学催化性能最好,用于H2O2的测定取得较好的结果。
1 实验部分
1.1 仪器
CHI660a电化学工作站(上海辰华仪器公司),电子天平(北京赛多利斯天平有限公司),电磁搅拌器(常州国华电器有限公司),离心机(上海浦东物理光学仪器厂)。
1.2 试剂
石墨粉:光谱纯(SP,国药集团化学试剂有限公司);以下所用到试剂均为分析纯(AR):液体石蜡(徐州试剂厂),过氧化氢(w=30%)(上海桃浦化工厂),六氰合铁(III)酸钾(温州市化学用料厂),三氯化铁(国药集团化学试剂有限公司),氯化钾(中国医药上海化学试剂公司),氯化钴(国药集团化学试剂有限公司),氯化镍(上海虹光化工厂),硝酸铋(上海东仪化学试剂公司),硫酸铜(国药集团化学试剂有限公司)。实验中所使用的过氧化氢含量,均经过KMnO4标准溶液的滴定测量。水为二次水。
1.3 修饰剂的制备
1.3.1 普鲁士蓝的制备
配制0.05mol·L-1K3[Fe(CN)6]100mL,用2mol·L-1盐酸调节溶液pH=2.0。逐滴加入0.1mol·L-1FeCl350mL(约0.5h),搅拌3h,静置过夜。倾去上层清液,加入蒸馏水,反复几次至上层液澄清透明,留取下层沉淀物于表面皿上蒸干,得到墨绿色晶体,置于烘箱(90℃)干燥4h[14]。
1.3.2 类普鲁士蓝的制备
配制0.05mol·L-1K3[Fe(CN)6]100mL,用2mol·L-1盐酸调节溶液pH=2.0。逐滴加入0.1mol·L-1不同的盐50mL(约0.5h),搅拌3h,静置过夜。倾去上层清液,加入蒸馏水,反复几次至上层液澄清透明,留取下层沉淀物于表面皿上蒸干,得到紫红色晶体,置于烘箱内(90℃)干燥4h。不同的盐可分别制备各种类普鲁士蓝,我们用了CoCl2、NiCl2、CuSO4、Bi(NO3)3制备了四种类普鲁士蓝。
1.4 修饰电极的制备
1.4.1 普鲁士蓝修饰电极的制备
准确称取普鲁士蓝沉淀物1.00g和石墨粉3.00g,在研钵中研磨使其混合均匀。然后称取1.50g液体石蜡,倒入研钵中,继续研磨使其混合均匀。将所得修饰碳糊涂于石墨电极表面,做到涂抹部分厚度均匀,底部水平无凹陷或突出。
1.4.2 碳糊电极的制备
准确称取石墨粉4.00g在研钵中,然后称取1.50g液体石蜡,倒入研钵中,研磨使其混合均匀。将所得碳糊涂于石墨电极表面,做到涂抹部分厚度均匀,底部水平无凹陷或突出。
1.4.3 类普鲁士蓝修饰电极的制备
与普鲁士蓝修饰电极的制备相似,将普鲁士蓝分别换成各种类普鲁士蓝。
1.5 实验方法
普鲁士蓝修饰碳糊电极、各种类普鲁士蓝修饰碳糊电极或碳糊电极为工作电极,铂电极为对电极,饱和甘汞电极(SCE)为参比电极。在电解池加入HAc-NaAc缓冲溶液5.0mL,再加入H2O2溶液,用循环伏安法进行试验,电位扫描范围为1.0~-0.45V,扫描速度为100 mV·s-1;记录伏安曲线;每次使用后,将修饰碳糊电极表面的修饰碳糊除去,用蒸馏水冲洗干净,涂上新的修饰物即可再次使用。
2 结果与讨论
2.1 铁氰化钴修饰碳糊电极对H2O2电化学催化
普鲁士蓝修饰碳糊电极、各种类普鲁士蓝修饰碳糊电极做工作电极,在HAc-NaAc缓冲溶液中加入5.34×10-5mol·L-1的H2O2,进行循环伏安法扫描,扫描电位范围1.0~-0.45V,扫描速度为100mV·s-1;记录伏安曲线(见图1)。
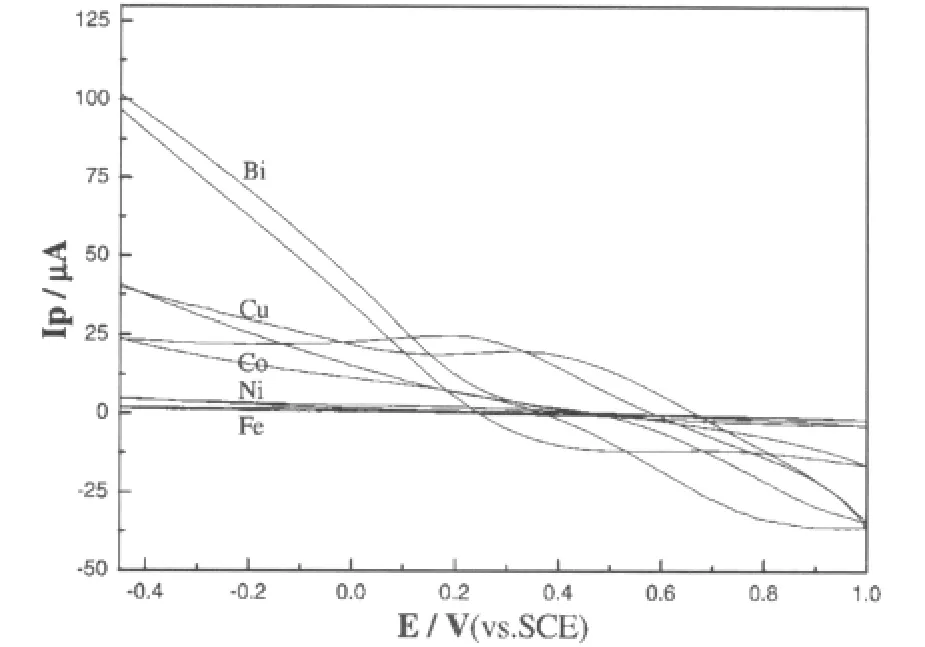
图1 H2O2在修饰碳糊电极上的循环伏安曲线
从图1可以看出:在HAc-NaAc缓冲溶液中,普鲁士蓝修饰碳糊电极对H2O2的氧化还原不起催化作用。在各种类普鲁士蓝修饰碳糊电极中,只有铁氰化钴修饰碳糊电极上出现明显的H2O2还原峰。
比较了铁氰化钴修饰电极在空白的HAc-NaAc缓冲溶液及在含H2O2的HAc-NaAc缓冲溶液中的循环伏安曲线(图2),发现加入H2O2后,在0.2V左右的还原峰电流明显增大,说明该电极对H2O2的还原有催化作用。

图2 铁氰化钴修饰碳糊电极伏安曲线
2.2 底液的选择
以铁氰化钴修饰碳糊电极为工作电极,分别在KCl、KNO3、NaAc、KH2PO4、NaAc-HAc(浓度均为0.1mol·L-1)缓冲溶液中进行实验。在NaAc-HAc缓冲溶液中,峰形较好且稳定,选用其作为实验溶液。
2.3 pH值的影响
H2O2浓度为2.34×10-4mol·L-1,改变底液的pH值,进行循环伏安法试验,以0.2V处的峰电流对pH值作图(图3),结果发现在pH为3.5~4.5时峰电流较大,pH<3.5或pH>4.5时峰电流均减少。故选用pH=4.3的HAc-NaAc缓冲溶液为测定底液。

图3 pH值对峰电流的影响
2.4 扫描速度的影响
在H2O2浓度为2.34×10-4mol·L-1的HAc-NaAc缓冲溶液中,铁氰化钴修饰碳糊电极以10~100mV·s-1的扫描速度做循环伏安实验。随着扫速的逐渐增大,还原峰与氧化峰均逐渐增大,还原峰电位负移,氧化峰电位正移。峰电流Ip与扫速平方根呈直线关系(图4),说明H2O2在电极上的反应受扩散控制。
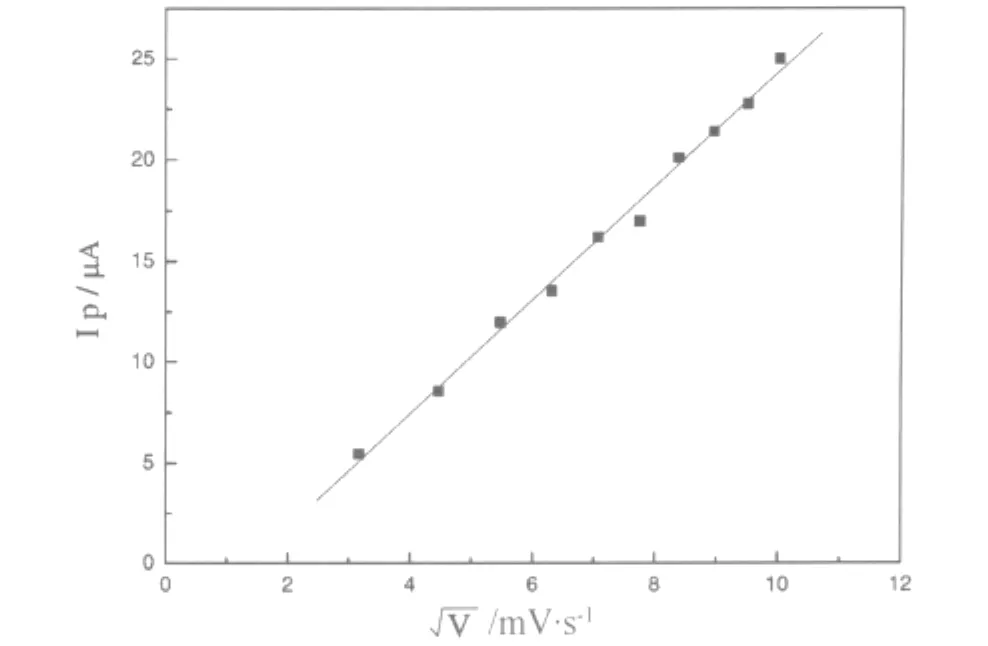
图4 扫描速度对电极响应的影响
2.5 线性关系曲线
在最佳实验条件下,H2O2的浓度在5.34×10-6~5.34×10-4mol·L-1的浓度范围内,H2O2还原峰峰电流Ip(μA)与浓度C(10-5mol·L-1)呈良好的线性关系(见图5),线性方程为

线性相关系数为0.999。
2.6 干扰实验
在H2O2浓度为5.0×10-5mol·L-1的HAc-NaAc缓冲溶液中,研究干扰情况。结果表明,下列物质在该溶液中最少允许量为(给定允许误差±10%):1500倍Ca2+、1500倍Mg2+;1000倍抗坏血酸;800倍谷氨酸、800倍半胱氨酸;500倍葡萄糖。
2.7 电极的重现性与稳定性
将铁氰化钴修饰碳糊电极在H2O2浓度为5.0×10-5mol·L-1的HAc-NaAc缓冲溶液中,连续测定10次,峰电流的平均值为2.36×10-5A,相对标准偏差为3.5%。说明电极的重现性好。另外电极放置一个月后,仍可使用,可见铁氰化钴碳糊电极稳定性良好。
2.8 H2O2回收率测定
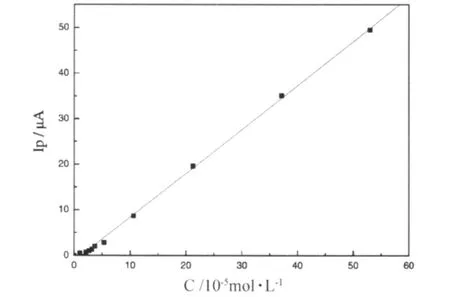
图5 还原峰电流与H2O2浓度的线性关系曲线
准确移取H2O2(w=30%)1.00mL于250mL容量瓶中进行定容,得到w=1.2%的H2O2样品溶液,用KMnO4溶液标定其准确浓度为3.28×10-2mol·L-1。在10.0mLHAc-NaAc缓冲溶液中,加入一定量的w=1.2%的H2O2样品溶液,按实验方法测定H2O2含量,并用标准加入法进行加标回收实验。平均回收率为98.7%,相对标准偏差为3.4%。结果见表1。
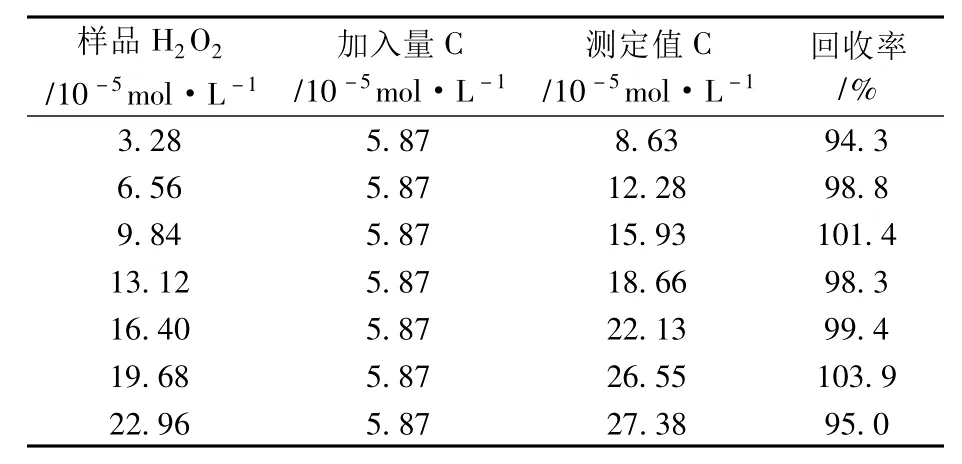
表1 过氧化氢回收率测定
3 结论
本实验研究了铁、钴、镍、铜和铋形成的普鲁士蓝及类普鲁士蓝的制备,并将它们用于修饰碳糊电极,研究了修饰碳糊电极的性能。结果表明,铁氰化钴修饰碳糊电极对H2O2的电化学催化性能最好,用于H2O2的测定取得较好的结果。该电极对H2O2具有一定的催化作用,测定的线性范围为:5.34×10-6~5.34×10-4mol·L-1,该电极具有灵敏度高、稳定性和重现性好等特点。
[1]董绍俊,车广礼,谢远武.化学修饰电极[M].北京:科学出版社,2003.
[2]MIRIAM REHANA KHAN.1-(2-Pyridylazo)-2-naphthol modified carbon paste electrode for trace cobalt(II)determination by differential pulse cathodic voltammetry[J].Analyst,1998,123(6):1351-1357.
[3]KEIKOYAMAMOTO,TAKANORIOHGARU,MASAKI TORIMURA,et al.Highly-sensitive flow injection determination of hydrogen peroxide with a peroxidase-immobilized electrode and its application to clinical chemistry[J].Anal Chim Acta,2000,406(2):201-207.
[4]ARKADY A KARYAKIN,OLGA V GITELMACHER,ELENA E KARYAKINA.Prussian Blue-Based First-Generation Biosensor.A Sensitive Amperometric Electrode for Glucose[J].Anal Chem,1995,67(14):2419-2423.
[5]ARUN KUMAR,RAJESH MALHOTRA,B D MALHOTRA,et al.Co-immobilization of cholesterol oxidase and horseradish peroxidase in a sol-gel film[J].Anal Chim Acta,2000,414(1-2):43-50.
[6]JIANCHUN YUAN,ALAN M SHILLER.Determination of Subnanomolar Levels of Hydrogen Peroxide in Seawater by Reagent-Injection Chemiluminescence Detection[J].Anal Chem,1999,71(10):1975-1980.
[7]LINGSU ZHANG,GEORGE T F WONG.Optimal conditions and sample storage for the determination of H2O2in marine waters by the scopoletin-horseradish peroxidase fluorometric method[J].Talanta,1999,48(5):1031-1038.
[8]YUANZONG LI,ALAN TOWNSHEND.Evaluation of the adsorptive immobilisation of horseradish peroxidase on PTFE tubing in flow systems for hydrogen peroxide determination using fluorescence detection[J].Anal Chim Acta,1998,359(1-2):149-156.
[9]H KORRI YOUSSOUFI,N DESBENOIT,R RICOUX,et al.Elaboration of a new hydrogen peroxide biosensor using microperoxidase 8(MP8)immobilized on a polypyrrole coated electrode[J].Mater Sci Eng C,2008,28(5-6):855-860.
[10]CHENGHONG LEI,ZHANENZHANG,HAIYIN GAIYING LIU,et al.Biosensoring of hydrogen peroxide using new methylene blue N incorporated in a montmorillonite-modified horseradish peroxidase immobilization matrix as an electron shuttle[J].Anal Chim Acta,1996,332(1):73-81.
[11]袁艳茹,袁若,柴雅琴,等.基于普鲁士蓝和明胶修饰的过氧化氢生物传感器[J].西南大学学报:自然科学版,2007,29(5):49-55.
[12]李彤,姚子华,王振川.基于普鲁士蓝修饰电极的H2O2传感器[J].河北大学学报:自然科学版,2007,27(5):499-504.
[13]陈昌国,董海峰,卢惠婷.普鲁士蓝修饰碳糊电极测定过氧化氢的研究[J].分析科学学报,2009,25(2):232-234.
[14]杨志宇,李建平.普鲁士蓝掺杂固体石蜡碳糊电极及过氧化氢和水合肼的测定[J].桂林工学院学报,2004,24(2):219-222.
