AIL-N2O5-HNO3体系中硝解DADN 制备HMX
2011-01-28何志勇吕春绪李金山
何志勇,罗 军,汪 平,吕春绪,徐 容,李金山
(1.南京理工大学化工学院,江苏 南京210094;2.中国工程物理研究院化工材料研究所,四川 绵阳621900)
引 言
HMX是目前综合性能优良的高能炸药,但由于生产成本高,其应用受到限制[1]。世界各国对其制备开展了研究,其中DADN 法制备HMX 的特点是收率高、纯度好,美国认为此法生产HMX的成本比贝克曼法低[2]。Siele等[3]对N2O5硝化DADN 进行了研究,HMX 的收率达到82%。但是由于N2O5的热稳定性低以及N2O5不易制备等原因,前人在研究DADN 硝解反应时,重点用聚磷酸/HNO3体系作硝化剂[4],收率达到86%以上,但聚磷酸和硝酸需要大大过量,对设备的腐蚀性大。以DADN 为原料,采用不同硝化试剂制备HMX各有其优缺点[5],但总体而言,N2O5-HNO3体系具有收率高,废酸少,硝化剂过量少等优点。葛忠学和钱华等人利用N2O5-HNO3硝解DADN制备HMX,得率分别为96%和94.3%[2,6]。
离子液体作为环境友好的催化剂已引起广大研究者的普遍关注[7]。而绿色硝化剂N2O5相对于传统的硝硫混酸,具有反应快速,温度易控制,产物分离容易、纯度高,能有效减少废酸等特点,尤其适用于含能材料的制备[8]。文献[6,9-10]报道了两者的联合使用具有许多优点。
本研究联合使用绿色催化剂离子液体和绿色硝化剂N2O5催化硝解DADN 制备HMX,取得了满意的结果,为HMX 的制备提供新的途径。
1 实 验
1.1 材料和仪器
离子液体[Hmim]X、[(CH2)4SO3HPy]X、[(CH2)4SO3HMim ]X、[Et3NH ]X、[Et3N(CH2)4SO3H]X、[Caprolactam]X、PEG1000-DAIL(X)2(X=NO-3、HSO-4、pTSO-)分别按照参考文献制备[11-17]。
WRS-1B数字熔点测定仪,上海精密科学仪器有限公司;MB154S型红外光谱仪,加拿大Boman公司,KBr压片;300MHz核磁共振仪,德国Bruker-Daltonik公司,内标为四甲基硅烷;DL25电位滴定仪,瑞士Mettler-Toledo公司;纯度测定用高效液相色谱仪,Waters Alliance HPLC 系统,C18 柱,流动相甲醇和水(体积比70∶30),检测波长230nm,流速1mL/min。其他试剂均为市售分析纯。
1.2 试验方法
将质量分数98%的HNO3(22.2g,355.3mmol)倒入四口烧瓶中,强烈搅拌,用冷冻低温循环槽降温,保持体系温度低于0℃,再加入N2O5(5.60g,51.80mmol)和离子液体0.77g[(CH2)4SO3HPy]NO3(2.76mmol),然后将DADN(5.00g,17.3mmol)分批加入反应瓶中,加料时间10min,然后将反应混合物在40℃反应2h。反应结束后加入1g水,搅拌10min,减压蒸馏回收硝酸和乙酸,将瓶中的剩余物加入二氯甲烷浸泡,然后过滤,滤液旋蒸除掉二氯甲烷得离子液体,滤饼用水洗涤,丙酮转晶,干燥后得到β-HMX,纯度99%。IR、1H NMR 和m.p.数据与文献[2]相同。
2 结果与讨论
2.1 离子液体用量对HMX 收率的影响
在反应温度50℃,反应时间3h,物料配比n(HNO3):n(N2O5):n(DADN)=20∶3∶1,离子液体[(CH2)4SO3HPy]NO3摩尔分数为底物的1.0%~8.0%条件下,考察了离子液体用量对HMX收率的影响,结果见表1。
从表1可以看出,随着离子液体用量的增加,DADN 硝解产物HMX 的产率先增加后减少,当离子液体的摩尔分数为底物的4.0%时,HMX 的产率最高为91.6%。由于随着离子液体用量的增加,离子液体可能参与硝化反应,消耗了部分N2O5,硝化剂的硝化能力变弱,因此,离子液体最佳摩尔用量为反应底物的4.0%。
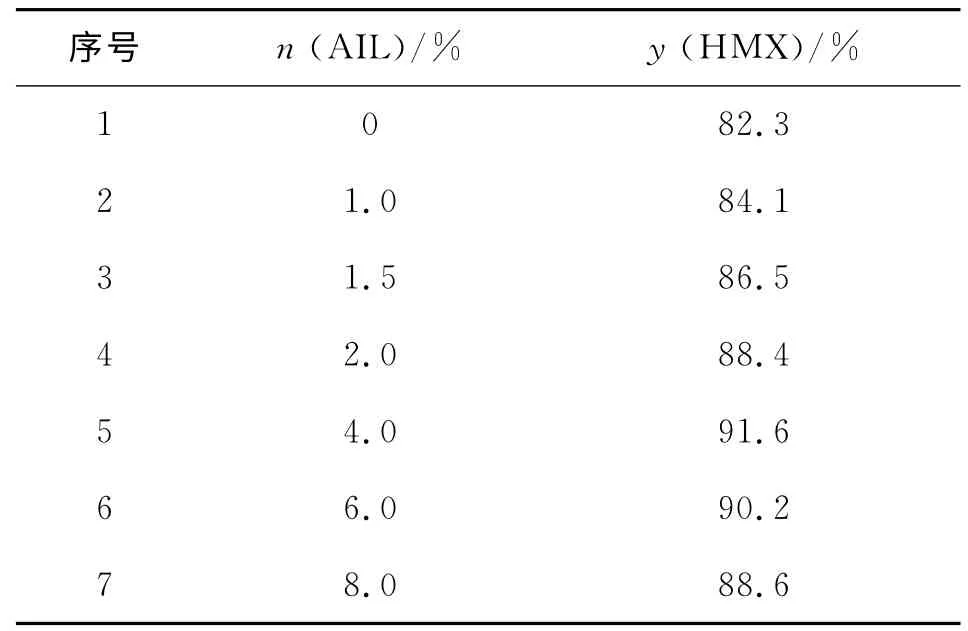
表1 离子液体用量对HMX 收率的影响Table 1 Effect of the dosage of AIL on the yield of HMX
2.2 反应温度对HMX 收率的影响
在反应时间3h,n(HNO3):n(N2O5):n(DADN)=20∶3∶1,离子液体[(CH2)4SO3HPy]NO3的摩尔分数为底物4.0%的条件下,考察了反应温度对HMX 收率的影响,结果见表2。
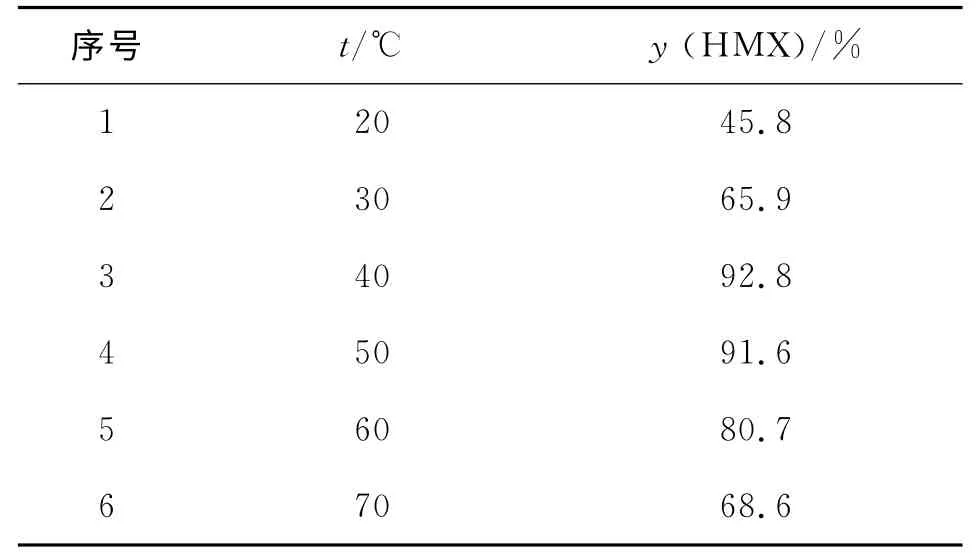
表2 反应温度对HMX 收率的影响Table 2 Effect of reaction temperature on the yield of HMX
由表2可知,温度较低时硝化剂的活性不高,20℃时收率只有45.8%,40℃时收率达到92.8%。纯N2O5在50℃时的半衰期为19min,溶解在有机溶剂和硝酸中其半衰期会延长[3],但是当温度超过40℃后,反应溶液呈红棕色,红色硝烟增多,N2O5分解加快,硝化剂减少,同时氮氧化物增多,氧化加强,反应过于激烈,氮杂环易破裂,导致HMX 收率下降,当温度升高到70℃时,收率仅为68.6%。因此,最佳反应温度为40℃。
2.3 反应时间对HMX 收率的影响
在反应温度40℃,n(HNO3)∶n(N2O5)∶n(DADN)=20∶3∶1,离子液体[(CH2)4SO3HPy]NO3的摩尔分数为底物的4.0%条件下,考察了反应时间对HMX 收率的影响,结果见表3。

表3 反应时间对HMX 收率的影响Table 3 Effect of reaction time on the yield of HMX
从表3可知,随着反应时间的增长,HMX 收率升高,2h时收率达到最大值93.6%,之后收率略微降低,是由于在酸性条件下时间过长,HMX 会有少量分解,因此,最佳反应时间为2h。
2.4 物料配比对HMX 收率的影响
反应时间为2h,温度40℃,离子液体[(CH2)4SO3HPy]NO3的摩尔分数为底物的4.0%条件下,考察了HNO3、N2O5和DADN 的物料配比对HMX 收率的影响,结果见表4。
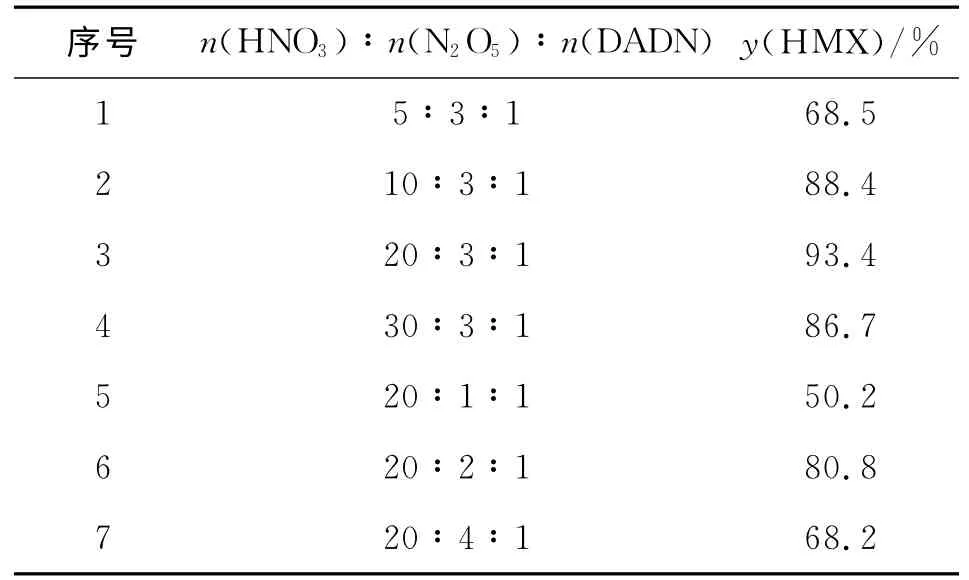
表4 物料配比对HMX 收率的影响Table 4 Effect of molar ratio of materials on the yield of HMX
从表4可以看出,当N2O5用量一定,硝酸用量较少时,N2O5的含量较高(质量分数达到50.5%),大部分N2O5无法溶解在体系中参与反应,因而HMX 收率较低;随着硝酸用量的增加,N2O5逐渐溶解在反应体系中,HMX 的收率又逐渐增加,当N2O5质量分数达到20%左右(即n(HNO3)∶n(N2O5)∶n(DADN)=20∶3∶1)时,HMX 收率达到93.4%。而当硝酸用量一定,N2O5含量太低时,类似于纯硝酸参与反应,硝酰阳离子较少,不易进行反应,HMX 收率较低。随着N2O5用量的增加,提供了大量的NO+2促进DADN 硝化生成HMX,因此HMX 的收率逐渐增加;当N2O5用量继续增加时,又有部分的N2O5不溶于体系,且高浓度N2O5可能促使DADN 开环反应增多生成链状副产物,降低了HMX 的收率。因此,合适的物料配比为n(HNO3):n(N2O5):n(DADN)=20∶3∶1。
2.5 不同离子液体对HMX 收率的影响
在反应温度40℃,反应时间2h,n(HNO3)∶n(N2O5)∶n(DADN)=20∶3∶1,离子液体的摩尔分数为底物的4.0%条件下,考察了21种离子液体对HMX 收率的影响,结果见表5。

表5 不同离子液体对HMX 收率的影响Table 5 Effect of the different AIL on the yield of HMX
从表5看出,离子液体对DADN 的硝解反应有一定的催化作用。在上述离子液体中,不同的阴离子对DADN 硝解反应的影响未呈现出一定的规律性,说明离子液体的阴离子对DADN 硝解反应的影响不大。总体来看,离子液体的阳离子类型对硝解反应的影响较明显,这可能与阳离子的酸性强弱以及空间位阻有一定关系,其中[Et3NH]pTSO表现出了最好的催化效果,可使HMX收率达到95.6%。
由上可知,通过实验得到最佳反应条件为:反应温度40℃,反应时间2h,物料配比n(HNO3)∶n(N2O5)∶n(DADN)=20∶3∶1,离子液体选[Et3NH]pTSO,离子液体摩尔分数为4.0%,HMX的平均收率为95.6%。不加AIL 时HMX 的收率为82.3%。这说明加入AIL对DADN 硝解反应有显著的催化作用。原因可能是离子液体的使用使N2O5分解出更多的硝酰阳离子(NO+2),提高了NO+2的单位浓度,促进乙酰基的脱除,硝解向生成HMX 的方向进行。有关AIL 加入后促进DADN硝解生成HMX 的机理还有待进一步研究。
2.6 废酸和离子液体的回收使用
硝解反应结束后反应中的废酸和离子液体可以通过蒸馏和浸泡来回收使用,从而降低生产成本。离子液体回收使用5 次,HMX 收率最大为95.6%,最小为95.2%,没有明显的降低。
反应剩余的N2O5和反应中生成的硝酸乙酸酐通过加入水生成硝酸和醋酸。而纯硝酸的沸点为83℃,醋酸的沸点为118℃,可以通过减压分馏分别得到硝酸和醋酸。因此,反应结束后温度降至20℃再加入1.00g水,用减压(12.5kPa)蒸馏获得硝酸(水浴35℃),硝酸的回收率为95%,通过电位滴定法检测质量分数为98.2%,继续减压蒸馏(水浴55℃),收集52℃的馏份,回收得到醋酸理论质量的78%。蒸馏结束后降温加入二氯甲烷20mL 浸泡,过滤,滤液旋蒸除去溶剂后可回收95%的离子液体,直接投入下批反应。
3 结 论
(1)离子液体对DADN 的硝解反应有显著的催化作用。反应温度40℃,反应时间2h,物料配比n(HNO3)∶n(N2O5)∶n(DADN)=20∶3∶1,离子液体[Et3NH]pTSO 摩尔分数为底物的4.0%条件下,HMX 收率达到95.6%,纯度99%。
(2)反应后可以通过减压蒸馏回收95%的硝酸,同时获得理论质量78%的醋酸。
(3)离子液体可以通过浸泡后除去溶剂回收,直接使用5次,其催化活性没有明显的降低。
[1]任特生.硝胺及硝酸酯炸药化学与工艺学[M].北京:兵器工业出版社,1994:203-223.
[2]钱华.五氧化二氮在硝化反应中的应用研究[D].南京:南京理工大学,2008.
QIAN Hua.Research on nitration by dinitrogen pentoxide[D].Nanjing:Nanjing University of Science and Technology,2008.
[3]Siele V I,Warman M,Leccacorvi J,et al.Alternative procedures for preparing HMX[J].Propellants,Ex-plosives,Pyrotechnic,1981,6(3):67-73.
[4]Succasunna W L,Saddlebrook S N,Fairlawn J A.et al.Process of producing HMX in 100%yields and purity:US,5124493[P].1992-06-23.
[5]吕春绪.绿色硝化研究进展[J].火炸药学报,2011,34(1):1-8.
LüChun-xu.Study progress and on green nitration[J].Chinese Journal of Explosives and Propellants,2011,34(1):1-8.
[6]葛忠学,李高明,洪峰,等.绿色硝化技术合成HMX的小试工艺研究[J].火炸药学报,2002,25(1):45-47.
GE Zhong-xue,LI Gao-ming,HONG Feng,et al.Study on the lab synthesis of HMX using dinitrogen pentoxide as the nitrating agent[J].Chinese Journal of Explosives and Propellants,2002,25(1):45-47.
[7]HE Zhi-yong,LUO Jun,LüChun-xu,et al.Synthesis of HMX via nitrolysis of DPT catalyzed by acidic ionic liquids[J].Central European Journal of Energetic Materials,2011,8(2):83-91.
[8]何志勇,罗军,吕春绪.N2O5硝解DPT 制备HMX[J].火炸药学报,2010,33(2):1-4.
HE Zhi-yong,LUO Jun,LüChun-xu,et al.Synthesis of HMX from DPT by green nitrolysis with dinitrogen pentoxide[J].Chinese Journal of Explosives and Propellants,2010,33(2):1-4.
[9]CHENG Guang-bin,LI Xia,QI Xiu-fang,et al.Synthesis of RDX by nitrolysis of hexamethylenetetramine in the presence of Brønsted acidic ionic liquids.Theory and practice of energetic materials(VOL.Ⅷ)[M].Beijing:Science Press,2009,8:48-51.
[10]ZHI Hui-zheng,LUO Jun,FENG Guang-an,et al.An efficient method to synthesize HMX by niitrolysis of DPT with N2O5and a novel ionic liquid[J].Chin Chem Lett,2009,20:379-382.
[11]齐秀芳.Brønsted酸性离子液体存在下的硝化(解)反应研究[D].南京:南京理工大学,2008.
QI Xiu-fang.Study on nitration (nitrolysis)in the presence of Brønsted acidic ionic liquids[D].Nanjing:Nanjing University of Science and Technology,2008.
[12]齐秀芳,程广斌,段雪蕾,等.Brønsted酸性功能离子液体存在下甲苯的硝化反应[J].火炸药学报,2007,30(5):12-14.
QI Xiu-fang,CHENG Guang-bin,DUAN Xue-lei,et al.Study on nitration of toluene in the presence of Brønsted acidic functional ionic liquids[J].Chinese Journal of Explosives and Propellants,2007,30(5):12-14.
[13]Cole A C,Jensen J L,Ntai I L,et al.Novel Brønsted acidic ionic liquids and their use as dual solvent catalysts[J].J Am Chem Soc,2002,124:5962-5963.
[14]Ganeshpure P A,George G,Jagannath D H.Brønsted acidic ionic liquids derived from alkylamines as catalysts and mediums for Fischer esterification:Study of structure-activity relationship[J].J Mol Catal A:Chemical,2008,279(2):182-186.
[15]LIU S,XIE C,YU S,et al.Esterification ofα-pinene and acetic acid using acidic ionic liquids as catalysts[J].Catal Com,2008,9(7):1634-1638.
[16]齐秀芳,程广斌,吕春绪.甲苯在离子液体一硝酸/乙酸体系中的区域选择性硝化反应[J].应用化学,2008,25(2):147-151.
QI Xiu-fang,CHENG Guang-bin,LüChun-xu,et al.Regioselective nitration of toluene with HNO3/Ac2O catalyzed by caprolactam-based Brønsted acidic ionic liquids[J].Chin J Appl Chem,2008,25(2):147-151.
[17]职慧珍,罗军,马伟,等.新型PEG 双子温控离子液体中的缩醛反应[J].高等学校化学学报,2008,29(10):2007-2010.
ZHI Hui-zhen,LUO Jun,MA Wei,et al.Acetalization of aromaldehyde and ethyleneglycol in novel PEG thermoregulated ionic liquids[J].Chemical Journal of Chinese Universities,2008,29(10):2007-2010.
