盐酸千金藤碱逆转MCF-7/ADR细胞多药耐药性的作用及其机制
2011-01-26王庆端
夏 薇,王 宁,王庆端
(河南省医药科学研究院药化室,郑州 450052)
盐酸千金藤碱逆转MCF-7/ADR细胞多药耐药性的作用及其机制
夏 薇,王 宁,王庆端△
(河南省医药科学研究院药化室,郑州 450052)
目的研究盐酸千金藤碱(CH)对人乳腺上皮细胞癌耐药细胞株MCF-7/阿霉素(ADR)多药耐药性的体外逆转作用,并探讨其逆转机制。方法 用四甲基偶氮唑盐(M TT)法检测CH对多药耐药肿瘤细胞MCF-7/ADR的耐药逆转活性;免疫组织化学法检测细胞内谷胱甘肽硫转移酶π(GST-π)的表达;通过对超螺旋PBR322 DNA的解旋能力检测拓扑异构酶Ⅱ(TopoⅡ)的活性。结果CH在无细胞毒浓度下具有逆转MCF-7/ADR细胞耐药性的作用,逆转倍数为13.5倍,但对敏感株MCF-7细胞的抗癌药物敏感性基本无影响。CH 4μ mol/L使MCF-7/ADR细胞中过度表达的GST-π的表达水平下降及DNA TopoⅡ的催化活性提高,但对敏感株MCF-7细胞无影响。结论CH具有逆转多药耐药性的作用,其机制可能与降低GST-π的表达及提高DNA TopoⅡ的活性有关。
乳腺肿瘤;抗药性,多药;谷胱甘肽转移酶;DNA拓扑异构酶;盐酸千金藤碱
肿瘤多药耐药性(multidrug resistance,M DR)是肿瘤化疗失败的主要原因,谷胱甘肽硫转移酶π(glutathione S-transferase pi,GST-π)通过对异生物质的生物转化和解毒功能参与肿瘤细胞耐药性的形成[1];而DNA拓扑异构酶Ⅱ(topoisomeraseⅡ,TopoⅡ)活性数量或性质上的改变引起药物诱导产生的可裂解复合物的形成减少,从而导致MDR的产生[2]。盐酸千金藤碱(cepharanthine hydrochloride,CH)是从防己科千金藤属植物的块根中提取分离出的一种双苄基异喹啉类生物碱单体化合物,具有较强的多种生物活性[3],其分子式为C37H38N2O6•HCl,相对分子质量为679.628,现国家食品药品监督管理局(SFDA)已批准进入Ⅱ期临床研究(临床批号:2005L00390)。有研究表明千金藤碱具有逆转肿瘤MDR的作用[4]。但其机制是否与GST-π及DNA TopoⅡ有关的研究尚无报道。本研究旨在探讨CH对人乳腺上皮细胞癌M DR细胞M CF-7/阿霉素(adriamycin,ADR)耐药性的逆转作用及其逆转机制。
1 材料与方法
1.1 细胞株与细胞培养 人乳腺上皮细胞腺癌MCF-7细胞株及耐ADR细胞株MCF-7/ADR均引自中国科学院上海药物研究所。两细胞株培养于含体积分数10%胎牛血清,1×105U/L青霉素和100 mg/L链霉素的RPMI-1640完全培养基中,置于37℃、饱和湿度及5%CO2的细胞培养箱内。细胞经消化传代,取对数生长期细胞进行培养,MCF-7/ADR细胞传代时在完全培养基中加入2 μ mol/L ADR以维持其MDR表型,实验前无药培养2周。
1.2 材料与仪器 CH为河南省医药科学研究院、中科院昆明植物研究所和广州暨南大学共同研究并提供,经检测达质谱纯。ADR为意大利Farmitalia公司产品,RPMI-1640培养基为美国Gibco产品,四甲基偶氮唑盐(M TT)为瑞士Fluka公司产品,兔抗人GST-π多克隆抗体、SP免疫组化染色试剂盒、DAB试剂盒购自北京中杉金桥生物技术有限公司,pBR322DNA为华美生物工程公司产品。DNA expert自动酶联免疫检测仪为奥地利Tecan公司产品,HPIAS-1000彩色病理图文分析系统为同济医科大学千屏影像工程公司提供,Gene Genius凝胶图像分析系统为英国Syugene公司产品。
1.3 M TT法测定药物的细胞毒作用[5]取对数生长期MCF-7、M CF-7/ADR细胞,制成细胞浓度8×107个/L的细胞悬液,接种于96孔细胞培养板,每孔100μL,培养24 h待细胞贴壁后,更换培养液,加入不同浓度的ADR、CH或维拉帕米(Verapamil,VER),每孔终体积为200 μ L,每组4个平行孔,细胞与药物作用72 h后每孔加入M TT溶液(5 g/L)20μ L,继续培养4 h,弃去孔内培养液,加入二甲亚砜(DMSO)150 μ L/孔,用微量振荡器振荡10 min,完全溶解后用酶联免疫检测仪在570 nm波长处测定吸光度值(A值)。计算抑制率、半数抑制浓度(IC50)、耐药倍数(耐药株 IC50/敏感株 IC50)、逆转倍数(耐药株IC50/加逆转剂后耐药株IC50)等。
1.4 细胞内GST-π表达的测定[6]运用免疫组化第二代LAB-SA检测技术测定GST-π的表达,并加以改进。处理盖玻片制备细胞爬片,取对数生长期细胞 MCF-7、MCF-7/ADR,以细胞数5×108个/L植入放有盖玻片的 24孔培养板,每孔 1 mL,培养24 h后,更换为含有不同浓度药物的培养液,继续培养12 h,取出盖玻片,用 PBS(0.01 M、pH7.4)液洗涤2次,4℃丙酮固定10 min,PBS洗涤3次后,按试剂盒说明书操作,一抗为1∶100兔抗人GST-π多克隆抗体,PBS代替一抗作为阴性对照。采用HPIAS-1000型彩色病理图文分析系统进行图像分析,于400倍显微镜下各测定7个视域细胞中GST-π的含量,以细胞积分光密度值对结果进行评价。
1.5 DNA TopoⅡ活性的测定 细胞培养及药物处理分组同前,经不同浓度药物作用24 h后,收集 MCF-7、MCF-7/ADR细胞各5×107个,按照文献[7]的方法,加以改进提取拓扑异构酶。采用考马斯亮蓝法定量测定酶提取液的蛋白含量。按照文献[8]的方法,以pBR322DNA为底物观察耐药株及敏感株细胞DNA TopoⅡ对pBR322DNA的解旋能力及药物对其影响。将琼脂糖凝胶电泳结果用Gene Genius凝胶图相分析系统照相并对超螺旋DNA条带进行半定量分析,以加酶组与空白对照组的吸光度比值作为DNA TopoⅡ活性量化指标。
1.6 统计学处理 采用SPSS10.0统计软件分析,实验数据以±s表示,各参数多个样本均数比较用单因素方差分析,两样本均数比较用t检验,进行统计学处理。
2 结 果
2.1 多药耐药细胞株MCF-7/ADR的耐药性测定 ADR对
MCF-7/ADR及MCF-7细胞的IC50值分别为(27.37±0.83)、(0.50±0.03)μ mol/L。耐药倍数为54.7倍。
2.2 CH体外逆转耐药性的作用 CH在体外对MCF-7及MCF-7/ADR细胞毒作用较弱,8 μ mol/L CH的抑制率分别为(9.86±2.03)%、(10.27±1.25)%,4 μ mol/L CH 时分别为(4.75±0.58)%、(5.10 ±0.82)%,2 μ mol/L CH 时分别为(2.15±0.47)%、(2.34±0.71)%,在逆转耐药性所用的浓度下,基本不影响细胞存活率。CH可部分增加MCF-7/ADR对ADR的敏感性,对敏感株 MCF-7细胞无影响。4 μ mol/L CH对M CF-7/ADR细胞耐药性的逆转倍数为 13.5倍,而 8 μ mol/L VER的逆转倍数为7.3倍,CH对MCF-7/ADR的逆转活性强于 VER(P0.05),见表1。
2.3 CH对MCF-7/ADR细胞质GST-π表达的影响 MCF-7及M CF-7/ADR细胞中 GST-π均有表达,但 MCF-7/ADR细胞中GST-π呈高表达,而 MCF-7细胞中GST-π呈较低表达,两者相比差异有统计学意义(P0.05)。单用0.17 μ mol/L ADR处理MCF-7细胞及单用 9.12 μ mol/L ADR处理MCF-7/ADR细胞均不影响 GST-π 表达,与 4 μ mol/L CH 合用后可降低 MCF-7/ADR细胞中GST-π的表达水平(P0.05),但未下降至敏感细胞水平,而对MCF-7细胞无影响。与8 μ mol/L VER合用后也降低 MCF-7/ADR细胞中 GST-π的表达水平,但作用弱于CH,对敏感细胞无影响,见表2。
表1 CH对MCF-7及MCF-7/ADR敏感性的影响(±s,n=12)
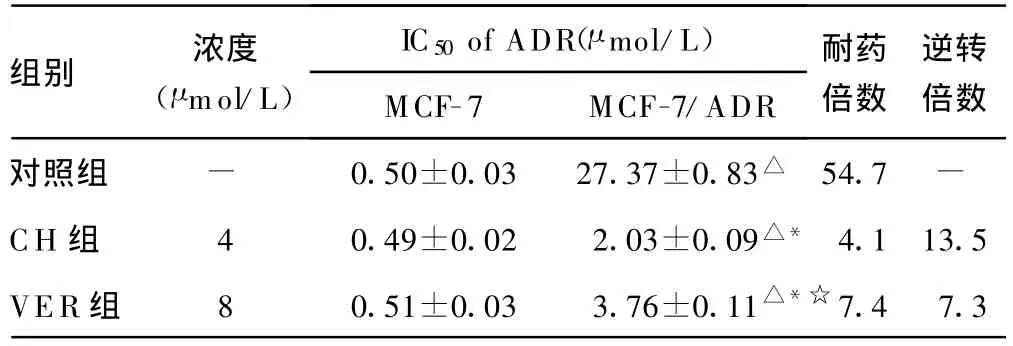
表1 CH对MCF-7及MCF-7/ADR敏感性的影响(±s,n=12)
△:P0.05,与同组 MCF-7比较;*:P0.05,与对照组MCF-7/ADR比较;☆:P0.05,与CH 组MCF-7/ADR比较;-:表示无数据。
组别 浓度(μ mol/L)IC50of ADR(μ mol/L)MCF-7 MCF-7/ADR耐药倍数逆转倍数对照组 - 0.50±0.03 27.37±0.83△ 54.7 -CH 组 4 0.49±0.02 2.03±0.09△* 4.113.5 VER组 8 0.51±0.03 3.76±0.11△*☆7.4 7.3
表2 CH对 MCF-7及MCF-7/ADR细胞中GST-π表达的影响(±s,n=7)
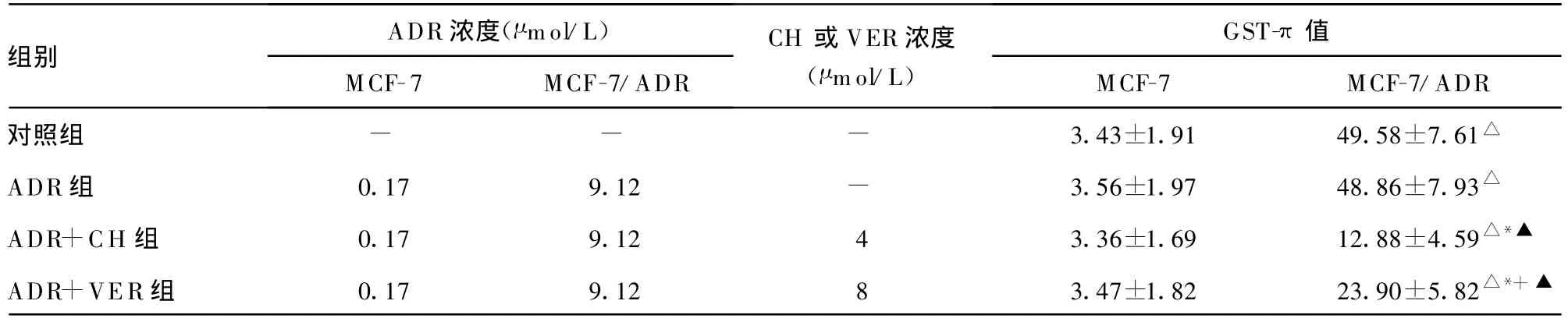
表2 CH对 MCF-7及MCF-7/ADR细胞中GST-π表达的影响(±s,n=7)
△:P0.05,与同组MCF-7比较;*:P0.05,与对照组MCF-7/ADR比较;+:P0.05,与ADR+CH 组MCF-7/ADR组比较;▲:P0.05,与ADR组MCF-7/ADR比较;-:表示无数据。
组别ADR 浓度(μ mol/L)MCF-7 MCF-7/ADR CH或VER浓度(μ mol/L)GST-π值MCF-7 MCF-7/ADR对照组 - - - 3.43±1.91 49.58±7.61△ADR组 0.17 9.12 - 3.56±1.97 48.86±7.93△ADR+CH 组 0.17 9.12 4 3.36±1.69 12.88±4.59△*▲ADR+VER组 0.17 9.12 8 3.47±1.82 23.90±5.82△*+▲
表3 CH对MCF-7及MCF-7/ADR细胞DNA TopoⅡ催化活性的影响(±s,n=10)

表3 CH对MCF-7及MCF-7/ADR细胞DNA TopoⅡ催化活性的影响(±s,n=10)
*:P0.05,与对照组MCF-7/ADR比较;△:P0.05,与ADR组MCF-7/ADR组比较;-:表示无数据。
组别 ADR浓度(μ mol/L)MCF-7 MCF-7/ADR CH或V ER浓度(μ mol/L)OD值MCF-7 MCF-7/ADR对照组 - - - 0.71±0.05 0.81±0.10 ADR组 0.17 9.12 - 0.68±0.08 0.81±0.12 ADR+CEP组 0.17 9.12 4 0.67±0.08 0.29±0.04*△ADR+VER组 0.17 9.12 8 0.67±0.06 0.77±0.12
2.4 CH对MCF-7/ADR细胞核内DNA TopoⅡ催化活性的影响 DNA TopoⅡ催化活性测定结果表明,单用0.17 μ mol/L ADR处理 MCF-7细胞及单用9.12 μ mol/L ADR处理MCF-7/ADR细胞,与加酶无药对照组相比差异均无统计学意义(P>0.05)。与4 μ mol/L CH 合用可促进MCF-7/ADR细胞DNA TopoⅡ介导的 DNA解旋作用,而对MCF-7细胞无影响。与8 μ mol/L VER合用对MCF-7及MCF-7/ADR细胞DNA TopoⅡ活性均无影响,见表3、图1。根据1个酶活性单位所需蛋白含量,MCF-7/ADR细胞为 MCF-7细胞的2.4倍,蛋白含量分别为(2.93±0.25)μ g和(1.22±0.16)μ g。

图 1 MCF-7及MCF-7/ADR细胞DNA TopoⅡ催化活性
3 讨 论
肿瘤M DR的发生存在多机制、多途径、多环节,在抗肿瘤药物杀伤肿瘤细胞的通道上发生任何改变均可导致抗药性的产生,涉及抗癌药物的转运、代谢和抗癌药物作用靶点,细胞识别毒性损伤,细胞损伤修复机制以及细胞凋亡等[9]。近年来研究显示以胞浆中谷胱甘肽硫转移酶(GSTs)介导的MDR和以细胞核内酶TopoⅡ介导的非经典耐药途径(AT-MDR),在MDR的发生过程中发挥重要作用[10-11]。
本实验所用的MCF-7/ADR细胞由对人乳腺癌细胞MCF-7经递增浓度的ADR反复诱导筛选获得的具典型MDR表型的细胞株。通过对两细胞株活性的测定,MCF-7/ADR细胞相对于亲代敏感细胞MCF-7耐药倍数为54.7倍。体外逆转活性表明CH对MCF-7/ADR的耐药性有明显的逆转作用。在非细胞毒剂量下的CH、VER可增加MCF-7/ADR细胞对 ADR的敏感性,4 μ mol/L CH的逆转倍数为 13.5,8 μ mol/L VER的逆转倍数为7.3,CH的逆转作用强于VER。
GSTs是一组具有多种生理功能的同工酶蛋白,对异生物质的生物转化和解毒具有重要作用,主要存在于细胞质中。GST-π基因表达受多水平调控,在多种耐药性肿瘤细胞株中过量表达,与肿瘤细胞的耐药性密切相关[12]。GST-π可催化GSH的巯基与亲电性抗肿瘤药物结合,消除原来的活性亲电部位,增加药物在水中的溶解度,降低其化学反应,水溶性谷胱甘肽-S-化合物经巯基尿酸生物合成途径代谢,加速抗肿瘤药物的降解,使药物在靶部位的积蓄量迅速减少而达不到致死浓度,导致肿瘤MDR的产生[13]。
DNA TopoⅡ是催化DNA拓扑结构改变的酶,为核基质成分之一,是肿瘤化疗的重要靶酶,与多种抗癌药物的细胞毒效应有关[14]。细胞对抗肿瘤药物的敏感性依赖于靶酶的水平,通过对分离出的抗药细胞核仁和核基质的研究证实,药物敏感性的降低在于药物诱导产生的可裂解复合物的形成减少;药物引起的DNA断裂减少和抗药细胞毒性的降低为抗药细胞内TopoⅡ活性降低所致。TopoⅡ介导的at-MDR的生化基础在于TopoⅡ活性数量或性质上的改变[15]。(2):167-177.
本实验结果显示,MCF-7/ADR细胞GST-π高表达,为MCF-7细胞的14.5倍,进一步证实GST-π高表达可导致MDR产生;而MCF-7/ADR细胞1个酶活性单位所需的蛋白含量为MCF-7细胞的2.4倍,DNA TopoⅡ的活性明显降低,说明肿瘤细胞耐药性在一定程度上与TopoⅡ的含量和活性的下降有关,与国外研究结果一致[16]。CH、VER均可降低MCF-7/ADR细胞GST-π的表达,CH可提高DNA TopoⅡ的活性,而对敏感株MCF-7无明显影响,表明CH逆转M DR的机制可能与降低GST-π的表达及增加DNA TopoⅡ的活性有关。有研究表明,在乳腺癌中 GST-π与 MDR相关蛋白(MRP)、mdr1存在共表达,而共表达是耐药相关标志受共同因子调控的证据[17],因此,VER能有效逆转P-gp介导的耐药,部分逆转 MRP介导的耐药,可能是其在一定程度上降低GST-π表达的机制,但与 TopoⅡ介导的 at-MDR途径无关。
GST-π的表达及TopoⅡ介导的at-MDR途径,受多水平调控,作用通路具有复杂性,CH通过何种机制影响GST-π的表达及TopoⅡ的活性,有待进一步研究。CH是从防己科千金藤属植物提取出来的生物碱单体化合物,日本已用于治疗临床放、化疗所致的白细胞减少20余年,大剂量用药而未发现明显毒副作用,对该药进一步研究并作为肿瘤化疗的耐药逆转剂应用于临床提供了重要依据。
[1] Teodori E,Dei S,Scapecchi S,et al.The medicinal chemistry of multidrug resistance(M DR)reversing drugs[J].Farmaco,2002,57(5):385-415.
[2] Liem AA,Chamberlain M P,Wolf CR,et al.The role of signal transduction in cancer treatment and drug resistance[J].Eur J Surg Oncol,2002,28(6):679-684.
[3] 王金华,叶祖光,孙爱续,等.粉防己碱逆转耐阿霉素的人乳腺癌MCF-7细胞的抗凋亡作用[J].中国组织化学与细胞化学杂志,2000,9(4):436-440.
[4] 宋玉成,夏薇,江金花,等.盐酸千金藤素逆转 EAC/ADR细胞多药耐药性的作用及其机制[J].药学学报,2005,40(3):204-207.
[5] 郭伟剑,李杰,沈兆忠,等.外源性 TNF-a基因联合异博定、三苯氧胺逆转多药耐药性[J].复旦学报:医学版,2001,28(2):141-144.
[6] 辛华.细胞生物学实验[M].北京:科学出版社,2001:81-86.
[7] Markovits J,Larsen AK,Segal-Bendirdjian E,et al.Inhibition of DNA topoisomerases I andⅡand induction of apoptosis by erbstatin and tyrphostin derviatives[J].Biochem Pharmacol,1994,48:549-560.
[8] Marx G,Zhou H,David E,et al.Covalent attachment of ethidium to DNA Results in enhanced topoisomeraseⅡ-mediated DNA cleavage[J].Biochemistry,1997,36:15884-15891.
[9] 李伟,胡凯文.肿瘤多药耐药研究现状[J].中国中医药信息杂志,2000,7(7):68.
[10]Bernardini S,Bellincampi L,Ballerini S,et al.Role of GST P1-1 in mediating the effect of etoposide on human neuroblastoma cell line Sh-Sy5y[J].J Cell Biochem,2002,86(2):340-347.
[11]Goekkurt E,Hoehn S,Wolschke C,et al.Polymorphisms of glutathione S-transferases(GST)and thymidylate synthase(TS)-novel predictors for response and survival in gastric cancer patients[J].Br J Cancer,2006,94:281-286.
[12]王秀丽,孔力,赵瑾瑶,等.三氧化二砷逆转人乳腺癌MCF-7/ADM细胞耐药的机制研究[J].中华肿瘤杂志,2002,24(4):339-343.
[13]Ichihara T,Wanibuchi H,Taniyama T,et al.Inhibition of liver glut athione S-transferase placental form positive foci development in the rat hepatocarcino-genesis by Porphyra tenera(Asakusa-nori)[J].Cancer Lett,1999,141:211-218.
[14] Tanner B,Pilch H,Schaffer U,et al.Expression of C-erbB-2 and topoisomeraseⅡ alpha in rdlation to chemoresistance in ovarian cancer[J].Zentralbl Gynakol,2002,124(3):176-183.
[15]Korkolopoulou P,Angelopoulou M,Siakantari M,et al.Evalution of DNA topoisomeraseⅡa expression provides independent prognostic information in non-Hodgkin′s lymphomas[J].Histopathology,2001,38:45-53.
[16]Scheltema JMW,Romijn JC,Van Steenbragge GJ,et al.Inhibition of apoptotic proteins causes multidrug resistance in renal carcinoma cells[J].Anticancer Res,2001,21(5):3161-3166.
[17]Kreisholt J,Sorensen M,Jensen PB,et al.Immunohistochemical detection of DNA topoisomeraseⅡalpha P-glycoprotein and multidrugresistance protein(M RP)in small-cell and non-small-cell lung cancer[J].Br J Cancer,1998,77:1469-1473.
Reversal of multidrug resistance in MCF-7/ADR cells by cepharanthine hydrochloride and its mechanism
ObjectiveTo investigate the reversal effect of cepharanthine hydrochloride(CH)on multidrug resistance(MDR)of drug-resistant cell line of human breast epithelial carcimoma(MCF-7/ADR),and to explore its mechanism.MethodsM TT assay was used to detect cytotoxicity and MDR reversal activity of CH in MCF-7/ADR cell line.Immunohistochemistry(IHC)technique was used to show the intracellular expression of glutathione S-transferases pi(GST-π).The catalytic activity of DNA Topoisomerase(TopoⅡ)was assessed by the ATP-dependent relaxation of supercoild pBR322 DNA.ResultsCH could enhance sensitivity of MCF-7/ADR cells to anti-tumor drugs.A 13.5 fold reversed effect of resistance was achieved in vitro.However,CH had few effects on drug-sensitive MCF-7 cells.After treatment of CH under the concentration of 4μ mol/L,the level of higher expression of GST-π was decreased and the activity of DNA TopoⅡwas increased in MCF-7/ADR cell line,but no changes was found in MCF-7 cells.ConclusionCH is able to effectively reverse drug resistance and its mechanism is probably related to reducing the expression of GST-πand enhancing the activity of DNA TopoⅡ in MDR tumor cells.
breast neoplasms;drug resistance,multiple;glutathione transferase;DNA topoisomerase;cepharanthine hydrochloride
10.3969/j.issn.1671-8348.2011.01.006
A
1671-8348(2011)01-0014-03
△通讯作,电话:(0371)66658216;E-mail:wangningxiao3@126.com。
2010-03-10
2010-06-23)
•论 著•
