废旧金刚石工具综合回收利用研究①
2011-01-25马飞
马飞
(有研粉末新材料(北京)有限公司,北京 101407)
1 引言
金刚石工具以人造金刚石为切割材料,碳化钨为工具胎体材料,金属铜粉、钴粉和镍粉等为粘合剂,各种原料混合后,用热压成型的加工工艺进行生产[1]。金刚石工具具有极高的硬度和耐磨性、低摩擦系数、高弹性模量、高热导低热膨胀系数,以及与非铁金属亲和力小等优点,可用于非金属硬脆材料如石墨、高耐磨材料、复合材料、高硅铝合金及其它韧性有色金属材料的精密加工[2]。2010年,我国人造金刚石产量达到了100亿克拉。在今后几年里,全球金刚石工具的市场需求将以每年超过20%的速度快速增长,其中,金刚石及类金刚石涂层产品的复合年增长率可达到14.3%[3]。
在通常情况下,废旧金刚石工具中残留有大量未被消耗的金刚石颗粒以及结合剂,如果将这些废旧金刚石工具弃之不用,将会造成巨大的浪费[4]。随着我国有色金属产量的持续快速增长,矿产原料短缺的矛盾日趋突出,所以,我们应大力发展有色金属资源的再生研究及回收工作。在此背景下,如何回收处理废弃金刚石工具的问题就摆在了我们面前,现阶段金刚石工具回收的一般工艺是采用酸溶[5,6],即利用金刚石、碳化钨不溶于酸,其他金属可溶的特性,而达到分离的目的,例如氯酸钾盐酸分解法[7]、硝酸分解法[8]等,都是利用此种原理进行分离的。但是这些方法过程都相对冗长,回收效率低下[9]。电解法以废金刚石工具为阳极,以酸性氯化钠体系为电解液,有价金属经过电解后进入溶液,金刚石和碳化钨颗粒沉入电解液底部。该法工艺简单,流程短,但是工艺耗费时间长,并且由于废金刚石工具的表面积较小,使得电解难度增大,且电解液的浓度不稳定,需不时加入电解质,这明显增加了工作量,目前此种方法只停留于实验阶段。
2 工艺流程和实验方法
废旧金刚石工具的回收是一个复杂而繁琐的过程,针对不同的原料性质、不同的回收对象而定,往往只回收其中的金刚石和碳化钨颗粒,但各种金属常常不能彻底分离,达不到综合回收的目的。基于此点,本文提出利用化学共沉淀的方法对废旧金刚石工具进行综合回收。废旧金刚石工具经过酸溶,其成分复杂的酸浸出液为配合金刚石工具金属含量进行调整,可以直接作为共沉淀制备超细粉体的原材料,制备出高档金刚石用超细预合金胎体粉末,进而重新用于金刚石工具的生产。实验采用的工艺流程图如下(图1所示)。

图1 实验拟采用的工艺流程Fig.1 Purposed process flow in the test
2.1 废旧金刚石的酸分解
对金刚石工具进行酸分解研究,试验所用金刚石工具中各金属质量分数分别为Cu35%、Fe20%、Ni15%、Co15% 、Sn15%。根据理论分析,金刚石工具中的有价金属在添加氧化剂的情况下,可以进行浸出,但考虑到金刚石中的金属经过热压烧结后,金属接触变得更加致密,也更加惰性,分解金刚石工具相对于分解简单的金属元素要困难得多,因此试验拟采用盐酸和硝酸的混合酸来对金刚石工具进行分解。
在温度为96℃,体积比盐酸∶硝酸=3∶2,对废旧金刚石工具进行浸出,浸出时间为2小时,各种金属的浸出率如下(见表1)。

表1 金属浸出率(%)Table 1 Leaching rate of metal(%)
由上表可知,采用硝酸和盐酸的混合酸作为浸出剂,在上述条件下,金刚石工具中的各种有价金属的浸出率达到了99% 左右,实现了对金刚石工具的完全分解,滤渣经过过滤、洗涤后,回收金刚石和碳化钨颗粒。
2.2 酸浸出液的共沉淀
金刚石工具中的有价金属经过酸浸出后,转变为金属离子,以草酸作为沉淀剂,用氨水调节草酸的pH值,来进行共沉淀研究[10],反应过程中发生的主要反应可用以下通式表示。

金刚石工具经过酸浸出后,浸出液中的成分和金刚石工具厂家中的工具配方会有差异,按照厂家要求,加入可溶性盐溶液配成和金刚石工具生产厂家一样的金刚石工具中的金属配比,进行共沉淀研究。
经过计算绘制了在草酸浓度为1mol/L,总氨浓度为1mol/L 时lg[Me]T—pH 图[11~12](见图2)。由于Sn离子过于容易水解,因此在计算时不予考虑。由图2可知,在草酸和氨水量一定的条件下,控制合适的溶液pH值,能实现各种金属的共沉淀。
在浸出液金属离子总浓度为1mol/L,温度70℃,草酸浓度为1mol/L,用氨水调节草酸溶液的pH值为10.5,滴加速度为60mL/min,草酸用量为理论量的1.1倍。各种金属的沉淀率见表2。

图2 pH对lg[Me]T的影响Fig.2 Influence of pH on lg[Me]T

表2 草酸过量系数为1.1条件下各金属的沉淀率(%)Table 2 Sediment ratio(%)of the metals in case that excessive coefficient of oxalic acid is 1.1
制得的部分草酸盐形貌如下(图3)。

图3 草酸盐形貌Fig.3 Morphology of oxalate
由表2可知,在上述实验条件下进行共沉淀,除铜的沉淀率为93.7% 以外,各种金属的沉淀率均在99% 以上,金属的综合浸出率为98.4%,基本上达到了沉淀完全的目的。从图3可知,在一定条件下制得的草酸盐前躯体,呈现形状比较一致、粒度较细且分布均匀呈椭圆形,这有利于后续对草酸盐前躯体进行氢还原。
2.3 草酸盐前躯体的氢还原
将前面通过共沉淀条件得到的草酸复盐粉末试样,置于电炉中,在氢气气氛下,控制一定的反应温度,将发生草酸盐的热分解及还原反应,生成预合金粉末。反应过程中发生的反应通式如下。

经过计算绘制了不同温度下五种金属的氧化物氢气还原平衡图[14,15],见图4。
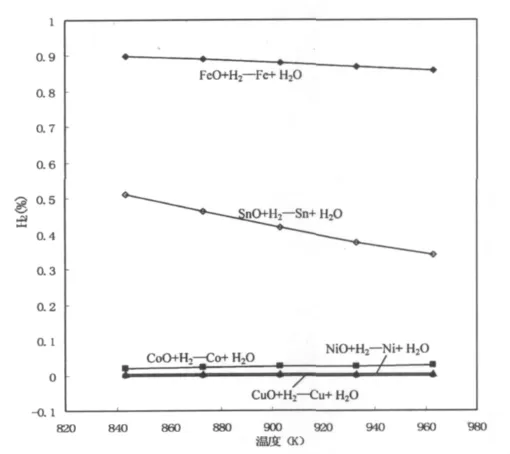
图4 MeO的H2还原平衡图Fig.4 Equilibrium diagram of deoxidization H2in MeO
由图4可知,FeO和SnO随着温度的升高,其还原反应向氢气减少的方向进行;而CoO、CuO、NiO则随温度升高所需的氢气含量升高。在同一温度下,CuO最易被氢气还原,而FeO则最难被氢气还原。
在还原温度为630℃,还原时间为4h的条件下得到的粉末形貌如图5所示,经过xrd衍射分析如图6所示。

图5 预合金粉的形貌Fig.5 Morphology of pre-alloy powder

图6 还原得到的预合金粉末的XRD图Fig.6 XRD diagram of deoxidized pre-alloy powder
由图5和图6可知,草酸盐前躯体经过还原后制得预合金粉末,经过检测,粒度<10μm,氧含量<0.5%,此种预合金粉末粒度均匀、形状一致,并且粉末粒度越细,其烧结温度越低,这对于金刚石工具企业降低能耗、延长石墨磨具寿命、降低成本,提高金刚石工具质量等级以及石材加工等行业降低能源消耗,增加产量都是非常重要的。
3 结论
(1)废旧金刚石工具中的金属元素在盐酸、硝酸的混合酸中,可以完全分解,金刚石和碳化钨颗粒经过洗涤、过滤后可以继续使用;
(2)酸浸出液经过调整成分后,以草酸作为沉淀剂,用氨水调节草酸的pH值进行共沉淀。在浸出液金属离子浓度为1mol/L,温度70℃,草酸浓度为1mol/L,用氨水调节草酸溶液的pH 值为10.5时,各种金属的综合浸出率为98.4%,基本上达到了沉淀完全的目的;
(3)对草酸盐前躯体进行氢还原工艺研究,得到了成分粒度均匀、形貌一致的超细预合金粉末;
(4)本方法在废弃金刚石工具回收的过程当中,回收其中的金刚石以及碳化钨,用共沉淀的方法把溶液中的各种有色金属离子制备成超细预合金粉末,二次应用于金刚石工具的制备中,除了有利环保外,并可能形成产业,最终创造较大的经济效益,目前此法已经进入到试生产阶段。
[1]郭灵虹,钟辉.废金刚石刀具综合回收工艺研究[J].无机盐工业,1995 (06):26-28.
[2]贾特,李嫚.基于灰色理论的我国人造金刚石产量的预测[J].工具技术,2007,41(5):3-5.
[3]王振明.从市场角度探讨金刚石工具产业的发展方向[J].行业发展综述,2001(4):26-28.
[4]高冰媛,于爱兵,等.金刚石工具的回收与再利用[J].工具技术,2010,44(1):11-16.
[5]何显达,郭学益,李平,黄凯,等.从人造金刚石触媒酸洗废液中回收镍、钴和锰[J].湿法冶金,2005,24(3):150-154.
[6]曲志平.残废金刚石刀头的回收利用[J].中国物资再生,1997(7):20-22.
[7]苏念英,崔嘉麟.废金刚石工具中钴的回收利用[J].广西化工,1997,26(3):56-58.
[8]张从良,彭国胜,王岩.废金刚石工具中铜钴镍的回收工艺研究[J].无机盐工业,2006,38(9):54-55.
[9]郭灵红,陈世途.废弃金刚石工具选择性浸出及回收工艺研究[J].四川有色金属,1996(1):19-22.
[10]Yu-Zan Hsieh,Shun-Tian Lin.Diamondd tool bits with iron alloys as the binding matrices[J].Materials Chemistry and Physics,2001(7):121-125.
[11]梁英教.无机物热力学数据手册[M].沈阳:东北大学出版社,1993.
[12]DEAN J.A..Lange’s Handbook of Chemistry[M].北京:科学出版社,1985.
[13]巴伦.纯物质化学手册[M].北京:科学出版社,2003.
[14]傅崇说.有色冶金原理[M].北京:冶金工业出版社,2005.
