饱和食盐水比热容测量的不确定度
2011-01-25张青兰武银兰
张青兰 武银兰
(太原理工大学物理与光电工程系 山西 太原 030024)
比热容反映了物质的热学性质,是一个重要的物理参量.比热容的测定对于了解物质的结构、确定物质的相变、鉴定物质的纯度以及新能源的开发和新材料的研制等都起着重要作用[1].因此,比热容的测量是物理实验教学的重要内容之一.
测定液体的比热容可通过混合法、散热法、电热法等方法进行.对于饱和食盐水的比热容的测量未见报道.现利用散热法测其比热容并就测量不确定度进行分析.
1 实验原理
1.1 牛顿冷却定律
一个系统的温度如果高于环境温度,就会损失热量;如果低于环境温度,就会吸收热量.实验证明,当系统与外界环境温度差较小(10~15℃以内)时,则单位时间内损失的热量与温度差成正比,这就是牛顿冷却定律[2],即
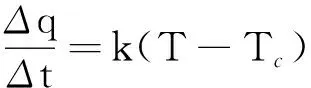
(1)
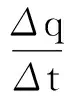
如果在实验中保持环境温度Tc恒定,则
Δq=CsΔ(T-Tc)
(2)
式中Cs是系统的热容.将式(2)代入式(1)并积分得到
(3)
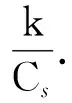
1.2 比较法进行散热修正
量热器是在物质的比热容测量中经常使用的仪器,对它的设计尽管已经采取了许多措施以减小系统与外界的热量交换,但仍然不能做到完全绝热.因此,在精确的测量中,必须对系统的散热进行修正.
利用式(3),分别写出对标准液体(纯水)和待测液体(饱和食盐水)冷却公式
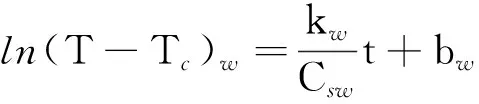
(4)
(5)
式中Csw和Css分别是系统中盛水和饱和食盐水时的热容.如果在实验中用同一个容器分别盛水和饱和食盐水,并保持在这两种情况下系统的初始温度、表面积和环境温度等基本相同,则可以认为系统在分别盛水和饱和食盐水时的散热系数kw和ks相同,即
kw=ks=k
令Sw和Ss分别代表由式(4)和式(5)作出的两条直线的斜率,即
则SwCsw=SsCss
(6)
式中Sw和Ss的数值可由作图法得出.
热容Csw和Css分别为
Csw=mwcw+m1c1+ΔC′
(7)
Css=mscs+m1c1+ΔC″
(8)
其中mw,ms,cw,cs分别是水和盐水的质量及比热容;m1,c1是量热器内筒和搅拌器的质量及比热容;ΔC′和ΔC″是温度计浸入已知液体和待测液体部分的等效热容,这部分等效热容很小,可以忽略不计.所以待测盐水的比热容为
(9)
2 实验部分
2.1 饱和食盐水的配制
室温下将一定量的食盐溶于一定量的热水中,并不断用搅拌器搅拌.当看到还有部分食盐未溶解时,静置两天,任其自然溶解.而后再加一定量食盐,如此反复至少三次,溶液中液态部分即为饱和食盐水.
2.2 冷却环境的实现
将底面积与高度均大于量热器外筒的容器嵌入一较大的泡沫塑料中(需紧密接触),容器上方的泡沫塑料盖子两侧留两个小孔,分别是装温度计(测环境温度)和自来水管的入水口;盖子中央留一个大孔,直径与量热器外筒相当.容器一侧(与入水口异侧)开一出水口.实验过程中保持水流速度恒定.
2.3 实验测量
用感量为50 mg的物理天平分别测量量热器内筒和搅拌器、饱和食盐水及纯水的质量,并将饱和食盐水、纯水分别加热到高于环境温度约10~15℃,用温度计记录系统散热的环境温度(量热器外筒的水温),数据见表1.
把加热到高于环境温度约10~15℃的饱和盐水放入相同的量热器中,再把量热器放入温度恒定的凉水水槽中,用搅拌器不断搅拌并每隔2 min记录一次温度(温度计最小分度为0.1℃).用同样的方法测量纯水.测量结果见表2和表3.

表1 饱和食盐水与纯水散热前各物理量的测量数据

表2 测量盐水所得数据

时间/min121416182022盐水温度Ts/℃34.033.833.533.333.132.9环境温度Tc/℃21.721.721.821.821.821.9

表3 测量纯水所得数据
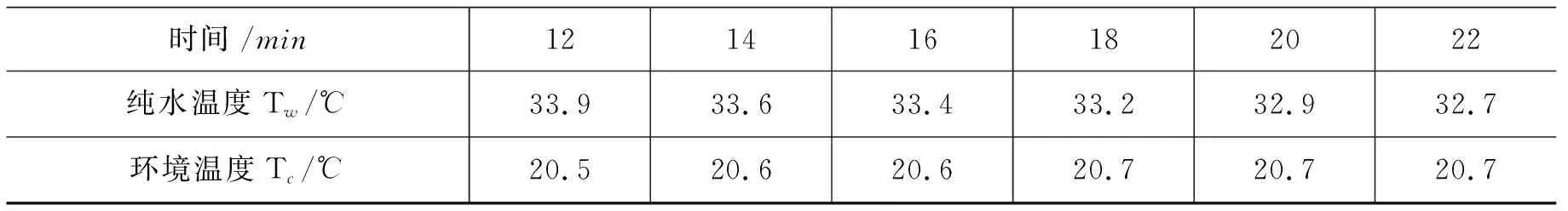
时间/min121416182022纯水温度Tw/℃33.933.633.433.232.932.7环境温度Tc/℃20.520.620.620.720.720.7
根据表2和表3中数据,用Origin作图软件作出ln(T-Tc)-t的关系曲线如图1,由图得直线的斜率分别为Ss=-0.011 11,Sw=-0.010 93.
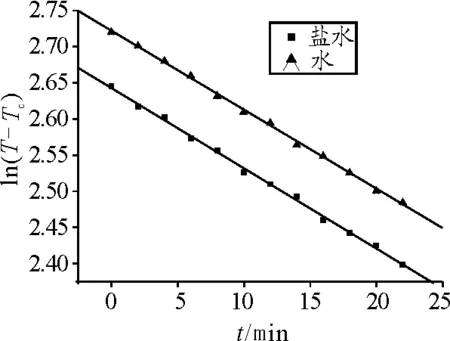
图1 ln(T-Tc)-t关系曲线
将测量的数据及黄铜的比热容c1=0.389 J/(g·K)、纯水的比热容cw=4.182 J/(g·K)代入公式(7)、(9)得饱和食盐水的比热容为
cx=3.243 J/(g·K)
3 实验结果的不确定度分析
3.1 饱和食盐水比热容的不确定度计算
本实验测得20℃的环境温度下,饱和食盐水的比热容值约为3.243 J/(g·K),从文献[2~4]的报道推知这个结果是可信的.不确定度分析如下.
根据式(9),得饱和食盐水比热容的相对不确定度为
(10)
由Origin作图软件拟合直线时给出的斜率标准偏差为ss=1.746 65×10-4,sw=1.246 46×10-4,则p=68%时分别求得
式(10)中各项依次求得为
将上面有关数据代入式(10)得
则
ucx=0.261 J/(g·K)
cx=(3.243±0.261) J/(g·K)
3.2 饱和食盐水比热容的不确定度分析
(1)实验条件
散热法测液体的比热容首要前提是盛水与饱和食盐水的两系统散热系数kw和ks相同,而散热系数与所盛液体的容器、系统表面积、冷却时的初始温度和环境温度等因素有关.在实验中,测量水与饱和食盐水的比热容时,所用的量热器为同一套量热器,而所装液体在量热器中的高度大致相同,导致两比较系统的表面积有所差别,散热系数稍有不同,对结果造成一定影响,这在多次测量中也得到证实.
(2)温度测量
由不确定度计算可知饱和食盐水比热容的不确定度主要取决于所拟合直线的斜率,而斜率的数据来自于散热测量中的温度与时间,从实验数据中截取不同的温度-时间段拟合直线结果不一致,而以相同的初温拟合直线结果接近文献报道值.时间与温度分别由一人专门负责读数,由于两个观察者有不同的个人误差,会导致时间与实时温度不太对应,影响斜率大小及其偏差.另外,被测体系的温度是随时间变化的,因此,温度计与被测体系之间不可能建立一种真正意义上的热力学平衡.实验中所用温度计为最小分度0.1℃的水银温度计,由于水银温度计中水银柱的升降总滞后于被测体系的温度变化,因此,在读数值与真实值之间有一定的热滞后误差,造成温度读数不十分准确.再者,被测系统温度T与环境温度Tc应为同一时刻的值,需同步测量,实验中很难做到这一点,从而影响到T-Tc的值.
(3)环境温度控制
系统所处的环境温度Tc的稳定性,直接影响到ln(T-Tc)与时间t的线性关系.本文中的实验系统所处的环境为可控的流动水,每次实验大约花费20 min,由于室内大环境温度不十分稳定,使得Tc发生0~0.5℃的变化.若Tc增加,系统与环境温差减小,散热减慢,从而影响拟合直线的斜率.
4 结论
通过散热法测量的饱和食盐水比热容为3.243 J/(g·K),不确定度为0.261 J/(g·K).由于得出待测液体的比热容的前提是系统的散热系数相同,因此,具体到实验中,饱和食盐水与水的初始温度、表面积和环境温度等需基本相同.此外温度计的灵敏度及测量中时间与温度的同步程度会对比热容的测量有较大影响.
参考文献
1 喻凌,潘学军.液体比热容的测量.四川师范大学学报(自然科学版),2003.26(3):306~308
2 龚镇雄,刘雪林.普通物理实验指导.北京:北京大学出版社,1990.167~179
3 蒋林华,徐佩珠.冷却法测定盐水比热容的讨论.湖州师专学报,1994(6):53~59
4 何晓明,利用牛顿冷却定律测定盐水的比热容.青海大学学报(自然科学版), 2007.25(4):85~87
5 中国合格评定国家认可委员会.测量不确定度要求的实施指南(CNAS-GL05).北京:中国标准出版社,2006
