伯乐树种子不同条件贮藏下前后生理比较
2011-01-25康华靖陶月良陈子林周钰鸿郑伟成
康华靖,陶月良,陈子林,周钰鸿,郑伟成
(1.温州科技职业学院园林系,浙江温州 325006;2.温州大学生命与环境科学学院,浙江温州 325027;3.浙江大盘山国家级自然保护区管理局,浙江磐安 322300;4.浙江九龙山国家级自然保护区管理局,浙江遂昌 323312)
伯乐树 (Bretschneidera sinensis)又名钟萼木,是伯乐树科的落叶乔木,它是我国特有的单种科植物,是第三纪热带植物区系的孑遗种,对研究被子植物的系统发育及古地理、古气候等具有重大的科学价值。伯乐树花大型,总状花序顶生,粉红色,夏天满树粉红色花十分艳丽;入秋后,红色果实累累,衬托在金黄色的叶片间,耀眼夺目,可作为园林绿化树种。此外,伯乐树树冠大、树干通直,其木材淡褐黄色,边心材不明显,纹理直、结构细,色纹美观,加工容易,不翘不裂,刨面光滑具光泽,适于家具、胶合板、细木工板及其它工艺品等,又是优良的用材树种。由于伯乐树星散分布,个体数量极少,被列为国家一级保护植物[1]。目前国内外对伯乐树的研究较少,主要集中在人工育苗[2-3]、系统分类[4-6]、化学成分[7]及种子休眠特性[8]上。李铁华[8]等研究认为,伯乐树种子具深休眠特性,在低温干藏 120 d后再层积 20 d解除休眠的效果最佳。了解种子贮藏过程中的物质变化和种子劣变过程,对于探讨种子贮藏生理机制、保持种子活力和提高种子贮藏寿命,以及种质保存和生物多样性的保护都有着十分重要的意义。本文以 3个不同地区的伯乐树种子为研究对象,设置不同的贮藏方式探讨其贮藏前后的生理变化,旨在为种质资源的保存以及伯乐树濒危机理的研究提供理论依据。
1 材料与方法
1.1 种子来源
种子来自浙江省丽水市的遂昌县、福建省南平市浦城县和衢州的江山市,编号分别为 1、2和 3。采种时间为 2007年 10月下旬,清水洗去肉质外种皮,置于室内稍做晾干 (以此时的种子作为起始对照CK)。
1.3 发芽率和发芽势的测定
分别于贮藏前后随机选取饱满的种子平铺在装有少许沙子的培养皿 (外径约 15 cm)中,然后添加蒸馏水,以稍有水分流出为宜,置于 26℃[8]培养箱中 (PYX-DHS-50×65-BS,上海跃进医疗器械厂)。每个处理 3个重复,每个重复 100粒种子。每天观察记录种子萌发情况,以胚根长度大于 3 mm视为萌发,以连续 3 d不再萌发视为萌发结束。

其中,Gt指第 t天时的发芽数,Dt指发芽天数。

表1 种子来源的概况
1.4 形态指标的测量
随机选取 25粒发育较为一致的种子,采用游标卡尺 (0.005)测量其最长、最宽和最厚的部位。
1.5 生理指标的测定
随机选取 20粒左右种子,除去种皮,小心将其切碎,称取其质量 (M1),放入干燥皿中,置于烘箱中,先 105℃烘 30 m in,再调至 80℃烘至恒重(M 2)。
通过预实验,初步判断伯乐树种子为淀粉类种子,脂类物质含量极低,因此本文没有对其变化进行研究。可溶性糖和淀粉含量的测量用蒽酮比色法[9];淀粉酶活性测定采用比色法[9];蛋白质含量测定采用考马斯亮兰比色法[10];蛋白酶的测定采用NaOH滴定法[10]。
1.6 数据处理
上述处理均设置 3个重复。各项实验运用SPSS12.0进行显著性检验,运用 Excel 2003作图。
2 结果分析
2.1 形态指标
由表2可知,不同地区的种子之间除厚度差异明显外,长度和宽度均未达到显著差异 (P>0.05),而长 /宽和长 /厚均以浦城县 (3号)地区为最大,而千粒重却最小,与其他 2个地区相比差异均达到显著水平(P<0.05),说明该地区的种子狭长而扁平, 质量较小。

表2 种子的形态
2.2 发芽率和发芽势
由图1可以看出,新采摘的种子无论是发芽率还是发芽势都极低,不同地区之间也并不存在着显著差异 (P>0.05)。经过贮藏后,种子的发芽率和发芽势均显著升高 (P<0.05),说明种子有休眠期,沙藏破除了种子休眠,从而提高了发芽率和发芽势。不同处理之间,干藏的发芽率和发芽势相对较低。
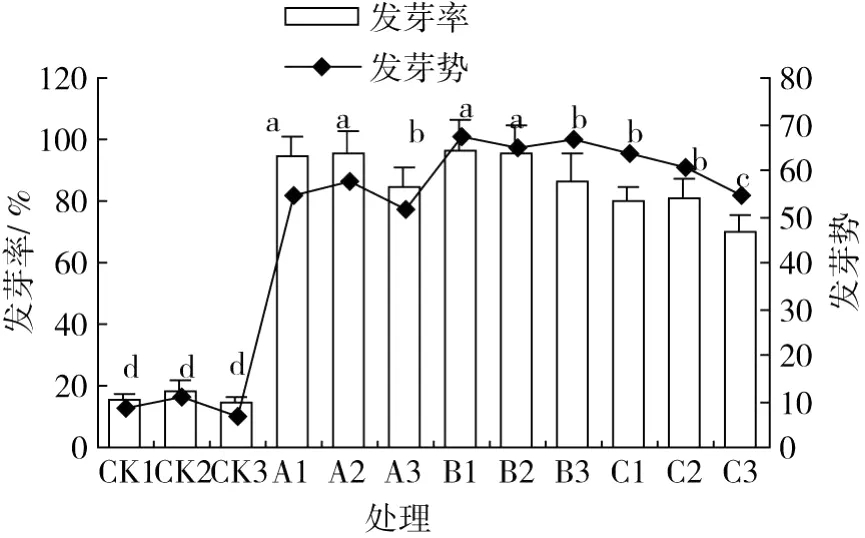
图1 伯乐树种子贮藏前后发芽率和发芽势的比较
2.3 含水量
3个地区的种子贮藏前的初始含水量较为接近,均在 55.0%左右 (P>0.05),经过 130 d的贮藏以后,其含水量达到 65.0%左右,不同处理之间差异不显著 (P>0.05)。沙藏处理 (常温和低温)与贮藏前相比增加了近 10.0%,其差异达到显著水平 (P<0.05);C处理下的种子含水量稍有增加,但与贮藏前相比,其差异并未达到显著水平 (P>0.05)。分析认为,种子贮藏 130 d后,种子外种皮裂开,A和B处理种子表面的湿度较大,便于种子吸收水分,而 C处理下的种子外种皮虽也裂开,但受封口袋贮藏方式的限制,只能吸收少量残留在的种子表面的水分,因此含水量相对略低。
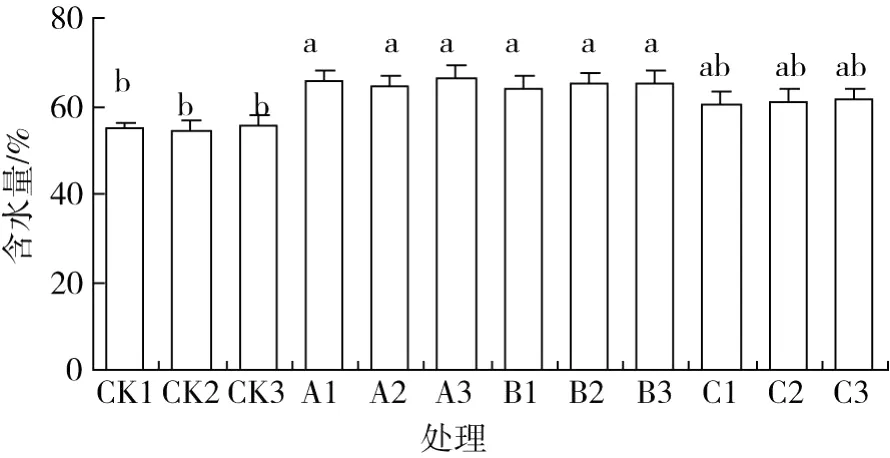
图2 伯乐树种子贮藏前后含水量的变化
2.4 蛋白含量与蛋白酶
新采摘种子的蛋白质含量以江山市为最低,与其他 2个地区相比,其差异达到显著水平 (P<0.05),推测这种差异主要是由于树龄的差异造成的。经过不同处理后,种子蛋白质含量均有明显的增加 (见图3)。同样,蛋白酶活性在贮藏前较低且不同地区之间并无显著差异,贮藏之后,其活性显著提高 (P<0.05),且不同贮藏方式之间存在差异 (见图4)。
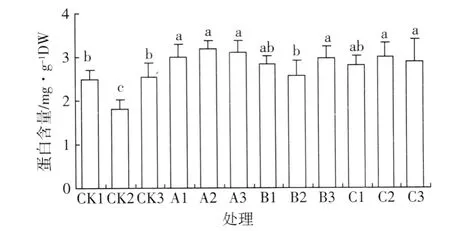
图3 伯乐树种子贮藏前后蛋白质含量的变化
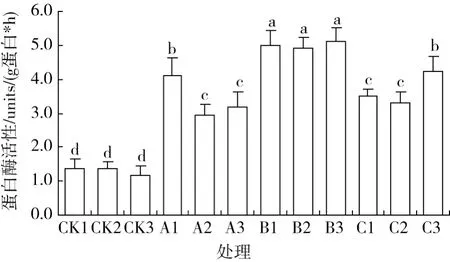
图4 伯乐树种子贮藏前后蛋白酶活性的变化
2.5 可溶性糖、淀粉含量及淀粉酶的变化
由图5可知,新采摘的种子,其淀粉含量占干重的 80%左右,说明伯乐树的种子为淀粉类种子。贮藏 130 d之后种子的淀粉含量下降至 40%左右,这与贮藏后淀粉酶活性的显著升高有关 (P<0.05)(见图6)。不同贮藏方式下的种子淀粉含量较为接近,之间的差异均未达到显著水平 (P>0.05),说明不同的湿度和温度对种子淀粉含量的保持影响不大。淀粉酶的活性在不同处理之间并未明显差异,而贮藏之后与对照之间存在显著差异 (P<0.05),说明伯乐树种子经过贮藏后,淀粉酶活性明显增强。

图5 伯乐树种子贮藏前后淀粉含量的变化
贮藏之后淀粉酶活性的增强,淀粉逐渐被分解,可溶性糖的含量也相应的升高 (如图7所示),与初始可溶性糖含量相比,贮藏之后其含量显著升高 (P<0.05)。由图5还可以看出,不同处理之间差异并不显著 (P>0.05)。

图6 伯乐树种子贮藏前后淀粉酶活性的变化
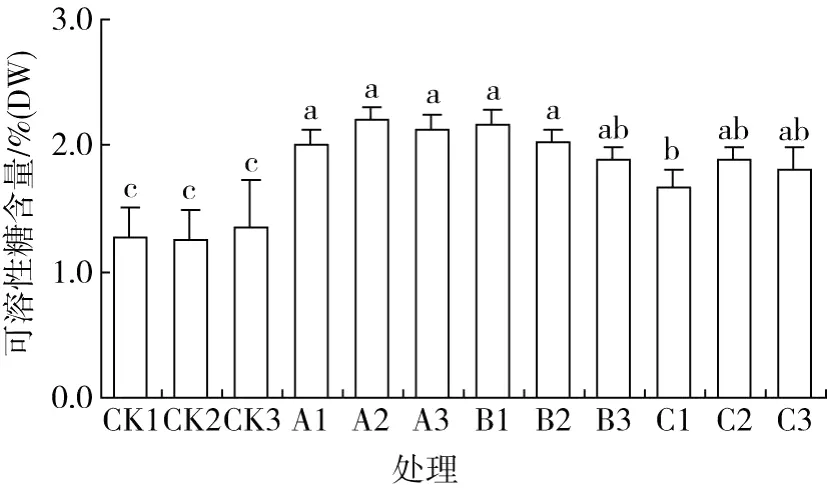
图7 伯乐树种子贮藏前后可溶性糖含量的变化
3 讨 论
种子形态是物种遗传变异的重要特征之一,可以影响到它的萌发和幼苗定植[11-12]。研究表明,生物统计学方法对一个种地理变异规律的研究结果与种源试验结果基本一致,因此了解果实及种子的地理变异规律,不仅可以为种源试验采样和试验设计提供信息,而且可以对种子区划及调拨范围的确定提供指导[13]。3个地区种子性状比较得知,与其他2个地区相比,浦城县地区的种子狭长而扁平,质量较小。另外,在相同的贮藏条件下,福建浦城县地区种子的发芽率均较低 (P<0.05)。分析认为,该地区伯乐树呈极为零星分布,且年龄级较小,开花的母树只有一棵,缺乏基因交流,有可能影响了种子的质量。
萌发实验还表明,新采收的种子,即使给予适宜的外界因子,其发芽率和发芽势均极低,经过贮藏之后发芽率和发芽势均有显著提高。研究表明,层积处理可以促使胚形态发育成熟、激素发生变化、抑制物质降解、大分子物质转化为小分子物质、提高一些酶的活力、促进有关基因的表达、低温下种皮透性增强、提高呼吸速率,以及使胚对脱落酸的敏感性降低等[14-15]。同样,利用适当的低温冷冻处理能够克服种皮的不透性,增进种子内部的新陈代谢,促进赤霉素和细胞分裂素等激素的合成,降解或转化脱落酸等抑制激素,从而促进种子的萌发[16]。实验结果也显示湿沙低温贮藏下的种子发芽率和发芽势均稍高。
种子的贮藏物质需要经过分解后,才能以可利用的方式动员到胚中去,以支持胚的迅速生长,这样就需要一些分解酶类的迅速合成。因此,种子发芽时,酶的活化是最为明显的现象之一[17]。贮藏之后,种子的淀粉酶和蛋白酶活性均显著升高。新采集的伯乐树种子淀粉含量达到其湿重的 80%左右,说明其种子属于淀粉类种子。因此,淀粉酶活性对伯乐树种子萌发过程中的物质转换和能量提供有重要影响。淀粉酶分解种子中储存的淀粉经一系列反应形成葡萄糖,供呼吸作用消耗。可溶性糖是种子贮藏过程中的主要呼吸底物[18],种子中可溶性糖主要由种胚和胚乳已贮藏的可溶性糖提供,并且可以从淀粉等高分子的多糖降解来得到补充[19-20],导致可溶性糖含量不降反升 (见图7)。淀粉酶活性的增加、淀粉含量的降低以及可溶性糖含量增加表现出了内部生理变化的一致性。而贮藏之后,蛋白质的含量与蛋白酶活性同时升高,分析认为这是由于种子萌发前期大量酶类物质的合成从而使蛋白质含量反而有所增加。
综合本次实验结果表明,伯乐树种子经不同条件贮藏 130 d后,种子含水量均明显增加,种皮出现裂痕,种子内的淀粉酶、蛋白酶活性也均升高,休眠得以解除,从而表现出较高的发芽率和发芽势,这表明伯乐树种子不适宜较长时间保存。
[1] 于永福.中国野生植物保护工作的里程碑——国家重点保护野生植物名录 (第一批)出台[J].植物杂志,1999(5):3-11.
[2] 卢清华,欧 斌,赖福胜,等.伯乐树播种育苗试验[J].林业科技开发,2007,21(2):94-95.
[3] 伍铭凯,杨汉远,龙 舞,等.伯乐树种子育苗试验[J].贵州林业科技,2006,34(4):39-42.
[4] 刘成运.伯乐树科及其近缘科的花粉形态研究[J].云南植物研究,1986,8(4):441-450.
[5] 曾懋修,童宗伦.伯乐树树干的解剖学研究[J].西南农业大学学报,1984(1):42-46.
[6] 吕 静,胡玉熹.伯乐树茎次生木质部结构的研究[J].植物学报,1994,36(6):459-65.
[7] 马忠武,何关福.中国特有植物钟萼木化学成分的研究[J].植物学报,1992,34(6):483-484.
[8] 李铁华,周佑勋,段小平.钟萼木种子生理休眠特性的初步研究[J].中南林学院学报,1997,17(2):41-45.
[9] 黄学林.种子生理实验手册[M].北京:农业出版社,1995.
[10] 宋松泉.种子生物学指南[M].北京:科学出版社,2005.
[11] MalikA U.Challenges and opportunities in allelopathy research:a brief overview[J].Journal of Chemical Eco logy,2000,26:2007-2009.
[12] Romeo J T.Raising the beam:moving beyond phytotoxicity[J].Journal of Chemical Eco logy,2000,26:2011-2014.
[13] 王军辉,顾万春,万 军,等.桤木不同种源球果及种子性状的遗传变异[J].东北林业大学学报,2006,34(2):1-5.
[14] Lin Chin-Ho,Lee Ling-Yann,Tseng Meno-Jiau.The effect of stratification and thidiazuron treatment on germination and protein synthesis of Pyrus serotina Rehd cv.Niauli[J].Annals of Botany,1994,73:515-523.
[15] Susan EM,Rosemary L P.Genetic regulation of seed dormancy in Purshia tridentate(Rosaceae)[J].Annals of Botany,2000,85:521-529.
[16] 徐是雄,唐锡华,傅家瑞.种子生理的研究进展[M].广州:中山大学出版社,1987.
[17] 中山包.发芽生理学[M].马云彬,译.北京:农业出版社,1988.
[18] 汪晓峰,景新明,林 坚,等.超干贮藏榆树种子萌发过程中ATP和可溶性糖含量的变化[J].植物生理学报,2001,27(5):413-418.
[19] Sheikh M B.The component of soluble sugar in peanut[J].Journal of agricultural and food chemistry,1992,40(5):780-783.
[20] 孙国容,陈月艳,关 旸,等.盐胁迫下星星草种子萌发过程中有机物、呼吸作用及其几种酶活性的变化[J].植物研究,1999,19(4):445-451.
