Jagged 1在生理性和病理性新生血管形成中的表达变化
2011-01-25严鹏科梅峥嵘段才闻
严鹏科 赵 慧 黄 煌 梅峥嵘 段才闻
1.广州医学院附属第三医院药剂科,广东广州 510150;2.南华大学病理研究所,湖南衡阳 421001;3.南华大学药物药理研究所,湖南衡阳 421001
肿瘤的生长和转移,均呈明显的新生血管依赖性。因为新生血管是提供病理组织养分保证肿瘤生长增殖的基础,同时,肿瘤新生的血管使得肿瘤细胞与个体的血管循环系统直接相通,这也是恶性肿瘤发生远处转移播散的必要条件。在实体肿瘤中,微血管网络承担着输送营养物质和排泄代谢废物的作用,是肿瘤生长和复发不可缺少的前提条件之一。肿瘤要达到1~2 mm3以上[1],必须生成新的血管以阻止肿瘤细胞的凋亡。因此,如何有效的截断肿瘤的血供、抑制新生血管,已经成为肿瘤治疗及防止肿瘤扩散的研究方向。血管生成方面的研究很多,目前已有药物应用于临床,通过阻断肿瘤血管生成抑制其生长、复发和转移,其疗效不令人满意,因为血管生成的关键调控因素尚不清楚。
Jagged 1是哺乳动物中第一个被证实的Notch受体的配体,参与调控许多组织的生长发育,在肌肉形成、神经、血管发生和维持正常造血前体细胞及其增殖等过程中起着重要作用[2],Jagged 1在肿瘤新生血管形成中也起了重要的作用,它在新生血管形成与肿瘤浸润、转移中的作用受到越来越多的关注。本研究建立鸡胚绒毛尿囊膜模型,动态观察血管发育不同时期Jagged 1的表达,探讨Jagged 1与血管发育的关系,并在正常的结直肠组织和不同大小结直肠癌组织中观察Jagged 1的表达,为肿瘤的治疗寻找新的靶点。
1 材料与方法
1.1 实验材料
人脐静脉内皮细胞株EA.HY926,由中南大学湘雅医学院细胞中心引进。种蛋购自衡阳联合养鸡公司,选用新鲜、大小适中的优质种蛋,半自动孵化箱自行孵育。在解放军169医院批准同意和告知患者家属同意后,收集解放军169医院外科手术切除的结直肠癌旁正常黏膜组织5例,结直肠癌新鲜标本15例,其中男11例,女4例;年龄28~75(平均56.9)岁;肿块直径≤3 cm患者、3 cm<肿块直径≤5 cm患者、肿块直径>5 cm患者各5例,手术切除的血管瘤旁正常皮肤组织和皮肤血管瘤新鲜标本各8例,其中男4例,女4例;年龄8~32(平均20.1)岁,所有标本均由病理组织学诊断证实。
1.2 实验方法
1.2.1 细胞培养 内皮细胞用含10%新生牛血清的DMEM培养液培养于37℃、5% CO2的恒湿培养箱中。细胞呈单层生长,铺满培养瓶后传代。传代时常规吸去培养液,用2.5 g/L胰蛋白酶消化,在显微镜下观察,发现胞质回缩、细胞间隙增大后,立即倾去胰酶,加适量含血清培养液吹打成单细胞悬液,调整细胞浓度用于实验。
1.2.2 鸡胚的培养及鸡胚绒毛尿囊膜模型的制备 新鲜受精鸡卵以1‰新洁尔灭清洗后放入60%相对湿度的孵育箱内孵育,呈45°夹角,有气室的一头向上,1~10 d温度设定为37.8℃,11~19 d设定为37℃,20~21 d设定为36.8℃,每天翻蛋2~3次。从鸡胚发育的第1天开始,每隔24 h剥开一批种蛋(每批5枚),观察鸡胚绒毛尿囊膜的生长情况,直到第21天。剥制时,用眼科镊在种蛋的气室一端轻敲一个直径为0.5 cm的小洞,沿着洞的周围,用眼科镊慢慢夹掉卵壳,轻轻揭开卵壳膜,注意勿伤及血管,暴露整个尿囊膜部分。以甲醇和丙酮混合液(1︰1)室温固定15 min,剥离尿囊膜,铺在培养皿中,阴干保存。
1.2.3 免疫组织化学染色 染色方法按照链霉素抗生物素蛋白-过氧化物酶(SP)法试剂盒说明书步骤操作。用已知阳性表达的组织做阳性对照,PBS代替一抗做阴性对照,结果以细胞膜和(或)胞浆出现黄色或棕黄色颗粒为阳性反应。
1.2.4 Western blotting 冰上称取组织100 mg,加蛋白裂解液进行蛋白抽提,应用Bradford法测定蛋白质含量。每样本取30 μg进行SDS-PAGE电泳,然后电转移至PVDF膜上,5%脱脂奶粉-PBST室温封闭1 h,PVDF膜分别与Jagged 1抗体、β-actin抗体4℃孵育过夜,再与HRP标记的二抗体37℃孵育1 h,化学发光显色后用凝胶成像系统扫描,半定量分析显影带。
1.3 统计学处理
实验均重复3次。各组数据均以均数±标准差()表示,采用SPSS10.0统计软件对数据进行单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 Jagged 1在人脐静脉内皮细胞EA.HY926中的表达
免疫细胞化学结果显示,Jagged 1主要在内皮细胞胞膜上呈阳性表达,胞浆中呈弱阳性表达,核表达为阴性,见图1。
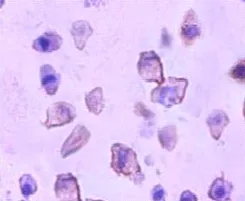
图1 Jagged 1在人脐静脉内皮细胞EA.HY926中的表达(×400)
2.2 鸡胚绒毛尿囊膜动态血管发育模型观察
第4.5天的鸡胚绒毛尿囊膜发育情况见图2A,胚胎继续发育,卵黄膜已覆盖大部分表面,肉眼可见鸡胚心脏跳动,尿囊膜开始发育,为一小水泡状,尿囊膜上可以看到细小的血管,但血管网不完善,只能观察到较细的血管和外周的血管环,血管内血液充盈不足,颜色偏淡不易观察,所以取第4.5天为鸡胚绒毛尿囊膜血管发育初生期的时间点。第8天的鸡胚绒毛尿囊膜发育情况见图2B,这时到了鸡胚器官发育末期,鸡胚绒毛尿囊膜已包围了大部分卵黄囊,尿囊膜上出现主干血管由胚胎向四周延伸,纹理清晰,大血管继续发育增粗,血管网进一步发育,可以观察到毛细血管网,小血管的数量及分支都有增加。第12天的鸡胚绒毛尿囊膜发育情况见图2C,此时尿囊膜已几乎完全覆盖了胚胎、卵黄囊和卵清,新血管达到高峰,较8日龄时增加达三倍之多,可见其上密集的血管网络,有丰富的粗大的血管,血管发育已完善,血管密度不再增加,主干血管清晰,呈树状均匀分布,血管间隙明显,小血管发育完全,所以取第12天为鸡胚绒毛尿囊膜血管发育旺盛期的时间点。第16天的鸡胚绒毛尿囊膜发育情况见图2D,血管开始退化,明显稀疏,细小的血管几乎已不可见,所以取第16天的鸡胚绒毛尿囊膜为血管发育消退期的时间点。第20天的鸡胚绒毛尿囊膜发育情况见图2E,大部分血管已萎缩不可见,只见残留的几根细小的血管。


图2 鸡胚尿囊膜动态血管发育模型
2.3 免疫荧光检测鸡胚绒毛尿囊膜血管中Jagged 1的表达
鸡胚尿囊膜发育至4.5 d时,Jagged 1表达于刚开始发育的细小血管、血管分叉处的茎细胞且表达量少。鸡胚尿囊膜发育至8 d时,Jagged 1表达于较为粗大的主干血管、未成熟完善的血管网状结构、小血管、分支及毛细血管网。鸡胚尿囊膜发育至12 d时,Jagged 1广泛表达于密集、发育完善的血管网络、丰富粗大的血管和各血管的分叉处。鸡胚尿囊膜发育至16 d时,Jagged 1在明显稀疏的各粗大血管中表达。鸡胚尿囊膜发育至20 d时,只有残留的几根细小血管依稀可见,Jagged 1表达减少,见图3。


2.4 Western blot检测鸡胚绒毛尿囊膜血管中Jagged 1的表达
为进一步证实不同血管发育期Jagged 1的表达变化,笔者选取胚龄为4.5、8、12、16和20 d的鸡胚绒毛尿囊膜,提取蛋白,Western blot检测Jagged 1表达量的变化。结果发现Jagged 1的变化呈先升高后降低的态势,即为从第4.5天(血管发育初生期)开始,表达逐渐上调,胚龄12 d(血管发育旺盛期)的表达量最多,随后Jagged 1的表达逐渐降低,胚龄16 d(血管发育消退期)的表达量明显减少,至胚龄20 d表达量降至最低,见图4。

图4 Western blot检测鸡胚绒毛尿囊膜血管中Jagged 1蛋白表达
2.5 免疫组化检测正常结直肠黏膜和结直肠癌中Jagged 1的表达
免疫组织化学结果表明,正常的结直肠黏膜中,Jagged 1表达于血管的内皮组织,血管间的结缔组织和肠绒毛表达阴性。结直肠癌细胞和肿瘤血管表达Jagged 1蛋白,其表达量与肿瘤体积,血管密度呈正比,Jagged 1广泛表达于肿瘤组织中新生的毛细血管和小血管,见图5。
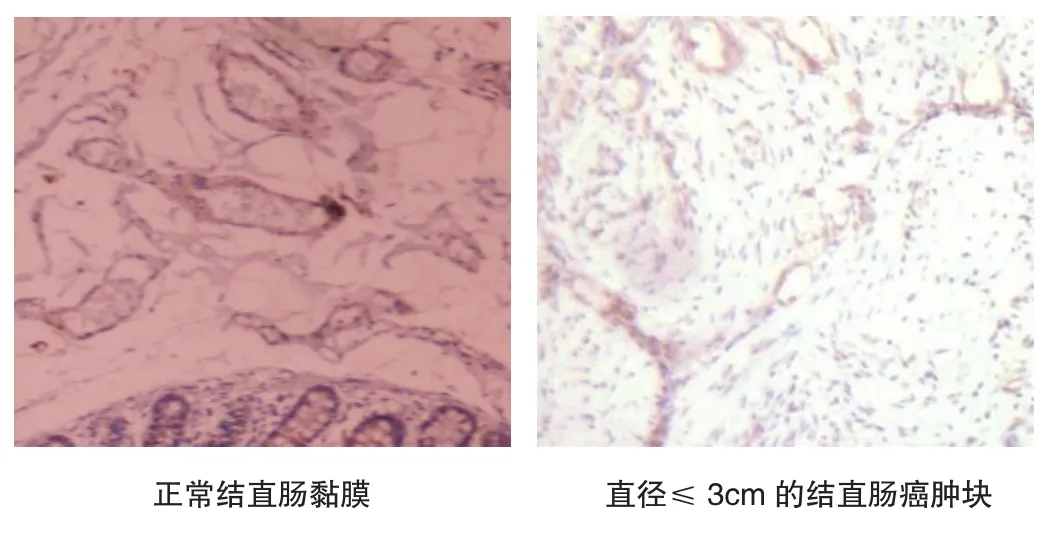

图5 Jagged 1在正常结直肠黏膜和不同体积的结直肠癌肿块中的表达
2.6 Western blot 检测正常结直肠黏膜和结直肠癌中Jagged 1的表达
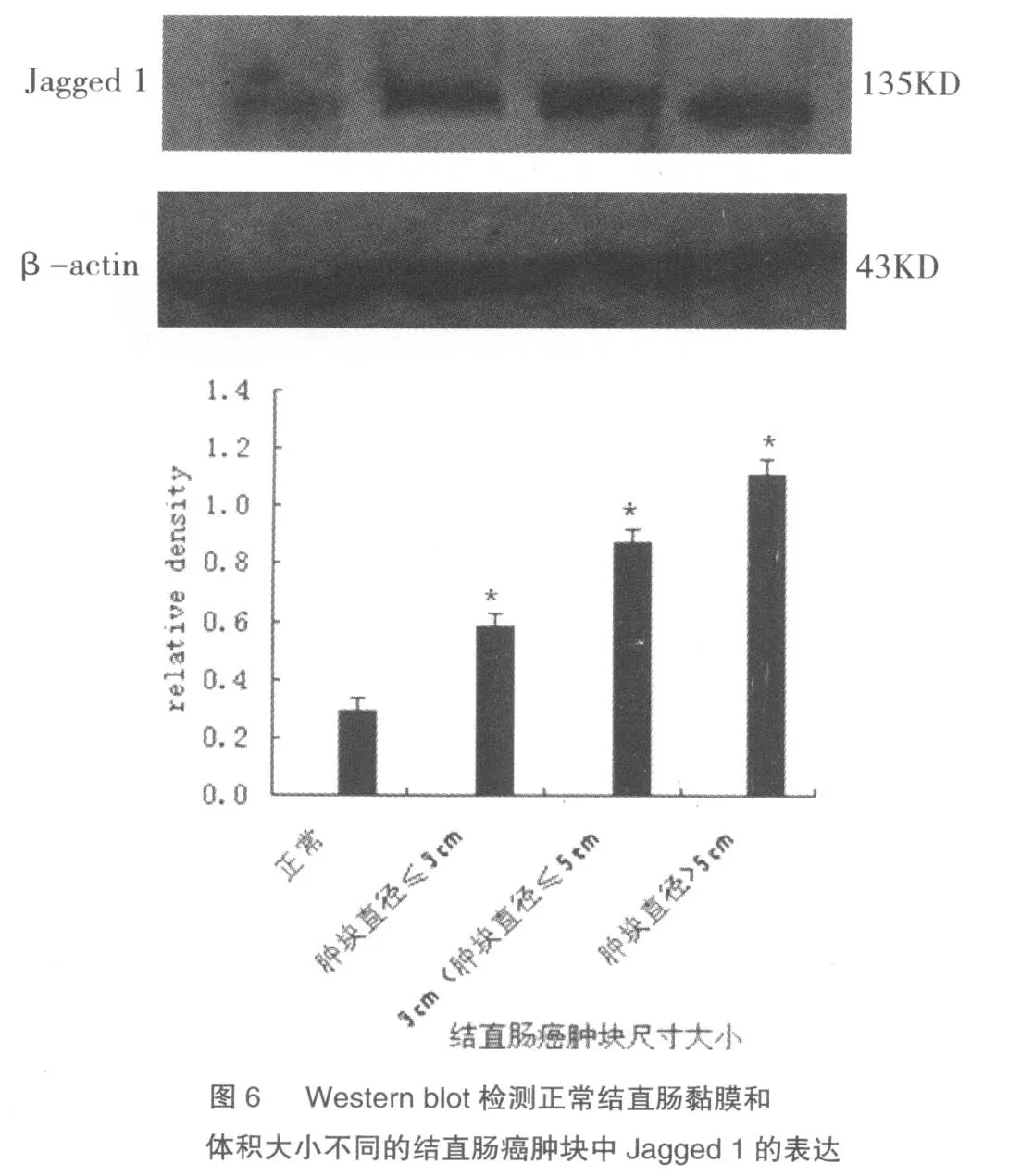
选取正常结直肠黏膜及大、中、小三个体积不同的结直肠癌肿块,分别提取蛋白,Western blotting检测Jagged 1表达量的变化。其结果与免疫组化结果相符,Jagged 1在结直肠癌中的表达量大大高于在正常结直肠黏膜中的表达量。肿瘤体积越大,血管生成越多,Jagged 1表达量越高,见图6。
3 讨论
鸡胚绒毛尿囊膜模型是研究血管生成的经典方法,鸡胚尿囊膜血管是研究血管生长常用的观测部位,此研究方法经济,且实验方法简单、易操作[3-4]。鸡胚绒毛尿囊膜血管的发育存在一个显著的特点,即从第1天孵育到第21天雏鸡出壳,尿囊膜上的血管会经历一个从无到有,从初生到旺盛、然后渐渐消退的过程,由此可以连续地研究血管发育过程中各种生长因子和抑制因子的变化。
Notch家族原本指果蝇中的一种特定的突变形式,是一个进化上十分保守的跨膜受体蛋白家族,它通过与其表达配体的相邻细胞相互作用实现细胞间的信号传递,从而决定动物发育过程中多种细胞的命运。研究显示Notch信号通路与肿瘤密切相关,在不同状况下,分别充当癌基因或抑癌基因[5]。Jagged 1是哺乳动物中第1个被证实的Notch受体的配体,研究表明,Jagged 1能单独或通过激活Notch信号通路影响肿瘤的发生发展,且参与了肿瘤的新生血管化[6]。Jagged 1在小鼠卵巢血管内皮细胞上的表达有助于小鼠卵子发生和卵巢血管形成[7],Jagged 1基因敲除小鼠会引发严重的胚胎和卵黄膜血管重塑缺陷,导致小鼠在胚胎发育11.5 d死亡,表现为血管发育异常和广泛出血[8]。Jagged 1基因敲除小鼠的血管内皮细胞不能形成良好的网状环样结构,内皮细胞伸出端状态异常,细胞迁移和形成细胞间相互连接的能力下降,血管发育重塑障碍,表明Jagged 1在胚胎血管发生中起关键作用[9]。
笔者前面的研究建立了鸡胚绒毛尿囊膜动态血管发育模型,观察和分析新生血管形成、发育和消退的过程,本实验利用此动态模型和尿囊膜较易剥取的特点,且尿囊膜血管网的发育随胚龄的增加而不断地深化,动态地展示了血管从初生、旺盛到消退的全过程。本实验用免疫荧光组织化学检测了鸡胚绒毛尿囊膜中Jagged 1的表达,发现血管发育过程中Jagged 1具有表达差异,鸡胚绒毛尿囊膜发育初期,血管网不完善,Jagged 1的表达量少。随着新生血管的重塑和成熟,Jagged 1广泛表达于密集、发育完善的血管网络,在血管发育消退期,Jagged 1的表达相应减少。Davis G.E和Birukova A.A等[9-10]的研究结果提示Jagged 1在血管生成中起关键作用,诱导了新生血管的形成。本研究显示,随着鸡胚尿囊膜血管从初生、旺盛到消退,Jagged 1的表达成逐渐上调再下调趋势。Western blot显示正常鸡胚尿囊膜组织中,随着生理性血管的形成,血管密度越大,血供越丰富,Jagged 1表达量增加,随着血管发育的进入消退期,血管密度越小,血供越少,Jagged 1的表达也降低。Jagged 1表达量与新生血管形成数量成正相关。因此笔者认为Jagged 1在血管生成中起关键作用,诱导了新生血管的形成。
血管生成是肿瘤生长和扩散的必要条件,1971年,Folkman指出“肿瘤生长依赖血管生成”,后又提出血管生成切换的概念,由此把恶性肿瘤的生长分为血管前期和血管化期。血管前期中,肿瘤细胞处于休眠状态或原位癌,肿瘤组织的营养及代谢产物的传送依赖与宿主组织间的相互弥散,从而进行肿瘤细胞的克隆性增殖,由此肿瘤细胞的产生和死亡基本平衡,肿瘤生长非常缓慢,不表现过度生长[11],最大直径不超过1~3 mm,此时如果肿瘤组织内无新生的毛细血管和小血管形成而建立新的血供,则肿瘤将停止生长或退化。从血管前期到血管化期的转化称为“血管生成开关”,一但肿瘤经历“开关”转化就进入了血管化期,血管化期对肿瘤组织的持续生长非常重要。在此期间,促进肿瘤生长的血管形成刺激因子占优势,抑制因子减少,将有大量的肿瘤血管生成,进而形成肿瘤组织的血管系统,完善了肿瘤组织的血液供应,肿瘤所需的氧、营养物由血管灌注供应,提供了肿瘤组织生存和发展的必要条件,肿瘤呈不可控制性生长。肿瘤新生血管结构缺乏完整性,管壁薄弱,仅排列一层内皮细胞,缺乏平滑肌,基底膜变薄或者缺如,使它们比正常成熟血管更容易被肿瘤细胞穿透,再者,血管生成本身就具有一定的组织侵袭性,肿瘤细胞可以沿着新生血管所开启的胶原裂隙侵袭,也可以进入血液循环在远离肿瘤的部位形成转移灶。因此,抑制血管生成可能是抗肿瘤生长和转移的有效途径。建立各种体内血管生成模型及体外检测与血管生成有关的内皮细胞的各项指标是实现寻找新的抗血管生成药物的关键。
鸡胚尿囊膜模型以鸡胚本身正常的血管作为研究对象,在研究血管生成机理或与血管生成相关因子时,缺乏肿瘤血管的特异性。因此本实验用免疫组织化学及Western blot检测了正常的结直肠黏膜和不同体积大小的结直肠癌肿块中Jagged 1的表达,发现Jagged 1表达于癌细胞胞膜和胞浆,且肿瘤体积越大,血管生成越多,Jagged 1的表达量越高。笔者分析Jagged 1可能通过与激活的Notch 1结合,刺激肿瘤新生血管形成从而促进肿瘤生长、侵袭及转移。
本研究利用鸡胚绒毛尿囊膜为模型,观察到Jagged 1的表达随血管发育而变化,Jagged 1与血管发育呈正相关,表明Jagged 1可能是新生血管形成的早期事件。笔者在正常的结直肠组织和不同大小结直肠癌组织中观察Jagged 1的表达,结果发现体积较大血管较丰富的结直肠癌组织,其Jagged l的表达较多,表明Jagged l的表达与结直肠癌的发生发展相关,Jagged l可通过与激活的Notch结合,增强其活性,刺激肿瘤新生血管形成从而促进肿瘤生长、侵袭及转移。
[1] Folkman J. Proceedings:Tumor angiogenesis factor[J]. Cancer Res,1974,34(8):2109-2113.
[2] Varnum-Finney B,Purton LE,Yu M,et al. The Notch ligand,Jagged-1,influences the development of primitive hematopoietic precursor cells[J].Blood,1998,91(11):4084-4091.
[3] Kim JS,Yu HK,Ahn JH,et al. Human apolipoprotein(a) kringle V inhibits angiogenesis in vitro and in vivo by interfering with the activation of focal adhesion kinases[J]. Biochem Biophys Res Commun,2004,313(3):534-540.
[4] Crivellato E,Nico B,Vacca A,et al. Recombinant human erythropoietin induces intussusceptive microvascular growth in vivo[J]. Leukemia,2004,18(2):331-336.
[5] Nicolas M. Notch1 functions as a tumor suppressor in mouse skin[J]. Nat Genet,2003, 33(3) : 416-421.
[6] Doi H. Jagged 1-selective notch signaling induces smooth muscle differentiation via a RBP-Jkappa-dependent pathway[J]. J Biol Chem,2006,281(39) :28555-28564.
[7] Vorontchikhina MA. Unique patterns of Notch 1,Notch 4 and Jagged 1 expression in ovarian vessels during folliculogenesis and corpus luteum formation[J]. Gene Expr Patterns,2005,5(5):701-709.
[8] Xue Y,Gao X,Lindsell CE,et al. Embryonic lethality and vascular defects in mice lacking the Notch ligand Jagged 1[J]. Hum Mol Genet,1999,8(5):723-730.
[9] Davis GE,D.R. Senger. Endothelial extracellular matrix:biosynthesis,remodeling, and functions during vascular morphogenesis and neovessel stabilization[J]. Circ Res, 2005, 97(11):1093-1107.
[10] Birukova AA. Involvement of microtubules and Rho pathway in TGF-beta1-induced lung vascular barrier dysfunction[J]. J Cell Physiol, 2005, 204(3):934-947.
[11] Reilly MS. Angiostatin:a novel angiogenesis inhibitor that mediates the suppression of metastases by a Lewis lung carcinoma[J]. Cell, 1994, 79(2):315-328.
