HPLC法测定人肝细胞L02内外液中金丝桃苷的含量Δ
2011-01-24幸海燕夏培元陈剑鸿孙凤军
幸海燕,夏培元,戴 青,陈剑鸿,孙凤军
(第三军医大学第一附属医院国家药品研究临床药理基地,重庆市 400038)
HPLC法测定人肝细胞L02内外液中金丝桃苷的含量Δ
幸海燕*,夏培元#,戴 青,陈剑鸿,孙凤军
(第三军医大学第一附属医院国家药品研究临床药理基地,重庆市 400038)
目的:建立测定人肝细胞L02内、外液中金丝桃苷(Hyp)含量的方法。方法:以80μg·mL-1的Hyp与L02共孵育0、3、6、12、24h后,采用高效液相色谱(HPLC)法测定细胞内、外液中金丝桃苷的含量。色谱柱为KROMASIL C18(250mm×4.6mm,5μm),流动相为甲醇-0.4%磷酸(45∶55),柱温为30℃,流速为1.0mL·min-1,紫外检测波长为360nm。结果:细胞外液中Hyp的标准曲线为Y=35.412X-8.586(r=0.9999),表明Hyp检测浓度在2~200μg·mL-1范围内与峰面积积分值呈良好线性关系;细胞内液中Hyp的标准曲线为Y=35.759X-7.422(r=0.9999),表明Hyp检测浓度在0.1~10μg·mL-1范围内与峰面积积分值呈良好线性关系。细胞外、内液中Hyp的平均回收率分别为(96.00±2.43)%、(97.18±4.62)%,平均日内RSD分别为1.98%、4.36%,平均日间RSD分别为1.75%、2.86%。样品溶液处理后室温放置22h,未处理样品溶液于-20℃放置6d,平均RSD均<5%。结论:本方法简单、准确、线性范围宽、灵敏度高、精密度和回收率良好,可为进一步研究Hyp的抗氧化作用与机制奠定方法学基础。
高效液相色谱法;人肝细胞L02;金丝桃苷
金丝桃苷(Hyperoside,Hyp)属黄酮醇苷化合物,结构为槲皮素-3-半乳糖苷,是临床上疏肝解郁、清热解毒药方中金银花、菟丝子、贯叶连翘、山楂等的主要黄酮类活性成分。现代研究发现,Hyp对缺血性脑损伤、心肌损伤、肝损伤与肾损伤均有显著保护效应,其作用机制主要为抗氧化[1,2]。Hyp进入细胞并维持一定的浓度,是其发挥抗氧化作用的首要前提。因此,测定细胞内、外液中Hyp的含量有助于了解其在细胞内的潴留情况,以便为Hyp的抗氧化作用与机制研究提供充分的证据。本文以人肝细胞L02为研究模型,建立以高效液相色谱(HPLC)法测定L02细胞内、外液中Hyp含量的方法,为Hyp的抗氧化研究奠定理论基础。
1 仪器与材料
1.1 仪器
1100 HPLC系统(美国Agilent公司);CL31R型离心机(美国Thermo Fisher Scientific公司);Q型超纯水器(美国Milli-Qplus公司);MODEL3111型细胞培养箱(美国Thermo Fisher Scientific公司);超净工作台(苏州净化设备有限公司)。
1.2 试药
RPMI1640培养基、胎牛血清(美国Hyclone公司);Hyp原料药(南京泽朗医药科技有限公司,批号:ZL0910010A,纯度:98%);Hyp对照品(中国药品生物制品检定所,批号:1521-200202);去离子水(笔者自制);甲醇为色谱纯,其余试剂均为分析纯。
1.3 细胞
人肝细胞L02购自中国科学院上海细胞生物所细胞中心。
2 方法
2.1 细胞培养与处理
L02与以含10%胎牛血清的RPMI1640培养液调整密度至2.25×105·mL-1,接种于75cm2细胞培养瓶,于37℃、5%CO2培养箱内常规培养24h。加药处理时,细胞用含5%胎牛血清的RPMI1640培养。
待细胞处理结束后收集培养液,于4℃、12000r·min-1离心10min,小心吸取2mL上清置EP管中,即为细胞外样品溶液。以5mL冷的PBS洗涤细胞2次后,加入5mL新的含5%胎牛血清的RPMI1640培养液,于-70℃与37℃反复冻融3次,收集细胞裂解物于4℃、16000r·min-1离心10min,吸取2mL上清置EP管中,即为细胞内样品溶液。
2.2 标准溶液的制备
准确称取Hyp对照品适量,以甲醇溶解制成浓度为1mg·mL-1的标准贮备液,4℃贮藏,备用。
用空白细胞外样品溶液稀释Hyp标准贮备液,配制成浓度分别为2、5、10、20、50、100、200μg·mL-1的细胞外标准溶液。用空白细胞内样品溶液稀释Hyp标准贮备液,配制成浓度分别为0.1、0.2、0.5、1、2、5、10μg·mL-1的细胞内标准溶液,4℃贮藏,备用
2.3 方法学考察
2.3.1 色谱条件[3]色谱柱:KROMASIL C18(250mm×4.6mm,5μm);流动相:甲醇-0.4%磷酸(45∶55);柱温:30℃;流速:1.0mL·min-1;紫外检测波长:360nm;进样体积:30μL。
2.3.2 标准曲线的制备 以“2.2”项下方法制得的标准溶液按1∶1比例加入甲醇,充分混匀后于13000r·min-1离心5min,小心吸取上清,自动进样30μL,以Hyp峰面积积分值(Y)为纵坐标,Hyp浓度(X)为横坐标,进行线性回归。
2.3.3 回收率、精密度和稳定性试验 用空白细胞外样品溶液稀释Hyp标准贮备液,配制成质量浓度分别为5、20、100μg·mL-1的细胞外样品溶液;用空白细胞内样品溶液,精密加入Hyp标准贮备液,配制成浓度分别为0.2、1、5μg·mL-1的细胞内样品溶液,自动进样30μL(每个浓度进样5针),记录色谱峰峰面积,按回归方程计算回收率。同法制备上述溶液,于日内与日间(5d)进样,考察方法精密度。处理后的样品溶液室温下避光放置10、22h,未处理的样品溶液于-20℃放置3、6d后分别测定Hyp含量,考察样品稳定性。
2.4 细胞内、外液中Hyp的含量测定
按不同时间段将L02分为5组,以含10%胎牛血清的RPMI1640培养液调整密度至2.25×105·mL-1,接种于75cm2细胞培养瓶,于37℃、5%CO2培养箱内常规培养24h后,加入Hyp浓度为80μg·mL-1的含5%胎牛血清的RPMI1640培养液。分别于加药后0、3、6、12、24h按“2.1”项下方法收集得细胞内、外样品溶液。样品溶液按1∶1的比例加入甲醇,充分混匀后于13000r·min-1离心5min,小心吸取上清,取30μL 进样,进行HPLC分析。
2.5 统计学方法
试验数据以±s表示,由SPSS 13.0统计软件处理。
3 结果
3.1 方法专属性
分别取空白细胞样品溶液、标准溶液、样品溶液进样测定。结果表明,在本色谱条件下,细胞内、外液中内源性物质对Hyp的测定无干扰,Hyp的保留时间分别约为8.11、8.08min。色谱见图1。
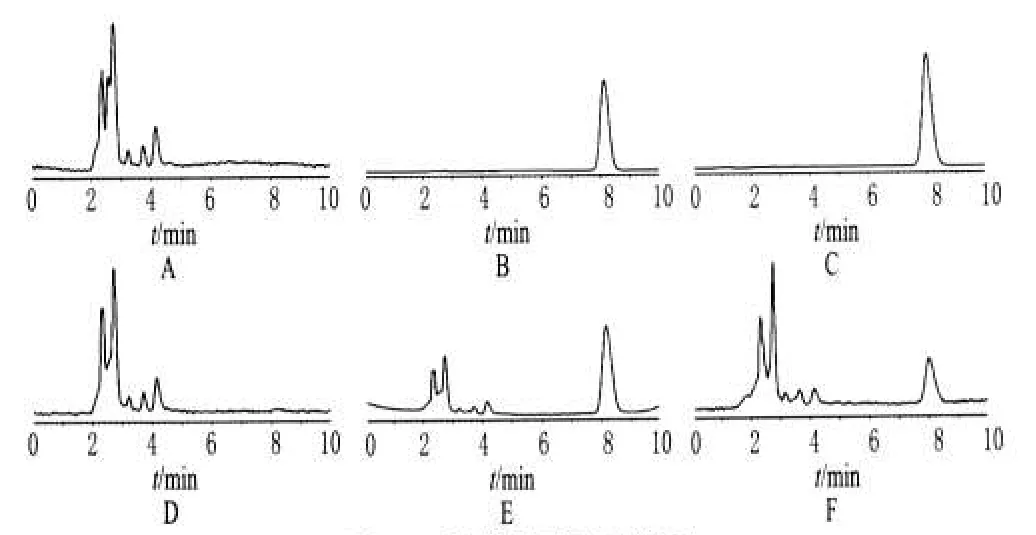
图1 高效液相色谱图A.空白细胞外样品溶液;B.细胞外标准溶液;C.细胞外样品溶液;D.空白细胞内样品溶液;E.细胞内标准溶液;F.细胞内样品溶液Fig1 Chromatogram of Hyp in L02cellsA.blank extracellular solution;B.extracellular standard solution;C.extracellular sample;D.blank intracellular solution;E.intracellular standard solution;F.intracellular sample
3.2 线性关系
得细胞外样品回归方程为Y=35.412X-8.586(r=0.9999);细胞内样品回归方程为Y=35.759X-7.422(r=0.9999)。结果表明,细胞外样品中Hyp检测浓度在2~200μg·mL-1范围内、细胞内样品中Hyp检测浓度在0.1~10μg·mL-1范围内与其峰面积积分值呈良好线性关系。细胞内、外液的定量限分别为0.1、2μg·mL-1。
3.3 回收率与精密度试验
按照“2.3.3”项下方法测定高、中、低浓度回收率,结果细胞外液分别为(98.60± 1.52)%、(94.91±1.63)%、(94.50±4.14)%,细胞内液分别为(98.09±2.07)%、(95.52±3.60)%、(97.91±8.20)%。细胞外、内液的日内平均RSD分别为1.98%、4.36%,日间平均RSD分别为1.75%、2.86%,表明本分析方法准确度高、稳定性好。回收率与精密度试验结果见表1。
表1 回收率与精密度试验结果(±s)Tab1 Results of recovery and precision test(s±s)

表1 回收率与精密度试验结果(±s)Tab1 Results of recovery and precision test(s±s)
样品类型细胞外液细胞内液c/μg·mL-1 5201000.215相对回收率/%94.50±4.1494.91±1.6398.60±1.5297.91±8.2095.52±3.6098.09±2.07日内RSD/%2.981.491.468.672.292.13日间RSD/%1.042.381.824.513.110.96
3.4 稳定性试验
按照“2.3.3”项下方法处理后的样品,避光贮藏的稳定性考察结果表明,细胞外样品溶液处理后室温避光放置10、22h,未处理溶液于-20℃放置3、6d的平均RSD分别为0.9%、4.5%、0.5%、0.5%;细胞内样品溶液分别为0.4%、1.1%、1.0%、1.0%。Hyp在细胞内、外液中的放置稳定性见表2。
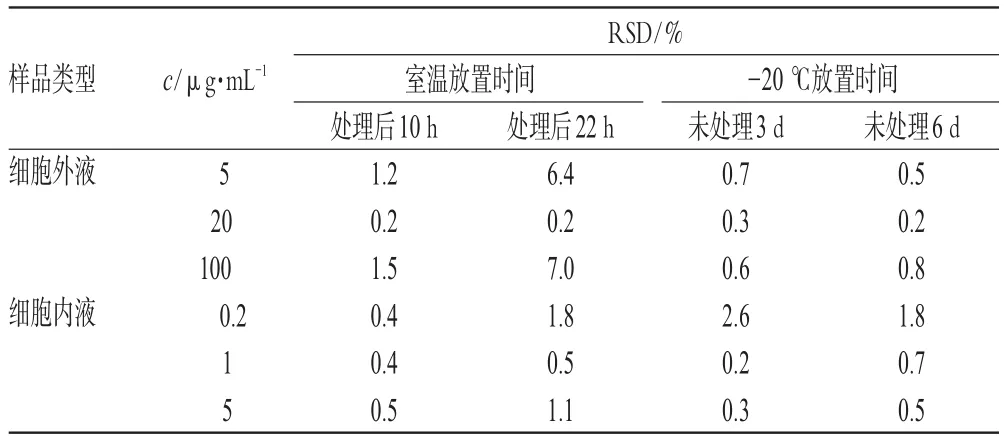
表2 Hyp在细胞内、外液中的放置稳定性(n=5)Tab2 Stability of Hyp in L02cells(n=5)
3.5 样品含量测定
按照“2.4”项下方法检测各时间点细胞内、外液中Hyp含量。结果表明,随着孵育时间的增加,进入细胞内的Hyp量也逐渐增加。细胞培养12h,进入细胞内的Hyp达峰值11.88%,随后细胞内的Hyp含量又缓慢下降。不同时间点细胞内、外液中Hyp的含量见表3。
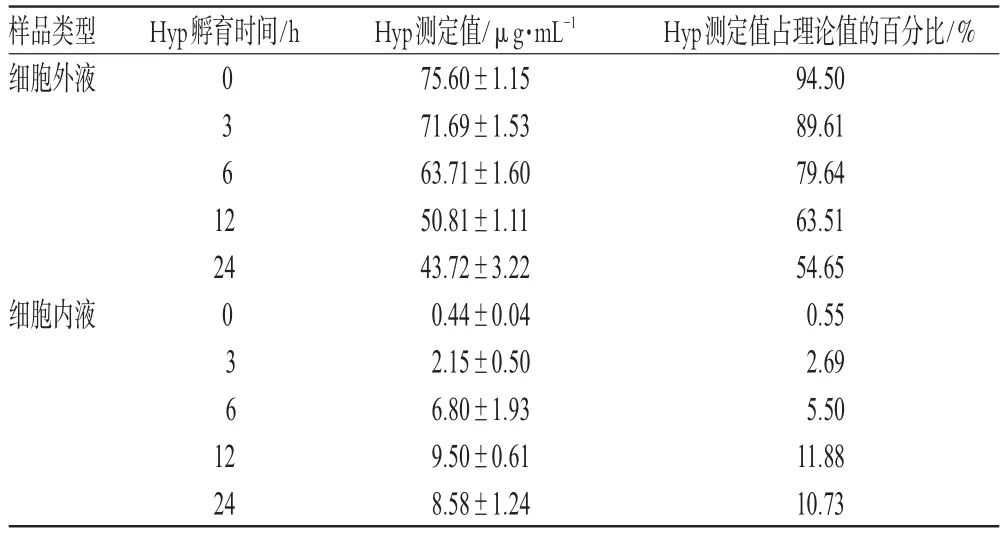
表3 不同时间点细胞内、外液中Hyp的含量(n=3)Tab3 Concentration of Hyp in L02cells after exposure to Hyp solution for various time(n=3)
4 讨论
目前,L02被广泛用作药物肝保护效应研究的模型[4,5],但有关HPLC法测定L02细胞内、外液中肝保护药物的含量却尚未见报道。本研究以了解Hyp在L02内的潴留过程为目的,建立了细胞内、外液中Hyp含量测定的HPLC法,为抗氧化研究中Hyp的给药浓度与时间的选择提供了充分的证据。
本研究在参考文献[6]的基础上,采用反复冻融的方法制备细胞内样品溶液。3次冻融结束后,在显微镜下未见形态完整的细胞,说明细胞破碎成功。该方法既避免了使用化学试剂破碎细胞带来的试验干扰,也能够保持检测药物的完整性,且本方法简便易行、重复性好,符合HPLC检测要求。
此外,本研究仅采用甲醇沉淀蛋白进行样品前处理,整个操作过程较为简单。因此,在确保准确进样、平行操作的前提下,选用简便易行的外标法进行Hyp的定量测定[7,8]。样品检测结果显示,终浓度为80μg·mL-1的Hyp与L02共孵育12h后,进入细胞内的Hyp达到峰值(11.88%),24h后又逐渐降低,这提示在后续的抗氧化研究中Hyp预保护L02的时间最好设在12~24h范围内。虽然Hyp的结构中含有糖基,进入细胞的能力较其他脂溶性药物低,但水溶性的增加也可以减少溶液配制时DMSO等助溶剂的使用,从而减少对细胞的毒性。孵育24h后,细胞内Hyp浓度逐渐降低,提示可能与其转变成其他代谢产物有关[9,10]。据报道,Hyp进入细胞后可以原型或代谢产物形式,通过螯合金属离子、直接清除自由基、调节细胞凋亡蛋白表达等机制发挥对各种细胞的保护效应[11,12]。
综上所述,本文建立的HPLC方法专属性好,回收率、精密度高,且方法简便、准确,可快捷地分析Hyp在细胞内、外动态变化的规律,可为进一步探讨Hyp的抗氧化效应和机制奠定方法学基础。
[1] Piao MJ,Kang KA,Zhang R,et al.Hyperoside prevents oxidative damage induced by hydrogen peroxide in lung fibroblast cells via an antioxidant effect[J].Biochim Biophys Acta,2008,1780(12):1448.
[2] Piao XL,Mi XY,Tian YZ,et al.Rapid identification and characterization of antioxidants fromLigularia fischeri[J].Arch Pharm Res,2009,32(12):1689.
[3] 王继森,刘友平,程 贝,等.莲房中金丝桃苷的分离鉴定及药材质量标准研究[J].成都医学院学报,2008,3(1):35.
[4] Wang Q,Liu TT,Fu Y,et al.Vanadium compounds discriminate hepatoma and normal hepatic cells by differential regulation of reactive oxygen species[J].J Biol Inorg Chem,2010,15(7):1087.
[5] Ou Y,Zheng S,Lin L,et al.Protective effect of C-phycocyanin against carbon tetrachloride-induced hepatocyte damage in vitro and in vivo[J].Chem Biol Interact,2010,185(2):94.
[6] Liu Z,Tao X,Zhang C,et al.Protective effects of hyperoside(quercetin-3-o-galactoside)to PC12cells against cytotoxicity induced by hydrogen peroxide and tert-butyl hydroperoxide[J].Biomedecine&Pharmacotherapy,2005,59(9):481.
[7] 马坤芳,王德旺,都述虎,等.HPLC法测定山楂叶中总黄酮的含量[J].中国药房,2008,19(33):2599.
[8] 汪光林,王 坚,吕 晔.RP-HPLC法测定宁心红杞胶囊中金丝桃苷和绿原酸的含量[J].中国药房,2008,19(9):694.
[9] Chang Q,Zuo Z,Chow MS,et al.Difference in absorption of the two structurally similar flavonoid glycosides,hyperoside and isoquercitrin,in rats[J].Eur J Pharm Biopharm,2005,59(3):549.
[10] Spencer JP,Chowrimootoo G,Choudhury R,et al.The small intestine can both absorb and glucuronidate luminal flavonoids[J].FEBS Lett,1999,458(2):224.
[11] Piao MJ,Kang KA,Zhang R,et al.Hyperoside prevents oxidative damage induced by hydrogen peroxide in lung fibroblast cells via an antioxidant effect[J].Biochimica Et Biophysica Acta-General Subjects,2008,1780(12):1448.
[12] Li HB,Yi X,Gao JM,et al.The mechanism of hyperoside protection of ECV-304cells against tert-butyl hydroperoxide-induced injury[J].Pharmacology,2008,82(2):105.
Content Determination of Hyperoside in L02Cells by HPLC
XING Hai-yan,XIA Pei-yuan,DAI Qing,CHEN Jian-hong,SUN Feng-jun
(State Base of Drug Research and Clinical Pharmacology,The First Affiliated Hospital of Third Military Medical University,Chongqing 400038,China)
OBJECTIVE:To establish the HPLC method for the content determination of hyperoside(Hyp)in L02cells.METHODS:HPLC was used to determine the concentrations of Hyp in L02cells,after co-cultured with Hyp at the concentration of 80μg·mL-1for 0,3,6,12,24h.HPLC analysis was performed on a KROMASIL C18(250mm×4.6mm,5μm)column at flow rate of 1.0mL·min-1using methanol-0.4%phosphoric acid(45∶55)as mobile phase with UV detection at 360nm.The column temperature was 30℃.RESULTS:The linear range of extracellular Hyp was 2~200μg·mL-1and that of intracellular Hyp was 0.1~10μg·mL-1(r=0.9999).The standard curves of extracellular Hyp wasY=35.759X-7.422and that of intracellular Hyp wasY=35.412X-8.586.Average recovery rates of extracellular and intracellular Hyp were(96.00%±2.43%)and(97.18%±4.62%).The RSD of intra-day and inter-day were 1.75%and 2.86%,respectively.The treated samples were kept at room temperature for 22hours and untreated samples were kept at-20℃ for 6days.The average RSD was below 5%.CONCLUSION:The results show that established HPLC method is simple,accurate and sensitive for the content determination of Hyp in L02cells.The wide liner range,satisfied precision and good mean recovery guarantee it can be used for further study of antioxidative effect of Hyp.
HPLC;L02cells;Hyperoside
R285;R969
A
1001-0408(2011)19-1731-04
Δ国家自然科学基金资助项目(30572366)
*博士研究生。研究方向:天然植物药的药理学。电话:023-68765991。E-mail:haiyanxing@yahoo.com.cn
#通讯作者:教授,博士研究生导师,博士。研究方向:新药药理研究及评价。电话:023-68754438。E-mail:py_xia@yahoo.com.cn
2010-09-10
2010-10-26)
