138份注射用药品说明书中理化配伍禁忌内容标注情况的调查分析
2011-01-24陈蓉,张蓓,陈青
陈 蓉,张 蓓,陈 青
(天津市天和医院,天津市 300050)
138份注射用药品说明书中理化配伍禁忌内容标注情况的调查分析
陈 蓉*,张 蓓,陈 青
(天津市天和医院,天津市 300050)
目的:了解我院常用注射用药品说明书配伍禁忌标注的情况,为规范药品说明书提供参考。方法:根据《药品说明书规范细则(暂行)》和《药品说明书和标签管理规定》,对我院常用注射用药品说明书“用法用量”、“药物相互作用”及“注意事项”项目中配伍禁忌等情况进行调查和统计分析。结果:本次调查共纳入注射用药品说明书138份,明确标注配伍禁忌的共51份,占总数的36.96%;详细标注辅料成分的共22份,占总数的15.94%。结论:注射剂的合理配伍相关信息对于临床安全用药至关重要,但说明书对此项内容标注情况不尽人意。建议生产厂家在说明书中详细说明相关情况,使之更具有指导性,确保临床用药安全、有效。
药品说明书;配伍禁忌;合理用药
药品说明书是药品生产单位对药品主要特性及技术标准的介绍,是指导临床医护人员和患者安全、合理用药的科学依据。近年来,由于临床静脉用药不断增多,特别是新药临床应用的日益广泛,药物配伍也日趋复杂,用药安全性和不良反应也越来越引起医务工作者的重视。据卫生部药品不良反应监测中心推算,在输液环节发生的不良反应可达10%[1]。通过药品说明书,医护人员可以了解药物的理化性质、配伍禁忌及配药时的注意事项等,保证药物的安全使用和治疗效果。因此,笔者对我院138份注射用药品说明书中配伍禁忌相关内容进行了统计、分析,并结合临床实际用药情况,对此部分应当注意的问题加以讨论,为规范药品说明书提供参考。
1 资料与方法
收集我院常用注射用药品说明书138份,参考《药品说明书规范细则(暂行)》和《药品说明书和标签管理规定》对上述说明书中所列项目进行统计分析,重点对说明书中“用法用量”、“药物相互作用”及“注意事项”项目中配伍禁忌的情况进行探讨分析。
2 结果
2.1 纳入药品情况
所收集的138份药品说明书根据药理作用可分为18大类,共涉及103个厂家的138个品种。其中,国产品种122个、进口品种14个、合资品种2个。根据药品批准文号将所有药品分为中药注射剂和西药注射剂。中药注射剂品种12个,占所有品种的8.70%;西药注射剂品种126个,占所有品种的91.30%。138份说明书所涉及的中、小容量注射剂71个,大容量注射剂11个,分别占所有品种的51.45%和7.97%。注射用无菌粉末品种56个,占所有品种的40.58%。普通无菌粉末品种36个,冻干无菌粉末品种20个,其中自带溶媒的7种,不带溶媒的49种。
2.2 相关项目标注情况
所涉及的138份药品说明书中,“用法用量”一项标注率为100%,“药物相互作用”一项标注率为99.27%,“注意事项”一项标注率为100%。有关理化配伍禁忌内容主要集中标注在“用法用量”、“药物相互作用”及“注意事项”3个项目中,所在项目不统一,没有规范性,具体标注情况详见表1。12种中药注射剂和126种西药注射剂中配伍禁忌标注情况详见表2。

表1 理化配伍禁忌所在项标注情况Tab1 Item for the physical and chemical incompatibility
在所涉及的12种中药注射剂中配伍禁忌标注“尚不明确”的7种,未予标注者2种,二者合计占中药注射剂总数的75%,明显高于西药注射剂的61.90%。由于目前临床应用的各种注射剂配伍应用检索表中,缺乏对中药注射剂的相关资料,因而说明书的作用就显得更为重要。
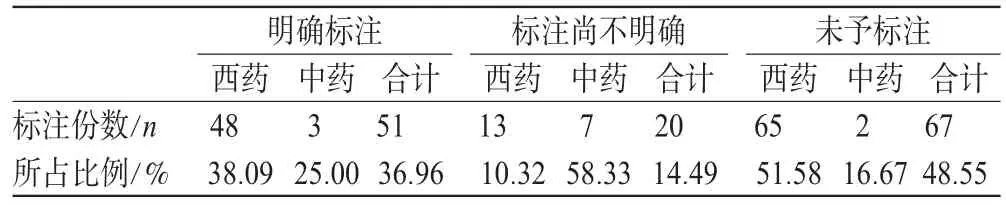
表2 138份药品说明书理化配伍禁忌标注情况Tab2 Labeling information of physical and chemical incompatibility in 138pieces of package insert
2.3 配伍禁忌标注情况
51种明确标注配伍禁忌的药品说明书中,提示序贯滴注应作冲管操作的仅有4种,但临床提示,对于有明确配伍禁忌的药物,仅简单地分别滴注而忽略序贯给药过程中出现的理化变化,仍然可导致不良后果。51份明确标注配伍禁忌的药品具体标注情况详见表3。

表3 51份明确标注配伍禁忌标注情况Tab3 Clear labeling information of incompatibility in 51pieces of package insert
2.4 辅料成分标注情况
说明书中标注辅料成分,可以提示药师和医师在临床使用过程中有效避免理化配伍变化的产生,也提示对于某些辅料过于敏感或不能耐受的患者可以避免使用含有这类辅料的药物。《药品说明书和标签管理规定》要求注射剂应当列出所用的全部辅料名称,但调查所示仍有41份无辅料一项,且大部分标注较简单,详见表4。

表4 辅料成分标注情况Tab4 Labeling information of excipients
2.5 配制方法标注情况
所涉及品种需稀释使用的127种药物中有21种未标明溶解及稀释溶媒,有52种未标明所稀释浓度,这给临床合理配液操作会带来不便,而且极易发生配伍反应,稀释液标注情况详见表5。

表5 稀释液使用方法标注情况Tab5 Show the usage of dilutions
2.6 国产与进口药品标注情况比较
所涉及药品中,同种药品同时有国产与进口品种的共7种,比较其标注项目,显示进口药品比国产药品说明书在操作、配制及注意事项几方面标注更为详尽,具体详见表6。

表6 7种同种药品国产与进口标注情况Tab6 7domestic and imported medicine of the same drug labeling information
3 分析与讨论
根据《药品说明书规范细则(暂行)》和《药品说明书和标签管理规定》,药品说明书中需明确标示的项目共有20项,但未对“配伍禁忌”内容提出要求。然而在影响输液安全的诸多因素中,静脉输液药物的合理配伍是其中的核心问题之一,有配伍禁忌的药物组合后外观性状破坏,发生物理或化学变化,如不溶、沉淀、氧化还原、变色、分解等作用性质改变,使之失效或产生毒性物质,以致不可使用,因此说明书中明确标注理化配伍禁忌是保障临床合理用药的依据。本文调查的138份说明书中明确标注理化配伍禁忌情况的51份,仅占总数的36.96%,说明生产厂家对于理化配伍禁忌的研究与重视程度不够。此外,所涉及的138份说明书中仅有3种进口药品及1种国产药品在说明书中明确标注药物pH值,这对于临床医护人员正确判断药物的酸碱性以避免配伍反应会产生很大影响。建议国家相关部门加强对药品说明书的安全监管,定期组织专家对上市药品进行再评价,督促药品生产厂家根据临床最新研究进展、上市后药品监测情况及再评价结果,加强说明多种药物间的理化配伍和输注通路的合理安排等内容的修改和补充。
注射用药物溶媒也是引起理化作用的一个重要因素。说明书中需配制使用的药品溶解、稀释溶媒对于药液稳定性和操作注意事项等叙述,直接影响医护人员在短时间是否能正确选好注射用药物的溶解、稀释溶媒,从而影响药物的治疗效果和安全性。注射剂的酸碱度是选择溶媒或稀释液的依据,但调查显示仅有少数说明书明确标注了药物的pH值,这对于临床医护人员正确判断药物的酸碱性会产生很大影响。因此,建议厂家在说明书上标注注射液的酸碱度,以利于指导医护人员选择合适溶媒,保证药物使用安全、有效。由于弱酸和弱碱的电离度小,在溶液中大部分以分子状态存在,当介质pH变化时,其电离率也相应变化,直接影响其溶解度。而一些临床常用的参考材料,如汤光等的配伍禁忌表,虽提出两种药物有配伍禁忌的原因主要是pH值不同,但没有说明如果将这两种药物溶解在大体积输液中,其pH得到缓冲,还能否配伍。因此,从临床上来看,说明书标注配伍禁忌是很必要也很有作用的。
中药注射剂成分复杂,其生物碱、苷类、氨基酸等主要成分和一些未被除尽的杂质在与另一药物配伍后,可因pH改变或氧化、缩合、水解等反应而析出微细胶体颗粒[2]。因此,建议生产厂家应逐步完善中药注射剂说明书中相关注意事项和作好药物间相互作用的统计,使临床医师和患者明确中药注射剂在使用过程中应该注意哪些问题,明确使用该注射剂后容易与哪些药物发生相互作用,避免因药品说明书中的项目缺失而发生药品不良反应/事件。
尽管我国药品的监督管理工作进一步网络化、科学化、规范化,但由于国内、外制药企业的生产条件和实验条件不同,其产品说明书存在不同程度的差别。表6的研究表明,国内药品说明书不完整、不够规范,很多关键项目的缺失,缺乏临床或非临床试验数据支撑,造成了其科学性不强,在临床实践中指导合理用药的意义不大,甚至形同虚设的不良现状。
药品说明书是医护人员获取用药信息的重要渠道,是安全用药、合理用药的科学依据。本次说明书理化配伍禁忌的调查综合评价不尽如人意,会给临床合理用药带来隐患,表明药品说明书的规范化不仅事关生产企业,也是药品监管机构的责任。只有发挥政府监督机构、生产企业、医务人员、社会等多方面的综合监督功能,通过修订、完善相关的法律、法规来加强执法力度,提高对药品说明书的重视程度,加强对药品说明书修改与更新的监管,才能使我国药品说明书不断科学化、规范化,进一步保障临床用药安全。
[1] 吴凤清.输液配药变革在弦[J].中国医院院长,2006,2(19):64.
[2] 魏宇宁,李久旭,王洪刚,等.苦碟子注射液与5种大输液配伍的稳定性考察[J].中国药房,2008,19(36):2834.
Investigation and Analysis of the Label of Incompatibility in 138Package Inserts
CHEN Rong,ZHANG Bei,CHEN Qing
(Tianjin Tianhe Hospital,Tianjin 300050,China)
OBJECTIVE:To understand the label of incompatibility in package inserts of injection in our hospital and to provide reference for regulating drugs specification.METHODS:According to package insert regulation(trial)and package insert and label management regulation,package inserts of commonly used injections in our hospital were investigated and analyzed in respect of dosage and usage,drug interaction and cautions and incompatibility.RESULTS:138package inserts were involved in the study.51package inserts contained the content of incompatibility,accounting for 36.96%.22pieces of package insert included the detail of excipients,accounting for 15.94%.CONCLUSION:Information about compatibility of injection is very importance for the safety of drug use while the label of incompatibility leaves much to be desired.It is suggested to state related information in package insert in detail in order to give it the character of guidance and ensure safety and effectiveness of drug use in the clinic.
Drug package insert;Incompatibility;Rational drug use
R926
C
1001-0408(2011)20-1841-03
*主管药师,本科。研究方向:医院药学。电话:022-23197176。E-mail:Tianheyiyuan92@yahoo.com.cn
2010-12-26
2011-03-07)
