国内外关于左炔诺孕酮紧急避孕药不良反应的数据分析与评价Δ
2011-11-17朱向
朱向,李 瑛
(#国家人口计生委计划生育药具不良反应监测中心/江苏省计划生育科学技术研究所,南京市210036)
国内外关于左炔诺孕酮紧急避孕药不良反应的数据分析与评价Δ
(#国家人口计生委计划生育药具不良反应监测中心/江苏省计划生育科学技术研究所,南京市210036)
目的:为我国左炔诺孕酮紧急避孕药安全使用与评价提供参考。方法:对美国食品与药品管理局医药产品不良事件报告体系、我国国家药品不良反应监测中心、世界卫生组织和我国国家人口计生委计划生育药具不良反应监测中心所收集到的左炔诺孕酮紧急避孕药不良反应报告进行分析,并对左炔诺孕酮紧急避孕药的不良反应进行文献检索与分析,找出国内、外关于左炔诺孕酮紧急避孕药不良反应发生类型与报告数据的差距并分析原因。结果:国内、外关于左炔诺孕酮紧急避孕药不良反应的发生类型、种类和报告数据方面均存在较大差距。结论:左炔诺孕酮紧急避孕药不良反应的公众教育、发放人员的专业培训及医师对紧急避孕药不良反应的认知与及时处理是减少与预防紧急避孕药不良反应发生的关键。
左炔诺孕酮;紧急避孕;不良反应
紧急避孕药是在觉察到避孕方法失败或无防护措施性交后的一定时间内,为避免非意愿妊娠的发生而使用的一类补救性药品[1]。目前,国际上最为常用的紧急避孕药为左炔诺孕酮紧急避孕药。近年来,随着使用左炔诺孕酮紧急避孕药人数的不断增加及低龄化等问题的不断出现,左炔诺孕酮紧急避孕药所致的不良反应(ADR)越来越受到国际社会的关注。笔者对美国食品与药品管理局(FDA)的医药产品不良事件报告体系(MedWatch)、我国国家药品不良反应监测中心、世界卫生组织(WHO)的乌普萨拉国际药物监测合作中心(UMC)和我国国家人口计生委计划生育药具不良反应监测中心(SCARS)所收集到左炔诺孕酮紧急避孕药ADR进行趋势分析及评价,以期为我国左炔诺孕酮紧急避孕药安全性研究提供参考依据。
1 美国左炔诺孕酮紧急避孕药ADR的发生趋势
美国FDA的MedWatch在2004-2008年间所收集到的左炔诺孕酮紧急避孕药ADR分别为2004年10例、2005年7例、2006年19例、2007年38例、2008年95例,共计169例[2]。 其中,涉及到了意外妊娠、异位妊娠、月经问题等多种ADR,在ADR中发生居前10位的依次为意外妊娠56例、月经问题32例、异位妊娠28例、晕厥12例、吐血8例、血栓4例、胰腺炎4例、抽搐3例、眩晕3例、痤疮3例,分别占ADR总数的33.14%、18.93%、16.57%、7.1%、4.73%、2.37%、2.37%、1.78%、1.78%、1.78%,详见图1。居前5位的ADR其历年的发生趋势详见图2。

图1 2004-2008年间美国左炔诺孕酮紧急避孕药ADR的发生情况Fig 1 The occurrence of adverse drug reactions induced by levonorgestrel emergency contraception in USA during 2004-2008
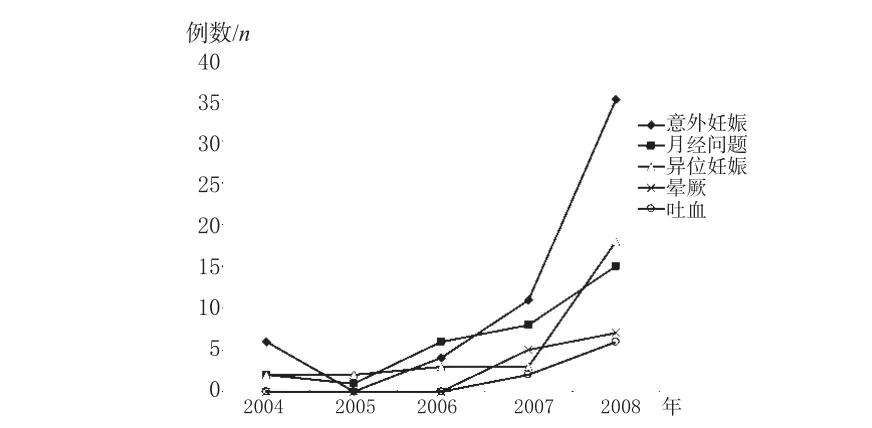
图2 2004-2008年间美国左炔诺孕酮紧急避孕药ADR前5位发生趋势Fig 2 The tendency of top 5 adverse drug reactions induced by levonorgestrel emergency contraception in USA during 2004-2008
2 UMC收集的左炔诺孕酮紧急避孕药ADR报告分析
WHO的UMC于2004-2008年间共计收到左炔诺孕酮紧急避孕药ADR报告59 298例,其中女性生殖系统损害18 758例、中枢及外周神经系统损害7 152例、全身性损害6 501例、神经紊乱5 925例、胃肠系统损害4 506例、皮肤及其附件损害4 452例、代谢和营养障碍3 130例、肿瘤1 613例、心血管系统损害1 210例、视觉损害986例、免疫功能紊乱916例、肌肉骨骼系统损害738例、胎儿异常727例、血小板和出血/凝血障碍708例、肝胆系统损害454例、呼吸系统损害406例、泌尿系统损害398例、红细胞异常242例、内分泌紊乱199例、胶原组织损害103例、新生儿和婴儿异常65例、听觉和前庭功能损害52例、白细胞和网状内皮系统异常40例、味觉异常9例、嗅觉异常8例。其中,女性生殖系统损害中包括月经紊乱等60种ADR;中枢及外周神经系统损害中包括头痛等64种;全身性损害中包括疼痛等48种;神经紊乱中包括抑郁等44种;胃肠系统损害中包括腹痛等63种,共涉及781种ADR。
3 我国国家药品不良反应监测中心收集的左炔诺孕酮紧急避孕药ADR发生趋势
我国国家药品不良反应监测中心在2004-2008年间所收集到的左炔诺孕酮紧急避孕药ADR分别为2004年1例、2005年12例、2006年29例、2007年46例、2008年70例,共计158例。
该158例ADR报告中涉及到了类早孕反应、月经问题等10种ADR,按照发生数排序依次为类早孕反应108例、月经问题28例、皮疹9例、头晕5例、腹痛4例、腹泻1例、白带增多1例、血尿1例、痤疮1例,分别占ADR总数的68.35%、17.72%、5.70%、3.16%、2.53%、0.63%、0.63%、0.63%、0.63%,详见图3。

图3 2004-2008年间国家药品不良反应监测中心收集的左炔诺孕酮紧急避孕药ADR发生情况Fig 3 The occurrence of adverse drug reactions induced by levonorgestrel emergency contraception in UMC during 2004-2008
国家药品不良反应监测中心2004-2008年间收集到的左炔诺孕酮紧急避孕药ADR历年来的发生趋势见图4。
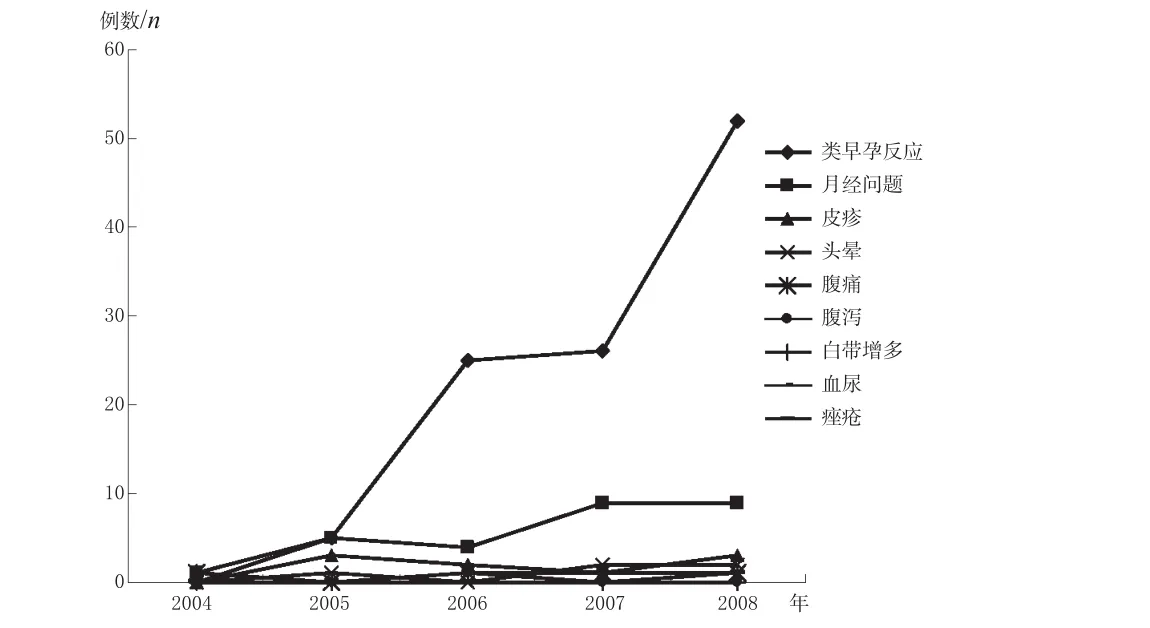
图4 2004-2008年间国家药品不良反应监测中心收集的左炔诺孕酮紧急避孕药ADR发生趋势Fig 4 The occurrence of adverse drug reactions induced by levonorgestrel emergency contraception reported by National Center for ADR Monitoring during 2004-2008
4 SCARS收集的左炔诺孕酮紧急避孕药ADR报告情况
截止2009年12月31日,SCARS收集到左炔诺孕酮紧急避孕药ADR报告13例,涉及4种ADR,依次为意外妊娠3例、异位妊娠3例、阴道出血3例、类早孕反应2例,分别占ADR发生总数的23.08%、23.08%、38.46%和15.38%。
5 国内外关于左炔诺孕酮紧急避孕药ADR发生类型的差距
5.1 已报告的左炔诺孕酮紧急避孕药ADR发生种类
经相关文献检索,目前世界范围内关于左炔诺孕酮紧急避孕药报道过的ADR有不规则出血、恶心、呕吐、异位妊娠[3]、乳房触痛、头晕、头痛、偏头痛[4]、颅内静脉血栓[5]、腹胀、性欲减少、抑郁[6]、静脉曲张、脑血管意外、脑膜炎及病毒性疾病[7]等。
5.2 国内外左炔诺孕酮紧急避孕药ADR类型的差距
根据美国MedWatch和WHO的UMC2004-2008年间关于左炔诺孕酮紧急避孕药ADR的监测数据,发现其所涉及到的ADR涉及女性生殖系统损害、中枢及外周神经系统损害、全身性损害、神经紊乱、胃肠系统损害、代谢和营养障碍、肌肉骨骼系统损害等多种类型。
目前,我国虽然紧急避孕药的市场销售量巨大,并呈逐年上升趋势,但我国的ADR监测机构所接收的相关ADR报告的类型和数量却极少,只集中于意外妊娠、异位妊娠、月经问题、类早孕反应、皮疹、头晕等几种类型。
5.3 国内外左炔诺孕酮紧急避孕药ADR报告数据的差距
根据国内、外2004-2008年间所收集到的左炔诺孕酮紧急避孕药ADR报告数据,美国FDA的MedWatch收集到的ADR排名前3位的依次为意外妊娠56例、月经问题32例、异位妊娠28例;WHO的UMC收集到的ADR排名前3位的依次为月经问题11 862例、头痛3 264例、意外妊娠2 824例,而可能危及到生命的异位妊娠则以817例位居第13位;我国国家药品不良反应监测中心收集到的ADR排名前3位的依次为类早孕反应108例、月经问题28例、皮疹9例;SCARS收集到的ADR排名前3位的依次为意外妊娠3例、异位妊娠3例、阴道出血3例。
6 国内外ADR差距的原因分析
从“5.3”项的分析可以看出,国际间关于左炔诺孕酮紧急避孕药ADR的发生类型与报告数据有着很大的差距,分析具体原因可能如下:
6.1 国内外左炔诺孕酮紧急避孕药说明书中关于ADR陈述的差距
美国销售的左炔诺孕酮紧急避孕药“PLAN B”的说明书非常详细,其中有对于17岁及以下女性只作为处方药使用的重点提示、特殊人群(老人、儿童、人种、肝肾功能不全)、使用禁忌(药物配伍使用相互作用)、警告(不可作为常规避孕使用、不可用于终止妊娠、月经影响、异位妊娠)、预先提示(妊娠、性传播疾病/人体免役缺损病毒(STD/HIV)、体检和随访、糖代谢、药物相互作用、哺乳期妇女、儿科使用、停药后的生育能力)、ADR等一系列告知的内容[8]。
而目前我国的左炔诺孕酮紧急避孕药说明书仅在“不良反应”一栏中写上了“偶有轻度恶心、呕吐,一般不需处理,可自行消失,如症状较重应向医师咨询”。这在很大程度上限制了医务人员对紧急避孕药ADR的认知,也限制了企业对公众不良反应的告知,最终限制了紧急避孕药ADR的发现与预防。
6.2 国内外关于左炔诺孕酮紧急避孕药安全性的公众教育及警示的差距
目前,对公众宣传某一类药安全性的责任主要还是由生产厂家来承担。而作为美国唯一生产销售左炔诺孕酮紧急避孕药“PLAN B”的DURAMED药厂在当初药品注册申请时就向FDA提交了一个详细而完整的关于该产品上市后销售、流通、公众教育及安全性监测的CARE计划(Convenient Access,Responsible Education Program)[9]。这个计划的重要职责就是对社会上所有可能接触该紧急避孕药的医师、药师、护士、销售人员及消费者进行安全性教育和警示,以使该药能合理合法的销售和使用,一旦出现ADR可及时收集信息并予以处理。
而我国的相关生产厂家目前尚未能承担起对社会上所有可能接触紧急避孕药的医师、药师、护士、销售人员及消费者进行安全性教育和警示的职责,左炔诺孕酮紧急避孕药的公众安全性教育很大程度上还仅仅依赖于医务人员和计划生育工作者有限的认知和宣传[10]。各级医疗机构重视程度不够及公众对避孕药具ADR报告制度认识不足都导致了左炔诺孕酮紧急避孕药ADR不同程度的漏报。
7 结论
随着使用紧急避孕药人群的不断低龄化,未婚人群、低龄人群的用药安全的公众教育,包括使用禁忌、警告及ADR的预先提示需要广大生产厂家的投入与支持;计划生育药具发放系统服务人员的专业知识培训是当务之急,医院医师对紧急避孕药ADR的认知和及时处理是减少与预防紧急避孕药ADR发生的关键。
[1] 程利南.紧急避孕法的不良反应及其防治[J].实用妇产科杂志,2008,24(3):141.
[2] FDA.The adverse event reporting system(AERS):lasted quarterly data files[EB/OL].http://www.fda.gov/Drugs/GuidanceComplianceReegulatoryInformation/Surveillance/ucm082193.2010-08.
[3] Ghosh B,Dadhwal V,Daka D.Ectopic pregnancy following levonorgestrel emergency contraception:a case report[J].Contraception,2009,79(2):155.
[4] Tanchev S,Shentov B.Emergency contraception with levonorgestrel in adolesce-nts[J].Akush Ginekol(Sofiia),2004,43(Suppl 3):S41.
[5] Horga A,Santamarina E,Quilez A.Cerebral venous thrombosis associated with repeated use of emergency contraception[J].Eur J Neurol,2007,14(4):5.
[6] No authors listed.Efficacy and side effects of immediate postcoital levonorgestrel used repeatedly for contraception[J].Contraception,2000,61(5):303.
[7] Ellen CG Grant.Adverse reactions and emergency contraception[J].Lancet,2001,357(9 263):1 203.
[9] Food and Drug Administration.Levonorgestrel emergency contraception[EB/OL].http://www.fda.gov/.2009-02-17.2009-04-20.
[10] 许玉芳,刘 宇,陈巧儿,等.推广紧急避孕宣传教育的意向性研究[J].中国计划生育学杂志,2002(增刊):168.
Analysis and Evaluation of Adverse Drug Reactions of Levonorgestrel Emergency Contraception at Home and Abroad
ZHU Xiang-jun,LI Ying
(State Contraceptives Adverse Reaction Surveillance Center,Jiangsu Institute of Family Planning Scientific Technology,Nanjing 210036,China)
OBJECTIVE:To provide reference for safe use and evaluation of levonorgestrel emergency contraception in China.METHODS:By the means of literature retrieval and analysis,the reports of adverse drug reactions induced by levonorgestrel emergency contraception from MedWatch(FDA Medical Products Reporting Program),National Center for ADR Monitoring,WHO and State Contraceptives Adverse Reaction Surveillance Center were analyzed to find out the differences of types and data of adverse drug reactions induced levonorgestrel emergency contraception and analyze the reasons.RESULTS:There were large type and data differences of adverse drug reactions induced by levonorgestrel emergency contraception at home and aboard.CONCLUSION:The public education,professional training of issue personnel and the cognition of doctors and immediate processing are key to reduce and prevent the adverse drug reaction induced by emergency contraception.
Levonorgestrel;Emergency contraception;Adverse drug reaction
R711;R96
C
1001-0408(2011)20-1835-03
2010-09-15
2011-04-11)
