BRAFV600E基因突变及p27蛋白表达与甲状腺乳头状癌颈淋巴结转移的关系①
2011-01-23卢军峰解乃昌姬逸男
卢军峰,解乃昌,姬逸男
(广西医科大学第一附属医院胃肠腺体外科,广西 南宁 530021)
近几年众多学者在甲状腺乳头状癌(papillary thyroid cancer,PTC)中检测到高频率的BRAFV600E基因突变,并且认为BRAFV600E突变与细胞周期调控因子p27的表达异常密切联系相关,其突变或表达异常会引起细胞的失控性生长,进而发生肿瘤和淋巴结转移[1]。本文通过检测PTC中BRAFV600E突变及p27蛋白的表达测定,并结合临床病理参数的研究,为PTC颈淋巴结转移的危险因素评估提供一定的依据。
1 材料和方法
1.1 临床资料:收集广西医科大学第一附属医院病理科2004年9月至2010年3月存档83例PTC蜡块,均为首次手术且术前未行放射碘治疗。术后及实验前经2位病理科专家再次确诊。患者年龄最小12岁,最大76岁,平均年龄45岁。男性17例,女性66例。
1.2 DNA提取、琼脂糖凝胶电泳、PCR-SSCP检测、BRAFV600E基因DNA序列分析:将各蜡块对照相应的HE切片,切成8μm厚切片,烤片脱蜡脱水并刮入1.5mL EP管中,经消化裂解粗提DNA。以DNA提取液为反应模板,用特异性引物扩增BRAF基因第15外显子。扩增产物皆经琼脂糖凝胶电泳鉴定目的基因片段。以12%非变性聚丙烯酰胺凝胶垂直平板电泳,银染。回收及纯化经PCR-SSCP筛选出有突变的DNA扩增样品。由北京诺赛基因组研究中心有限公司对样品测序。
1.3 免疫组织化学法:采用链霉菌抗生物素蛋白一过氧化物酶连接法(SP法):按抗体说明书(福建迈新生物技术公司)推荐的高压抗原修复法及相应实验步骤操作。由试剂公司提供阳性对照片,以PBS代替一抗作阴性对照。
1.4 p27蛋白半定量表达的测定:p27蛋白阳性定位于胞核或胞浆。每张切片随机选取10个高倍镜视野,据染色程度和着色细胞百分率进行判断:基本不着色记0分,按染淡黄色、棕黄色、棕褐色依次记为1-3分;着色细胞占计数细胞百分率≤5%记0分,6% -25%记1分,26% -50%记2分,>50%记3分。据两项得分乘积评分:分值<2者为染色阴性,分值≥2者为染色阳性。免疫组化结果见图1。
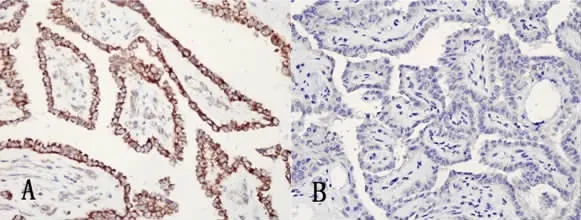
图1 PTC中CyclinD1和p27蛋白免疫组化表达
1.5 统计学处理:采用SPSS 15.0统计软件,率的比较应用X2检验。对分析影响淋巴结转移的独立影响因素利用Back stepwise LR检验分析,检验水准以P<0.05有统计学意义。
2 结果
2.1 本研究中83例PTC临床病理参数资料如表1所示。
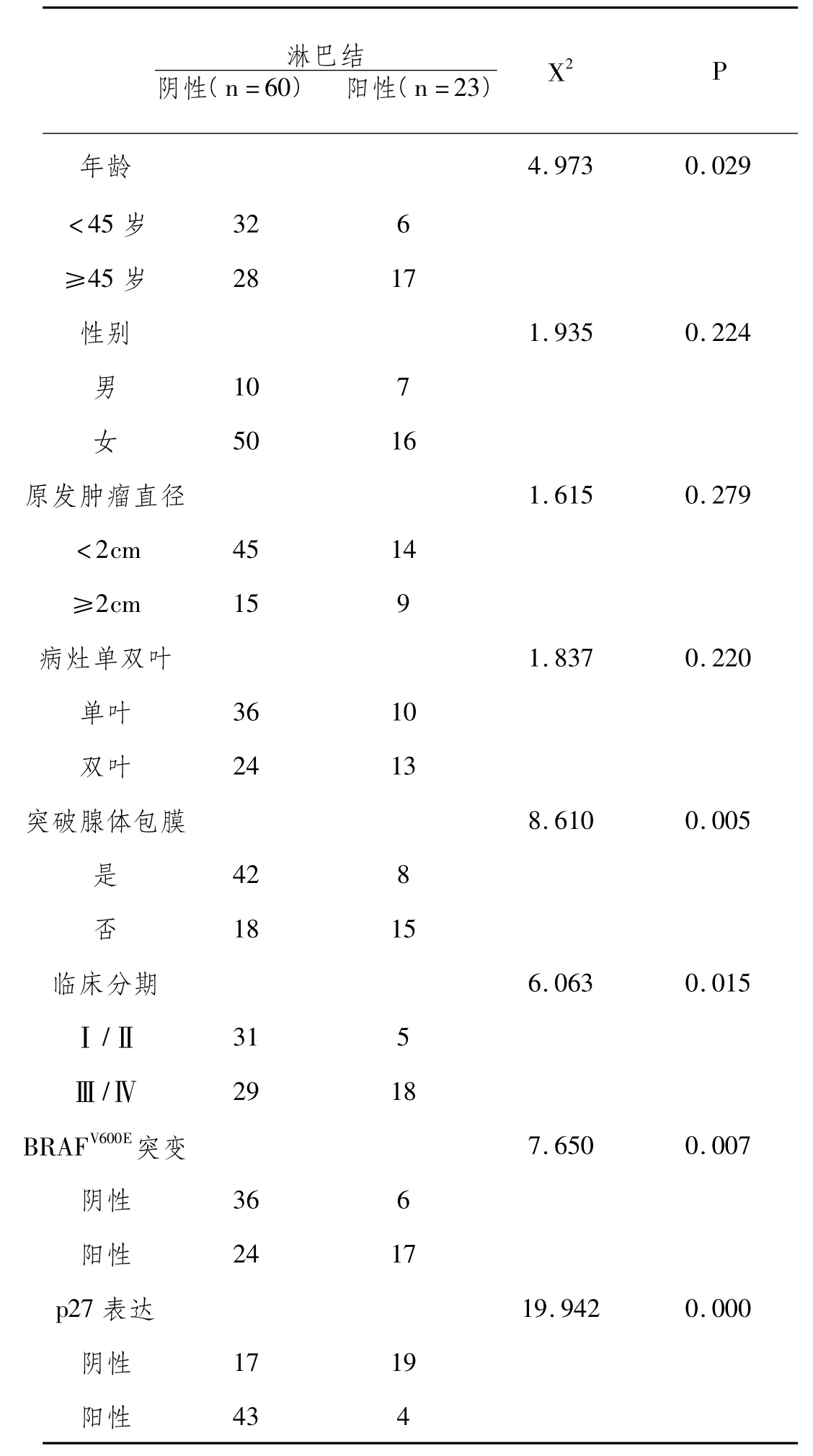
表1 83例PTC颈淋巴结转移与否的临床病理因素关系
83例PTC颈淋巴结转移情况在性别(P=0.224)、原发肿瘤直径(P=0.279)、病灶单双叶(P=0.220)的差异无显著性;而在年龄(P=0.029)、病灶突破腺体包膜(P=0.005)、临床分期(P=0.015)、BRAFV600E突变(P=0.007)和 p27(P <0.001)的差异有显著性。在检测出BRAFV600E基因突变阳性的41例PTC中,p27蛋白阴性率为 68%(28/41)。在BRAFV600E突变阳性PTC中p27呈低表达,基因突变组与野生组PTC在p27(P<0.001)表达的差异有显著性。
2.2 甲状腺乳头状癌颈淋巴结转移危险因素的多因素分析,见表2。

表2 83例甲状腺乳头状癌患者颈淋巴结转移危险因素的多因素分析
3 讨论
BRAF基因,又名鼠类肉瘤滤过性毒菌致癌同源体B1,是RAF基因家族成员,位于人染色体7q34,含18个外显子,编码蛋白质分子全长约94 kD,有783个氨基酸残基,属于丝氨酸/苏氨酸蛋白质激酶类,是MAPK激酶家族里最高效的磷酸化剂,在凋亡和增殖过程中起重要作用,调节细胞的生长发育。BRAFV600E突变最初是Davies[2,3]等在恶性黑色素瘤的研究中被发现,目前大量研究表明,BRAFV600E突变同样发生于甲状腺癌,且其发生率非常高,仅次于黑色素瘤。
p27属于细胞周期抑制蛋白(kinase inhibition protein/cyclin inhibition protein,KIP/CIP)家族成员,能抑制不同类型的细胞周期蛋白(Cyclin)与细胞周期蛋白依赖性激酶(Cyclin-dependent kinase,CDK)形成Cyclin-CDK复合物,阻碍细胞周期由G1期进入S期,对细胞周期起负调控作用。它在多种肿瘤中的异常表达显示出其与肿瘤的密切关系。p27蛋白低表达使其抑制细胞增长功能降低,细胞过度增殖,导致肿瘤发生。p27在多种肿瘤中低表达,是判断预后的重要指标,肿瘤中p27蛋白表达越低预后越差[4]。
本研究中实验病例皆为分化型甲状腺乳头状癌,临床病理评估因素除性别、年龄、原发灶大小、肿瘤分期等外,新增BRAFV600E基因突变和p27蛋白两个参考因素,对PTC临床病理预后风险评估体系参数(如AGES、AMES、MACIS、UICC - TNM 分期)起到很好的补充作用。单因素分析结果提示年龄、病灶突破腺体包膜、肿瘤分期、BRAFV600E基因突变和p27蛋白表达可以作为PTC颈淋巴结转移的危险因素。淋巴结转移组 PTC患者平均年龄较高、临床分期较晚、BRAFV600E突变率高、p27蛋白呈低表达。BRAFV600E基因突变检出率为48.7%,与相关研究[5]BRAF突变率为29%-83%的报道一致,且原发灶和转移淋巴结中也常检测到该基因突变,Meta分析揭示BRAFV600E突变型PTC组织侵袭力高,易浸润甲状腺周边组织,临床病理分期高。包膜受侵或发生淋巴结转移的PTC患者BRAFV600E突变率更高,但有些数据差异无显著性[6],原因可能与病例数目不足有关。BRAFV600E突变组PTC中p27呈低表达,在黑色素瘤和PTC细胞中的一项最新研究报道[7]指出:BRAFV600E基因突变阻断了细胞外信号调节激酶1/2(ERK1/2)通路的中粘附控制,导致p27蛋白表达下调。但某些报道[8]中没有确切的数据来证实BRAFV600E基因突变与p27表达下调之间的确切关系,需进一步的分子学实验来验证该理论。Pesutic-Pisac VA[9]等将PTC分为低危组(年龄<45岁、女性、肿瘤直径<2cm、病理示乳头状或滤泡状、腺体包膜完整、单发病灶、无淋巴结转移)和高危组(年龄≥45岁、男性、肿瘤直径≥2cm、病理示高柱状嗜酸性硬化细胞型、突破腺体包膜、多发病灶、有淋巴结转移),指出低危组的PTC患者,如果p27蛋白呈低表达,该类PTC患者发生颈淋巴结转移可能性仍较大。多因素分析结果提示年龄、BRAFV600E突变和p27蛋白低表达可以作为评估PTC颈淋巴结转移的危险因素,与Rodolico V[7]等的研究结论相似。而性别、原发肿瘤大小、病灶单双叶情况、病灶突破腺体包膜方面和肿瘤分期情况对PTC颈淋巴结转移的危险因素评价意义不是很大。
综合本实验方法和实验数据的分析,BRAFV600E突变和p27蛋白可以作为评估甲状腺乳头状癌颈淋巴结转移危险因素的参考指标,具有BRAFV600E基因突变和(或)p27蛋白低表达的PTC发生颈淋巴结转移的可能性较大。
[1]Hilger RA,Scheulen ME,Stumber GD.The Ras- Raf-MEK - ERK pathway in the treatment of cancer[J].Onkologie,2002,25(6):511 -518.
[2]Davies H,Bignell GR,Cox C,et al.Mutations of the BRAF gene in human cancer[J].Nature,2002,417(6892):949-954.
[3]Xing M.BRAF mutation in thyroid cancer[J].Endocr Relat Cancer,2005,12(2):245 -262.
[4]Goto AK,Sakamoto AT,Machinami RI.An immunohistochemical analysis of cyclinD1,p53 and p21waf1/cip1 proteins in tumors originating from the follicular epithelium of the thyroid gland[J].Pathology,2001,197:217 -222.
[5]Xu X,Quiros RM,Gattuso P,et al.High prevalence of BRAF gene mutation in papillary thyroid carcinomas and thyroid tumor cell lines[J].Cancer Res,2003,63:4561 -4567.
[6]Lee JH,Lee ES,Kim YS.Clinicopathologic significance of BRAFV600Emutation in papillary carcinomas of the thyroid:a meta - analysis[J].Cancer,2007,110(1):38 -40.
[7]Rodolico V,Cabibi D,Pizzolanti G,et al.BRAFV600Emutation and p27 kip1 expression in papillary carcinomas of the thyroid ≤1 cm and their paired lymph node metastases[J].Cancer,2007,110(6):1216 -1218.
[8]Motti ML,De Marco C,Califano D,et al.Loss of p27 expression through RAS->BRAF->MAP kinase-dependent pathway in human thyroid carcinomas[J].Cell Cycle,2007,6(22):2817-2825.
[9]Pesutic - Pisac VA,Punda An,Gluncic Iv,et al.Cyclin D1 and p27 expression as prognostic factor in papillary carcinoma of the thyroid:Association with Clinicopathological Parameters[J].Clinical Science,2008,49:643 -649.
