高纯氢氧化铈生产工艺研究
2011-01-22,,
,,
(甘肃稀土新材料股份有限公司技术中心,甘肃白银 730922)
高纯氢氧化铈产品在应用方面对铈的纯度、非稀土杂质含量、硝酸溶解性、氧化率要求较高,因此在原料选用上要选用质量合格的原料,并且在工艺上要寻求一种比较优化的工艺条件,这样才能够稳定持续地生产合格的氢氧化铈。在日趋激烈的市场竞争中,为了使高纯氢氧化铈高质量地走向市场,笔者首先对原料硝酸铈进行了质量把关;其次对原料氨水进行了质量把关,要求MgO质量分数小于5×10-7;最后在工艺上做了探索性实验,找出了影响工艺不稳定的因素,主要是H2O2、NH4OH在加料过程中的流量比控制,以及分解温度和保温时间。为减少Mg2+的共沉淀对产品质量的影响还要控制沉淀终点pH。通过实验并结合生产实际确定了最佳生产条件,在最佳条件下已持续稳定地生产出大批量合格产品,产品合格率达到99.98%。
1 实验部分
1.1 原料
Ce(NO3)3溶液:自产,用结晶Ce(NO3)3溶于水制得,w(CeO2/REO)>99.9%,w(La2O3/REO)<1×10-4,w(Nd2O3/REO)<1×10-4,w(MgO)<1×10-6。工业氨水:自产,浓度为6.5~8.0 mol/L,w(MgO)<5×10-7。工业双氧水:质量分数为30%。
1.2 分析方法
REO分析采用EDTA容量法;CeO2分析采用硫酸亚铁铵容量法;Ce4+分析采用硫酸亚铁铵容量法;非稀土杂质分析采用原子吸收分光光度计法,由甘肃稀土新材料股份有限公司中心化验室分析。
1.3 双氧水氧化反应机理
以硝酸铈液为原料,在室温、搅拌条件下加双氧水氧化Ce,约1 mol双氧水可以使1 mol 三价铈完全氧化为四价铈。在氧化的同时有酸生成,故需加碱控制溶液pH=5~6,才能使Ce4+完全水解析出。反应式如下:

2Ce(OH)3O·OH↓+6NH4NO3+2H2O
反应过程中首先生成胶状红褐色过氧化铈沉淀,加热煮沸则过氧化铈转化为黄色四价氢氧化铈[1]。反应式如下:

1.4 实验方法
量取定量体积的Ce(NO3)3液,配制成质量浓度为80 g/L的溶液。根据其稀土含量加入分散剂[1],搅拌均匀后在室温下加入H2O2氧化,用NH3·H2O作中和剂[2],常温下控制pH=5.5~6.0,搅拌氧化120 min,沉淀完全控制pH=8.5~9.0。将沉淀物升高温度进行分解,分解温度大于92 ℃,保温分解时间大于40 min。加水,停止搅拌,澄清后虹吸上清液并洗涤沉淀物4次,将物料压滤,滤饼烘干即得Ce(OH)4产品。
2 结果与讨论
2.1 H2O2与NH4OH物质的量比对产品氧化率的影响
用双氧水作氧化剂,氨水作中和剂进行氧化。为了达到最佳氧化条件(pH=5.5~6.0),必须控制好二者的加入流量,使氧化反应达到平衡状态。氨水、双氧水的流量不稳定会造成氧化不完全,如果氨水在同时间内流量偏大会在瞬间形成Ce(OH)3沉淀,因此,流量的稳定性对合成Ce(OH)4会有影响。H2O2与NH4OH物质的量比对产品氧化率的影响见图1。其他条件:Ce(NO3)3液质量浓度为80 g/L,氧化时间为120 min,沉淀完全pH=8.5~9.0,分解温度为92 ℃,保温分解时间为40 min,洗涤4次。由图1看出,加入双氧水、氨水的流量不同,对氢氧化铈的氧化率以及酸溶性有一定影响(试验得知,氧化率低于90%的产品硝酸溶解不清亮),控制双氧水与氨水物质的量比为1.20~1.25,所得Ce(OH)4硝酸溶解清亮,氧化率大于97.5%,符合客户对Ce(OH)4产品氧化率大于97%的要求。

图1 H2O2与NH4OH流量比与氧化率的关系
2.2 分解温度对产品氧化率的影响
氧化生成的褐红色的过氧化铈沉淀必须在加热情况下才能够分解成黄色的Ce(OH)4沉淀。分解温度对产品氧化率的影响见图2,其他条件同2.1节。由图2看出,分解时必须达到一定的温度,才能使过氧化物分子间的氢键断裂,使过氧化铈完全分解为Ce(OH)4。温度低于90 ℃,产品分解不完全,导致产品氧化率较低(<94%);温度大于92 ℃,产品氧化率达到98.5%以上。

图2 分解温度与氧化率的关系
2.3 保温分解时间对产品氧化率的影响
图3为保温分解时间对产品氧化率的影响,其他条件同2.1节。由图3看出,分解时必须控制一定的分解时间,才能使过量的双氧水分解完全,达到最佳分解程度。分解时间为30 min,产品氧化率为92%(硝酸溶解不清亮),达不到合格产品要求;分解时间为40min,产品氧化率提高到98%;随着分解时间的继续延长,氧化率变化不大。考虑到生产成本,分解时间控制在40 min。

图3 分解时间与氧化率的关系
2.4 沉淀结束pH对产品中MgO杂质含量的影响
在氧化反应结束时,需要加氨水调节体系pH,使Ce(OH)4沉淀完全(要求上清液中REO质量浓度<0.03 g/L)。在此条件下与稀土离子共存的杂质离子主要是Mg2+,而产品Ce(OH)4对MgO杂质含量的要求是其质量分数小于2.5×10-6。查文献得知,Mg(OH)2开始沉淀pH为9.4。如果调节溶液pH>9会对产品中MgO的含量有影响。为此,对控制pH减少MgO的含量进行了试验,结果见表1,其他条件同2.1节。由表1看出,控制pH为8.5~9.0,所得产品中MgO含量在合格范围,而且对上清液的澄清效果没有影响,上清液中REO含量在要求范围内。说明pH为8.5~9.0,Mg2+没有完全以吸附共沉淀的形式进入沉淀物中,一部分可以通过洗涤除去,与pH>9相比,MgO减少26%左右,这在工艺上是可取的。

表1 沉淀结束pH对产品中MgO杂质含量的影响
2.5 综合最佳条件生产实验
通过单因素实验并结合生产实际选定最佳条件:以结晶硝酸铈为原料,料液质量浓度为80 g/L,加入分散剂,双氧水与氨水物质的量比为1.20~1.25,氧化时间为120 min,沉淀结束调节pH为8.5~9.0;分解温度大于92 ℃,保温分解时间大于40 min;洗涤4次,压滤,烘干。在上述条件下制得氢氧化铈产品质量见表2。生产实验在3 m3反应槽中进行,每批投入REO 115 kg,产出氢氧化铈158 kg左右,稀土收率大于97%,产品质量合格率达到99.98%。
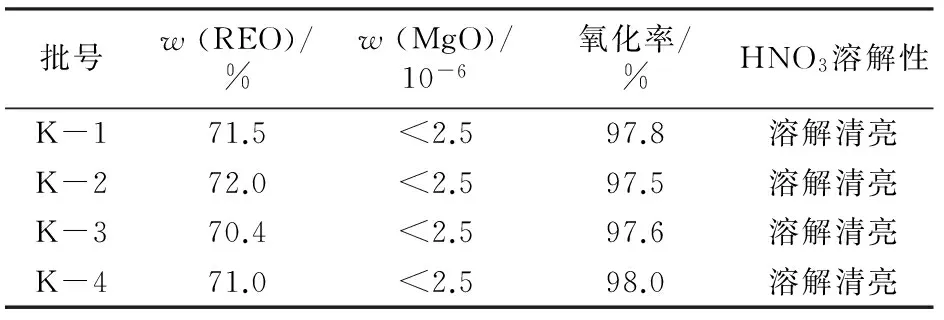
表2 最佳条件制备Ce(OH)4产品质量
3 结论
采用结晶硝酸铈为原料,H2O2为氧化剂,氨水为中和剂,生产高纯氢氧化铈最佳条件:控制双氧水与氨水物质的量比为1.20~1.25(即使体系保持弱酸性条件,pH=5~6),沉淀完全体系pH=8.5~9.0,分解温度大于92 ℃,保温分解时间大于40 min。在此条件下,产出的高纯氢氧化铈产品合格率达到99.98%。
[1] 桑俊利,赵洪,张键,等.氢氧化铝粉体表面化学改性的研究[J].无机盐工业,2005,37(8):15-17.
[2] 刘建华,郝在晨,梁金龙.氢氧化镁阻燃剂的湿法改性研究[J].无机盐工业,2005,37(6):50-51.
