单甲基肼还原Np(Ⅴ)的反应动力学
2011-01-19李小该叶国安唐洪彬蒋德祥
李小该,何 辉,叶国安,唐洪彬,蒋德祥,李 斌
中国原子能科学研究院 放射化学研究所,北京 102413

1 实验
1.1 试剂和仪器
237NpO2,实验室备用。实验用Np(Ⅴ)采用已制备好的Np(Ⅵ)溶液[2]加还原剂MMH还原所得。单甲基肼系实验室合成,经分析其纯度不小于99%,各种浓度的单甲基肼溶液在实验前配制。UO2(NO3)2、HNO3、NaNO3等试剂均为分析纯。
SPECORD S600 UV-vis-nir分光光度计,上海精密仪器厂;CS501型超级恒温水浴槽,上海实验仪器厂。
1.2 实验方法
将一定体积的Np(Ⅵ)溶液和HNO3等溶液定量加入到比色皿中,之后加入预定浓度的MMH溶液,开动电磁搅拌器搅拌均匀,约几分钟后于980.35 nm处定时跟踪Np(Ⅴ)的吸光度。添加的料液中MMH远远过量,而且能迅速将Np(Ⅵ)还原至Np(Ⅴ),对后续Np(Ⅴ)的还原实验并无影响,所得测量结果即为Np(Ⅴ)被MMH还原的动力学过程。
2 数据处理方法
假设反应体系对Np(Ⅴ)为一级反应,则该反应速率方程可表述为:-dc(Np(Ⅴ))/dt=kc(Np(Ⅴ))cm(MMH)cn(H+),体系中控制MMH及H+起始浓度远远大于Np(Ⅴ)起始浓度,则可令:k′=kcm(MMH)cn(H+),速率方程可简写为:-dc(Np(Ⅴ))/dt=k′c(Np(Ⅴ))。
实验数据采用函数拟合法处理,以反应中Np(Ⅴ)吸光度A对反应时间t描点作图,如果假设成立,则所得图像应能很好地与指数衰减函数y=y0+Ae-Kt拟合(试剂空白未扣除),拟合曲线的K值即为反应表观速率常数k′值。
3 结果与讨论
3.1 Np(Ⅴ)-MMH体系对Np(Ⅴ)的反应级数
MMH-Np(Ⅴ)反应在980.3 nm处吸光度A与反应时间t的关系示于图1。由图1可知,A和t之间的关系能很好地与函数y=y0+Ae-Kt拟合,说明上述假设正确,即氧化还原体系对c(Np(Ⅴ))为一级反应。

图1 MMH-Np(Ⅴ)反应在980.3 nm处吸光度与反应时间的关系
3.2 Np(Ⅴ)-MMH体系对MMH和H+的反应级数
表观速率常数k′=kcm(MMH)cn(H+),两边取对数:
lnk′=lnk+mlnc(MMH)+nlnc(H+)
(1)
实验中维持其它条件不变,只改变c(MMH),以lnk′对lnc(MMH)作图,lnk′-lnc(MMH)呈线性关系(图2),所得直线斜率为0.36,即为MMH的反应级数,即m=0.36,这表明Np(Ⅴ)-MMH体系对MMH为0.36级反应。同样,实验中只改变c(H+),以lnk′对lnc(H+)作图(图3),所得直线斜率为1,即n=1,Np(Ⅴ)-MMH体系对H+浓度为一级反应。
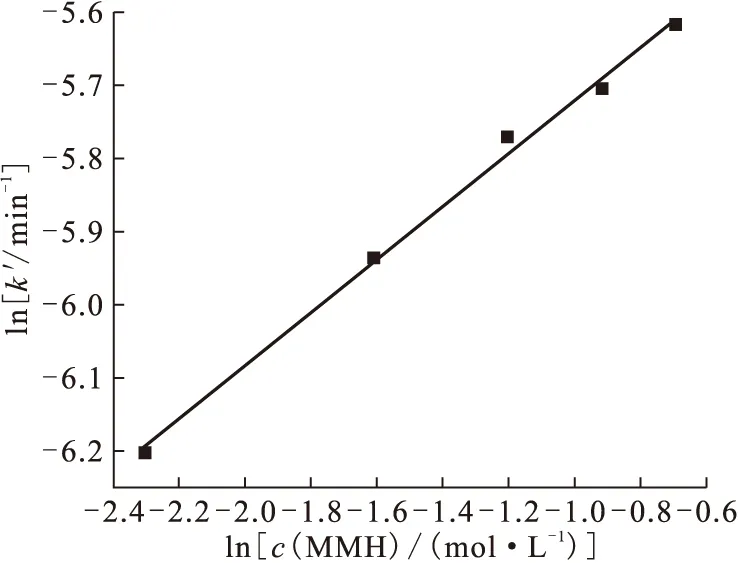
图2 ln k′-ln c(MMH)关系曲线
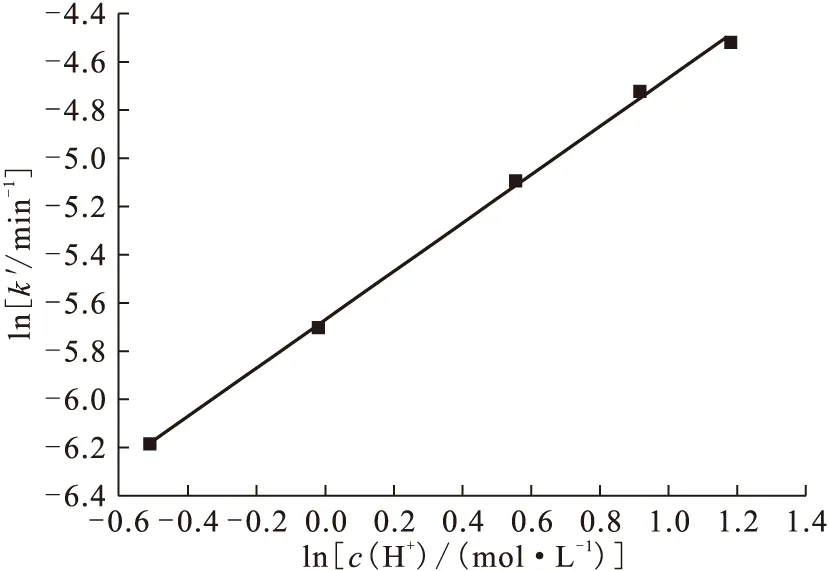
图3 ln k′-ln c(H+)关系曲线
综上所述,MMH还原Np(Ⅴ)的动力学速率方程可表示为:
-dc(Np(Ⅴ))/dt=
kc(Np(Ⅴ))c0.36(MMH)c(H+)
(2)
在温度θ=35 ℃、离子强度为2 mol/L时,速率常数k=0.004 79 (mol/L)-1.36/min。Np(Ⅴ)-MMH反应速率常数列入表1。
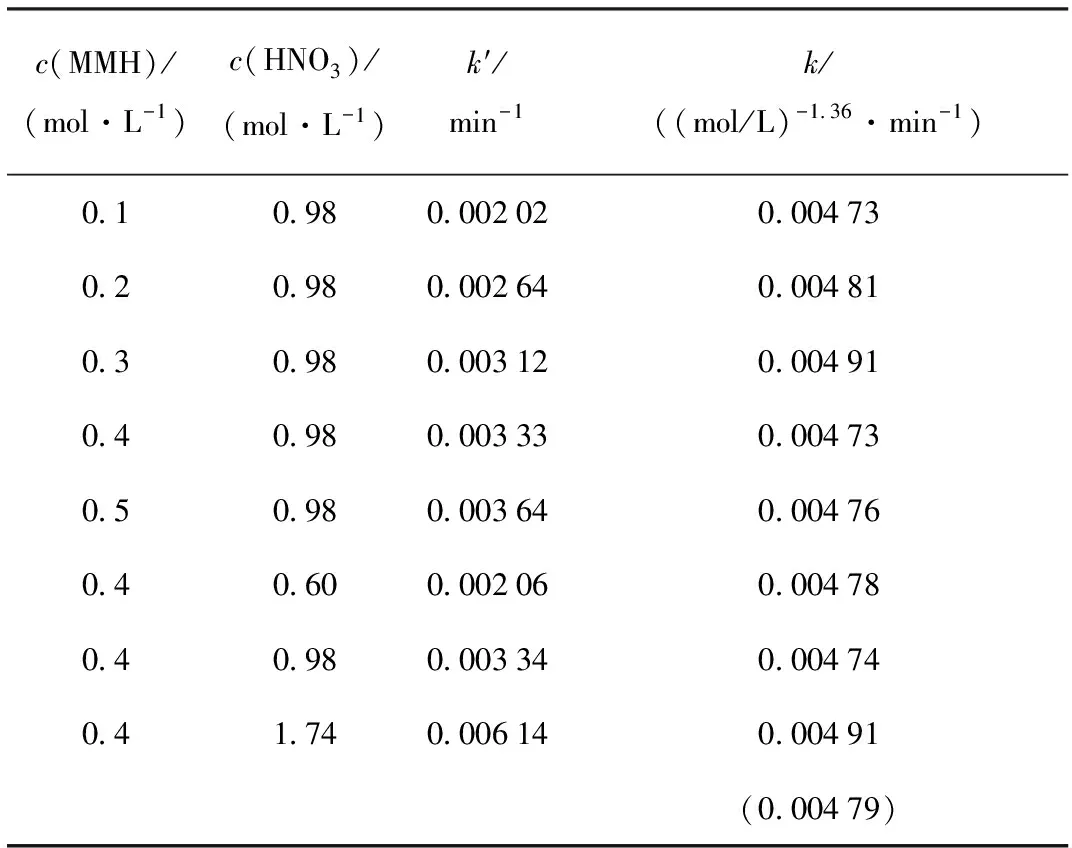
表1 Np(Ⅴ)-MMH反应速率常数
注(Notes):θ=35 ℃,I=2 mol/L;括号内数据为平均值(The datum in parentheses is average value)
3.3 离子强度对反应的影响
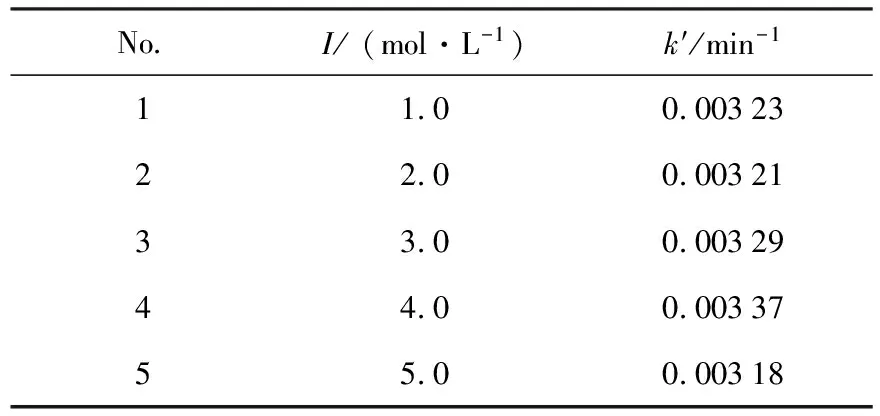
表2 不同离子强度下Np(Ⅴ)-MMH反应的表观速率常数
3.4 U(Ⅵ)浓度对反应的影响
Purex流程中镎、钚与铀的分离是在U(Ⅵ)大量存在条件下进行,因此必须考虑U(Ⅵ)浓度对MMH还原Np(Ⅴ)反应的影响。在c(HNO3)=0.98 mol/L、c(MMH)=0.4 mol/L、I=4 mol/L的条件下,研究c(U(Ⅵ))对Np(Ⅴ)还原反应的影响,结果列入表3。由表3可知,c(U(Ⅵ))在0~0.69 mol/L范围内k′值无明显变化,说明c(U(Ⅵ))在考察的浓度范围内对氧化还原反应无明显影响。
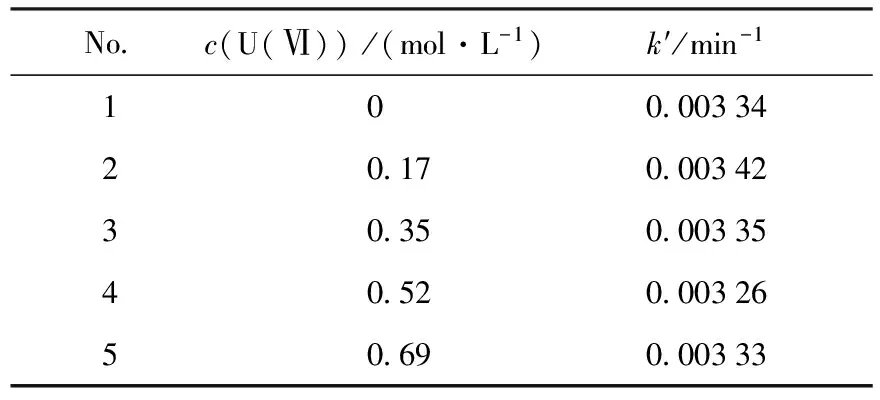
表3 不同c(U(Ⅵ))下Np(Ⅴ)-MMH反应的表观速率常数
3.5 温度对反应的影响
实验中维持其他条件不变,改变溶液的反应温度,在25~65 ℃范围内研究温度对反应的影响,结果示于图4。由图4可知,随着温度的升高,反应速率加快。根据Arrhenius方程,求得反应的活化能为60.43 kJ/mol。
3.6 不同还原剂还原Np(Ⅴ)动力学参数比较
表4列举了不同还原剂还原Np(Ⅴ)的反应动力学情况。Fe2+、U(Ⅳ)在常温下即能较迅速地还原Np(Ⅴ);肼衍生物还原Np(Ⅴ)的速率较慢,与Fe2+、U(Ⅳ)相比几乎可忽略。
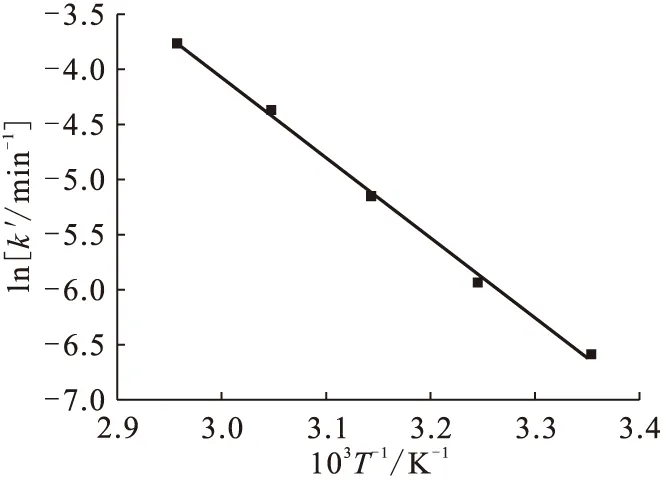
图4 温度对Np(Ⅴ)-MMH反应的影响

表4 不同还原剂还原Np(Ⅴ)的动力学参数
注(Note):*为HClO4体系,其余均为HNO3体系(* is HClO4system, the others are HNO3system)
4 Np(Ⅴ)-MMH反应机理探讨
(3)
(4)
(5)
(6)
(7)

(8)
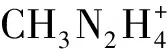
(9)
式(5)中间活化络合物的形成过程,其平衡过程可表示如下:
(10)
(11)
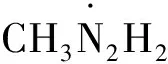
(12)
(13)
(14)
式(6)涉及到单电子在不同离子间的转移以及Np-O键的断裂过程,生成中间产物NpO2+,速度较慢,为反应的速率控制步骤,这也与前面的离子强度对反应速率的影响[8]实验结果相吻合,进一步说明了络合物内部单电子转移为该反应速率控制步骤的可信度。
-dc(Np(Ⅴ))/dt=
代入Kh、K1、K2的表达式可得:
-dc(Np(Ⅴ))/dt=
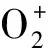
(15)
式中,k=k1KhK1K2。式(15)与式(2) 的动力学速率方程表达式形式基本一致,说明所假设反应机理正确。
与MMH还原Np(Ⅵ)的速率方程[1]:-dc(Np(Ⅵ))/dt=kc(Np(Ⅵ))c(MMH)/c(HNO3)、k=61.3 min-1(θ=24 ℃)相比,MMH还原Np(Ⅴ)的速率很慢,可忽略不计。因此采用Np(Ⅵ)做起始料液,来考察MMH还原Np(Ⅴ)反应动力学情况完全可行,而且可避免在制备Np(Ⅴ)时所带来的其它杂质离子的干扰。
5 结 论
(1) 本实验条件下,MMH还原Np(Ⅴ)反应动力学方程为:
-dc(Np(Ⅴ))/dt=
kc(Np(Ⅴ))c0.36(MMH)c(H+)
在温度θ=35 ℃、离子强度I=2 mol/L时,速率常数k=0.004 79 (mol/L)-1.36/min。该体系下反应速率很慢,与相同条件下MMH还原Np(Ⅵ)的速率相比,可忽略不计;也远慢于常温下Fe2+、U(Ⅳ)还原Np(Ⅴ)的反应速率。
(2) 在离子强度I=1.0~5.0 mol/L、c(U(Ⅵ))=0~0.69 mol/L范围内k′值无明显变化。温度升高,反应速率加快,相应的活化能为60.43 kJ/moL。
(3) 根据MMH还原Np(Ⅴ)的动力学速率方程,推测实验条件下MMH还原Np(Ⅴ)为络合物内部单电子转移的反应机理。
[1] 张先业,叶国安.单甲基肼还原Np(Ⅵ)Ⅰ.反应动力学研究[J].原子能科学技术,1997,31(3):193-198.
[2] 张安运.N,N-二乙基羟胺与Np(Ⅵ)和Pu(Ⅳ)氧化还原反应动力学和反应机理的研究[D].北京:中国原子能科学研究院,1998.
[3] Bond Y, Peterson J R.The Oxidation-Reduction Kinetics Involved in the Np(Ⅴ)+ Fe(Ⅱ) Np(Ⅳ)+Fe(Ⅲ) System in Nitric Acid Solutions[J].J Inorg Nucl Chem, 1977, 64(3): 193.
[4] Shastri N K, Amis A E, Wear J.Kinetics of the Reactions Between Four Valent Uranium and the Various Valence State of Neptunium[J].J Inorg Nucl Chem, 1965, 5(1): 67.
[5] Koltunov V S, Baranov S M, Koltunov G V.Kinetics of Reaction of Np and Pu Ions With Hydrazine Derivatives:Ⅹ Ⅷ.Reaction Between Np(Ⅴ) and Hydroxyethylhydrazine[J].Radiochem, 2005, 47(2): 168-172.
[6] Koltunov V S, Baranov S M, Tikhonov M F.Kine-tics of Reaction of Np and Pu Ions With Hydrazine Derivatives:Ⅹ Ⅶ.Reaction Between Np(Ⅴ) and Phenylhydrazine[J].Radiochem, 2002, 44(3): 248-252.
[7] 李亚东.镎离子在酸性溶液中的氧化还原过程[J].核科学与工程,1994,14(2):184-186.
[8] 邱体孝,刘锡兰.离子强度对配合物间电子转移反应速度的影响[J].四川师范学院学报,1989,10(1):44-47.
