JNK在棕榈酸致骨骼肌细胞胰岛素抵抗中的作用*
2011-01-16牛文彦
高 静 王 慧 牛文彦
JNK在棕榈酸致骨骼肌细胞胰岛素抵抗中的作用*
高 静 王 慧 牛文彦△
目的:探讨棕榈酸造成L6GLUT4myc骨骼肌细胞胰岛素抵抗过程中c-Jun N-末端激酶(JNK)所起的作用。方法:将L6GLUT4myc成肌细胞培养于24孔和6孔培养板中,随机分为溶剂组和棕榈酸组,分别用0.3 mmol/L的棕榈酸盐和溶剂牛血清白蛋白(BSA)孵育16 h,在棕榈酸组的后30 min加入JNK的抑制剂,于胰岛素刺激前后用酶联免疫吸附测定(ELISA)细胞膜上GLUT4myc的含量,免疫印迹法测定蛋白激酶B(Akt)、JNK和胰岛素受体底物1(IRS1)的磷酸化。结果与溶剂组相比,棕榈酸组中胰岛素增加的GLUT4myc水平的倍数和Akt的磷酸化降低(P<0.05);JNK和IRS1的丝氨酸位点S307的磷酸化水平变化差异无统计学意义(P>0.05)。结论棕榈酸导致L6骨骼肌细胞胰岛素抵抗的机制可能不涉及JNK,或JNK的作用很小。
棕榈酸 肌,骨骼 葡萄糖转运体4型 胰岛素 胰岛素抗药性 JNK丝裂原活化蛋白激酶类 蛋白激酶类
棕榈酸是游离脂肪酸中最主要的饱和脂肪酸,其造成骨骼肌胰岛素抵抗的机制尚不明确。在骨骼肌中,胰岛素刺激的葡萄糖摄取主要由位于细胞膜上的葡萄糖转运子4(glucose transporter 4,GLUT4)转运。其信号机制为胰岛素与其受体结合,磷酸化胰岛素受体底物1(IRS1)的酪氨酸位点,进而激活磷脂酰肌醇3激酶(PI3K),激活蛋白激酶B(Akt),最终传递信号到GLUT4[1]。c-Jun N-末端激酶(JNK)可磷酸化IRS1的丝氨酸位点S307,从而抑制IRS1的酪氨酸磷酸化,参与造成胰岛素抵抗的机制。本研究通过检测细胞膜上的GLUT4myc和Akt、JNK和IRS1的磷酸化水平,探讨JNK在棕榈酸造成骨骼肌胰岛素抵抗机制中的作用。
1 材料与方法
1.1材料 L6大鼠骨骼肌细胞株(L6GLUT4myc)由加拿大Amira Klip教授提供。Hanks液、α-MEM(天润善达公司),胎牛血清、胰酶(以色列Bioind公司),胰岛素(加拿大Eli Lilly公司),Sodium Palmitate和抗myc表位抗体(美国Sigma公司),不含脂肪酸的牛血清白蛋白(BSA,瑞士Roche公司),山羊血清(加拿大Wisent公司),抗磷酸化Akt和JNK抗体(美国Cell Sig⁃naling公司)。偶联辣根过氧化物酶(HRP)的山羊抗兔抗体、驴抗鼠IgM抗体(美国Jackson Immuno Research公司),增强化学发光底物检测试剂盒(美国Millipore公司)。
1.2方法
1.2.1细胞培养 用含10%胎牛血清的α-MEM培养基,于37℃,5%CO2条件下培养L6GLUT4myc成肌细胞,将接种在24孔和6孔培养板中的细胞用含1%胎牛血清的培养基分化为多核肌管,隔天换液,接种后第6天用于实验。
1.2.2细胞膜GLUT4myc的测定 将24孔板的细胞随机分为溶剂组和棕榈酸组,分别加入600 μL 0.9%的BSA和0.3 mmol/L的棕榈酸预孵育16 h。溶剂组分为胰岛素亚组和基础亚组;棕榈酸组分为胰岛素亚组、胰岛素+抑制剂(JNK的抑制剂SP600125,10 μmol/L)亚组和基础亚组,每亚组设有3个平行的复孔。2组中胰岛素亚组各加入胰岛素,使其最终浓度达到100 nmol/L,基础组不加胰岛素。处理细胞后,用酶联免疫吸附(ELISA)测定细胞膜上的GLUT4myc。多聚甲醛固定,甘氨酸淬灭,体积分数为5%(V/V)的山羊血清封闭后,用抗myc表位抗体室温孵育1 h;用HRP的山羊抗兔IgG室温孵育1 h;加入底物邻苯二胺溶液,反应约20 min后终止,用酶标仪测定上清液492 nm的吸光度值,重复4次。增加的细胞表面GLUT4myc水平=胰岛素组吸光度值/基础组的吸光度值。
1.2.3Akt、JNK和IRS1的磷酸化检测 在6孔板上,将细胞分为溶剂组和棕榈酸组,每组2孔。分别用溶剂BSA和0.3 mmol/L的棕榈酸预孵育16 h。各组的其中1孔加入1 mL,100 nmol/L胰岛素,另1孔不加胰岛素作为基础组。处理细胞后,裂解细胞,65℃加热15 min,于体积分数为7.5%(V/V)SDS-PAGE进行电泳,免疫印迹检测Akt、JNK和IRS1的磷酸化水平,一抗用各自的磷酸化抗体,二抗用偶联HRP的山羊抗兔抗体,以Actin1作为内参,增强化学发光底物试剂盒检测,曝光,重复4次。用Image J软件处理,各蛋白的磷酸化水平增高倍数=胰岛素组灰度值/基础组的灰度值。
1.3统计学方法 采用SPSS 11.5统计软件包进行统计学分析 对符合正态分布的正态计量资料以均数±标准差表示,两组均数间的差异用t检验比较,用单因素方差分析比较多组均数间的差异,进一步两两比较采用LSD-t检验法,以P<0.05为差异有统计学意义。
2结果
2.1各组胰岛素增加的GLUT4myc水平的比较 与溶剂组相比,棕榈酸组胰岛素刺激后细胞膜上增加的GLUT4myc的水平显著降低(P<0.01),但抑制剂JNK没有逆转此现象,见表1。
2.2棕榈酸对Akt、JNK和IRS1磷酸化的影响 溶剂组中的胰岛素刺激后Akt磷酸化水平增高倍数较棕榈酸组比较差异有统计学意义(P<0.01),见表2、图1;而2组中胰岛素刺激后JNK和IRS1的磷酸化水平增高比较差异无统计学意义(均P>0.05),见表2,图2、3。
表1 各组中胰岛素增加细胞表面GLUT4myc水平的比较 (n=12,倍
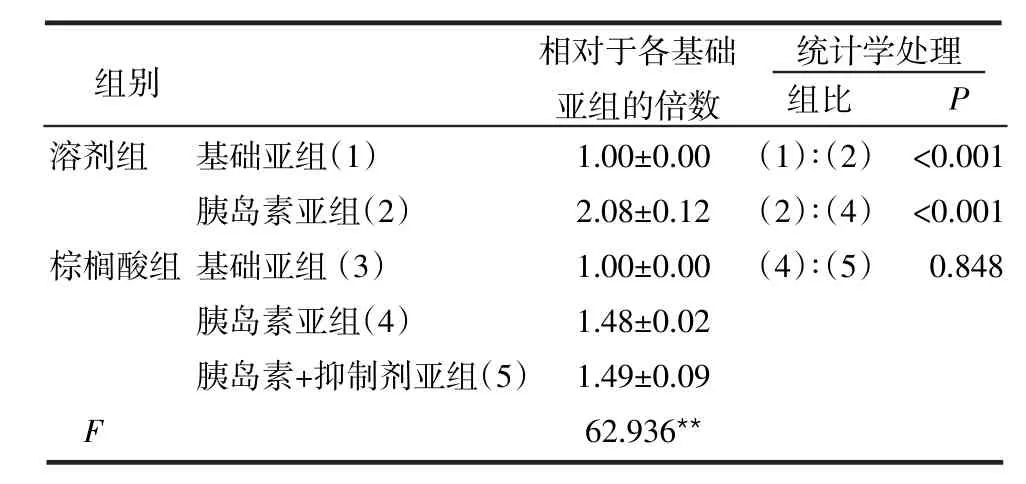
表1 各组中胰岛素增加细胞表面GLUT4myc水平的比较 (n=12,倍
**P<0.01
组别 相对于各基础亚组的倍数统计学处理组比 P溶剂组棕榈酸组F基础亚组(1)胰岛素亚组(2)基础亚组(3)胰岛素亚组(4)胰岛素+抑制剂亚组(5)1.00±0.00 2.08±0.12 1.00±0.00 1.48±0.02 1.49±0.09 62.936**(1)∶(2)(2)∶(4)(4)∶(5)<0.001<0.001 0.848
表2 2组中Akt、JNK和IRS1磷酸化水平增高倍数的比较 (倍

表2 2组中Akt、JNK和IRS1磷酸化水平增高倍数的比较 (倍
**P<0.01
组别 n Akt JNK IRS1溶剂组棕榈酸组t 44 9.60±1.87 5.29±0.98 4.08**3.11±0.52 2.82±0.46 0.84 2.36±0.24 2.13±0.05 1.87

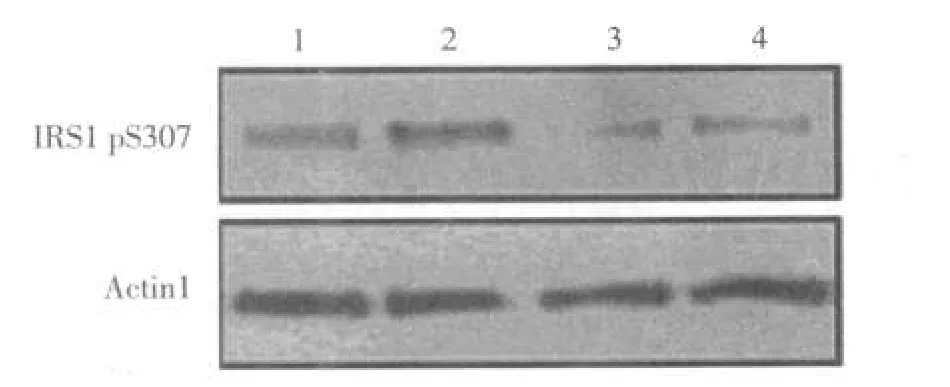
图3棕榈酸对L6GLUT4myc细胞IRS1磷酸化的影响
3 讨论
肥胖是导致糖尿病的重要危险因素,肥胖的脂肪组织分泌过多的脂肪酸,其中饱和脂肪酸棕榈酸可影响胰岛素调节骨骼肌摄取葡萄糖的作用[2-3]。本研究应用L6GLUT4myc骨骼肌细胞株,检测棕榈酸盐直接孵育对胰岛素调节GLUT4myc转位和Akt磷酸化的影响,并进一步分析了JNK在此机制中的作用。
本研究结果显示棕榈酸抑制胰岛素刺激的Akt磷酸化和GLUT4myc转位,表明棕榈酸削弱胰岛素信号。但JNK是否参与棕榈酸造成的胰岛素抵抗,其探求机制就是否涉及棕榈酰辅酶A尚存争议。棕榈酸首先生成棕榈酰辅酶A,其主要在丝氨酸棕榈酰转移酶(SPT)的作用下生成神经酰胺,并可生成少量的其他代谢产物,如二酰甘油(DAG)。SPT是生成神经酰胺的限速酶,用小RNA干扰方法抑制SPT的合成,则神经酰胺的合成量减少,DAG的合成量相应增多。增多的DAG会激活受其调节的PKC,进而激活JNK而间接增加IRS1的丝氨酸位点S307的磷酸化[4]。本研究结果显示,棕榈酸并不影响JNK和IRS1的丝氨酸位点S307的磷酸化,提示JNK可能不参与棕榈酸造成的胰岛素抵抗。但也可能是JNK参与此机制,而由于棕榈酸主要生成神经酰胺,DAG的合成量较少,因此JNK的作用较难检测。有报道用神经酰胺孵育L6细胞,发现IRS1的酪氨酸磷酸化水平没有降低,PI3K的活性也没有变化,但却降低了胰岛素增加的GLUT4的水平和葡萄糖摄取,造成胰岛素抵抗[5],表明神经酰胺并没有通过IRS1和PI3K这2个胰岛素上游信号分子造成胰岛素抵抗,与本研究结果一致。神经酰胺抑制胰岛素诱导的Rac的激活以及肌动蛋白(Actin)的重塑,同时抑制Akt的磷酸化[5]。Akt激活的一个关键步骤是其转位到质膜上,神经酰胺会通过PKCζ抑制此作用[2]。这些与本研究显示的棕榈酸抑制胰岛素刺激的Akt磷酸化结果相符。综上,棕榈酸主要生成神经酰胺,调节GLUT4转位,检测棕榈酸对胰岛素调节的Actin重塑的影响,可进一步验证JNK的作用。
[1] Jové M,Planavila A,Laguna JC,et al.Palmitate-induced interleu⁃kin 6 production is mediated by protein kinase C and nuclear-fac⁃tor kappaB activation and leads to glucose transporter 4 down-regu⁃lation in skeletal muscle cells[J].Endocrinology,2005,146(7):3087-3095.
[2] Powell DJ,Turban S,Gray A,et al.Intracellular ceramide synthesis and protein kinase Czeta activation play an essential role in palmi⁃tate-induced insulin resistance in rat L6 skeletal muscle cells[J].Biochem J,2004,382(Pt2):619-629.
[3] Dimopoulos N,Watson M,Sakamoto K,et al.Differential effects of palmitate and palmitoleate on insulin action and glucose utilization in rat L6 skeletal muscle cells[J].Biochem J,2006,399(3):473-481.
[4] Watson ML,Coghlan M,Hundal HS.Modulating serine palmitoyl transferase(SPT)expression and activity unveils a crucial role in lipid-induced insulin resistance in rat skeletal muscle cells[J].Bio⁃chem J,2009,417(3):791-801.
[5] JeBailey L,Wanono O,Niu W,et al.Ceramide-and oxidant-in⁃duced insulin resistance involve loss of insulin-dependent Rac-ac⁃tivation and actin remodeling in muscle cells[J].Diabetes,2007,56(2):394-403.
The Role of JNK in the Palmitate-Induced Insulin Resistance in Skeletal Muscle Cells
GAO Jing,WANG Hui,NIU Wenyan
Department of Immunology,Tianjin Medical University,Tianjin 300070,China
Objective:To study the role of c-jun N-terminal kinase(JNK)in the mechanism of palmitate-induced insu⁃lin resistance in L6GLUT4myc skeletal muscle cells.Methods:L6GLUT4myc myoblasts were incubated in 24 and 6 wells plates and divided into two groups,and treated with 0.3 mmol/L palmitate or solvent BSA for 16 h,respectively.JNK inhibi⁃tor was added to the medium during the last 30 min incubation with palmitate or BSA.The amount of GLUT4myc on the cell surface was measured by enzyme linked immunosorbent assay(ELISA)and the phosphorylation of protein kinase B(Akt).JNK and insulin receptor substrate1(IRS1)were measured by immunoblotting in the absence or presence of insulin respec⁃tively.Results:Compared to the solvent group,insulin-stimulated GLUT4myc translocation and phosphorylation of Akt de⁃creased in palmitate group(P<0.05).There was no significant difference in the phosphorylation of JNK and IRS1 pS307.Conclusion:Palmitate causes insulin resistance in L6 muscle cells,and JNK may not be involved in its mechanism.
palmitic acid muscle,skeletal glucose transporter type 4 insulin insulin resistance JNK mito⁃gen-activated protein kinases protein kinases
*国家自然科学基金资助项目(项目编号:30570912);国家自然科学基金委员会-加拿大卫生研究院健康研究合作计划项目(项目编号:30611120532);天津市科委科技支撑计划项目(项目编号:09ZCZDSF04500)
300070 天津医科大学免疫教研室
△通讯作者 E-mail:wniu@tijmu.edu.cn
(2010-09-28收稿 2010-11-15修回)
(本文编辑 魏杰)
