阿司匹林通过转化生长因子-β1途径抑制人脐动脉平滑肌增殖的实验研究
2011-01-16黄体钢李广平周丽娟刘红梅
王 林 黄体钢 李广平 曹 路 周丽娟 刘红梅 甄 琴
阿司匹林通过转化生长因子-β1途径抑制人脐动脉平滑肌增殖的实验研究
王 林 黄体钢 李广平 曹 路 周丽娟 刘红梅 甄 琴
目的:探讨阿司匹林对人脐动脉平滑肌细胞(HUASMCs)增殖的影响及转化生长因子(TGF)-β1信号途径在其中可能发挥的作用。方法利用HUASMCs进行体外培养;通过MTT法观察不同浓度阿司匹林(0.5、1.0、2.0及5.0 mmol/L)以及加入TGF-β1中和抗体后对细胞增殖(OD值)的影响;采用流式细胞技术检测阿司匹林(2.0 mmol/L)以及加入TGF-β1中和抗体后对细胞周期的影响。结果不同浓度阿司匹林(0.5、1.0、2.0及5.0 mmol/L)及加入TGF-β1中和抗体培养HUASMC细胞后,其数量(OD值)组间、时间效应差异均有统计学意义(P<0.05),且组间与时间效应间存在交互作用(P<0.05)。阿司匹林(2.0 mmol/L)可使HUASMCs的增殖阻滞在G0/G1期(P<0.05),TGF-β1中和抗体可使A2.0组的细胞G0/G1期减少,S期增多(P<0.05)。结论阿司匹林可使HUASMCs的增殖阻滞于G0期从而抑制HUASMCs增殖,这种抑制作用可能在一定程度上是通过TGF-β1信号途径所介导的。
脐动脉 肌,平滑,血管 细胞增殖 细胞周期 阿司匹林 体外研究 转化生长因子β1
近年来阿司匹林作为经典的治疗冠心病的药物,越来越受到重视,研究认为其可能通过作用于血管壁带来“额外”的益处,且对于治疗和预防粥样硬化晚期并发症有一定意义,但机制尚不明确[1-2]。除通过抑制环氧化酶发挥抗血小板的聚集作用外,阿司匹林还可以通过抑制增生、对抗血管炎症反应等途径来增加斑块的稳定性[3]。此前研究认为阿司匹林的抑制作用是通过转化生长因子β1(TGF-β1)及其信号传导途径来实现的[3]。本研究旨在通过体外培养,观察阿司匹林通过TGF-β1途径对人脐动脉平滑肌细胞(HUASMCs)增殖的影响,从而对该药物在临床治疗方面的潜在机制进行初步的探讨。
1 材料与方法
1.1材料 HUASMCs来源:选取产后新鲜脐带,无菌条件下分离动脉,采用植块法进行原代培养获得。一次性培养瓶、培养皿及细胞培养板(Corning公司),FACSVantage SE™多色分析和高速分选流式细胞仪(美国BD Bioscience公司),Multiskan MK3酶标仪(ThermoLabsystems公司),TLLC台式高速低温离心机(北京四环科学仪器厂);RPMI 1640培养液(含碳酸氢钠、HEPES、L-谷氨酰胺,GIBCO BRL公司),胎牛血清、人AB血清及0.25%胰蛋白酶消化液(HQ®TRYPSIN,Hyclone公司),阿司匹林原粉、血小板源性生长因子(PDGF)、MTT及二甲基亚砜(DMSO)购自Sigma公司,0.01 mol/L PBS(Solarbio公司);Cycle TestTMPlus DM 细胞周期检测试剂盒(BD Bioscience公司)。鼠抗人TGF-β1中和抗体(TGF-β1 Ab,Abazyme公司),乳酸脱氢酶检测试剂盒(北京中生公司)。
1.2分组 对HUASMCs进行原代培养并应用免疫组织化学法鉴定VSMC内的α-actin蛋白;MTT比色法测定细胞增殖活力[3-4]。在PDGF(10 μg/L)的作用下,向含不同浓度0.5、1.0、2.0及5.0 mmol/L阿司匹林的培养液中加入TGF-β1 Ab(50 mg/L)成为以下几个观察组:C组为空白对照组,仅加入无血清 RPMI 1640培养液;P 组为仅加入 PDGF(10 μg/L);A0.5、A1.0、A2.0、A5.0组为加入PDGF(10 μg/L)及阿司匹林浓度分别为0.5、1.0、2.0、5.0 mmol/L;C+Ab组为加入无血清RPMI 1640培养液和TGF-β1 Ab(50 mg/L);P+Ab组为加入PDGF(10 μg/L)+TGF-β1 Ab(50 mg/L);A0.5+Ab、A1.0+Ab、A2.0+Ab、A5.0+Ab组分别为加入PDGF(10 μg/L)+TGF-β1 Ab(50 mg/L)及阿司匹林浓度分别为0.5、1.0、2.0、5.0 mmol/L,每组重复4孔。
1.3实验方法 (1)接种细胞:取对数生长期的HUASMCs细胞,用0.25%胰蛋白酶消化单层培养的平滑肌细胞,用含10%胎牛血清+10%人AB血清的RPMI 1640培养液配制成单个细胞悬液,以每孔10 000个细胞接种于96孔细胞培养板中,每孔体积200 μL。(2)培养细胞:将培养板放入CO2恒温培养箱,在37 ℃、5%CO2及饱和湿度条件下,培养1~6 d。(3)呈色:分别在培养第1、3、6天,每孔加入0.5%MTT溶液20 μL,37℃继续培养4 h,终止培养,小心吸弃孔内培养上清液,每孔加入200 μL DMSO,振荡10 min,使甲臢充分溶解。(4)比色:选择490 nm波长,在用酶联免疫检测仪测定各孔光密度值(OD值),记录结果。以时间为横轴,OD值为纵轴绘制生长曲线。各组各个时间点所取得是同批的孔,且各浓度OD值在96孔板中同一浓度重复4孔取平均值。
1.4HUASMC细胞周期检测 采用流式细胞技术[4]取上述C组、C+Ab组、A2.0组、A2.0+Ab组进行观察。将阿司匹林(2.0 mmol/L)与对数生长期的HUASMC细胞作用24 h后,PBS冲洗,0.25%胰酶消化收集制成密度为1×106/mL的单细胞悬液,加入4℃预冷的70%乙醇,混匀,4℃保存,上流式细胞仪进行细胞周期分析。
1.5细胞毒性检测 采用乳酸脱氢酶法[4]:常规消化细胞,离心后把细胞调成104/mL,接种于24孔板,每孔l mL,共24孔,细胞贴壁后,按照上述分组方式,分别加入与C组和A5.0组相同的处理因素。培养24 h后,取上清液,用生化比色法检测血清中活性乳酸脱氢酶(LDH)。
1.6统计学方法 采用SPSS 17.0软件进行统计分析。符合正态性分布的计量资料用x ±s表示,多样本均数比较采用单因素方差分析和重复测量资料的方差分析,进一步组间比较选用SNK-q检验,以P<0.05为差异有统计学意义。
2 结果
2.1细胞培养结果 原代培养5~12 d,相差倒置显微镜下可见有梭形细胞从组织块边缘长出,以后细胞增殖,纵行排列向外生长延伸,2~3周出现致密的细胞层可长满瓶底。细胞经α-actin免疫组织化学鉴定,显微镜下可见细胞的胞浆为橙黄色,呈阳性结果,表明培养细胞是平滑肌细胞。传代培养4~7代,细胞长满瓶底时,表现为收缩型(分化型),可见平滑肌细胞呈梭形,平行生长,束状排列,密集与稀疏处相互交错呈“峰谷”状,选取4~7代细胞用于本研究。
2.2阿司匹林及TGF-β1 Ab对HUASMC增殖的影响 不同浓度阿司匹林(0.5、l.0、2.0及5.0 mmol/L)培养HUASMC细胞数量(OD值)组间、时间效应差异均有统计学意义(P<0.05),且组间与时间效应间存在交互作用(P<0.05),见表1。
表1 阿司匹林及TGF-β1 Ab对HUASMC增殖的影响(OD值,n=4,

表1 阿司匹林及TGF-β1 Ab对HUASMC增殖的影响(OD值,n=4,
=5.287=1 235.408=2.307,均P<0.05
C组P组A0.5组A1.0组A2.0组A5.0组C+Ab组P+Ab组A0.5+Ab组A1.0+Ab组A2.0+Ab组A5.0+Ab组0.278±0.021 0.282±0.052 0.279±0.021 0.275±0.042 0.277±0.046 0.273±0.042 0.283±0.019 0.300±0.033 0.270±0.028 0.274±0.032 0.273±0.033 0.267±0.040 0.410±0.053 0.462±0.062 0.430±0.050 0.428±0.063 0.398±0.052 0.377±0.045 0.459±0.018 0.464±0.036 0.457±0.035 0.452±0.038 0.448±0.046 0.435±0.061 0.675±0.051 0.765±0.061 0.656±0.046 0.645±0.039 0.630±0.046 0.563±0.036 0.737±0.043 0.780±0.065 0.706±0.033 0.701±0.030 0.699±0.031 0.697±0.057组别1 d 3 d 6 d
2.3阿司匹林对HUASMCs细胞周期作用的影响 A2.0组G0/G1期细胞百分率较C组有所增加,A2.0+Ab组G0/G1期细胞百分率较A2.0组有所减低,但仍高于C组,差异均有统计学意义(P<0.05);A2.0组的S期细胞百分率低于C组,A2.0+Ab组S期细胞百分率较A2.0组有所增加,但仍低于C组,差异均有统计学意义(P<0.05),见表2。
表2 阿司匹林(2.0 mmol/L)及TGF-β1 Ab对HUASMCs细胞周期的影响
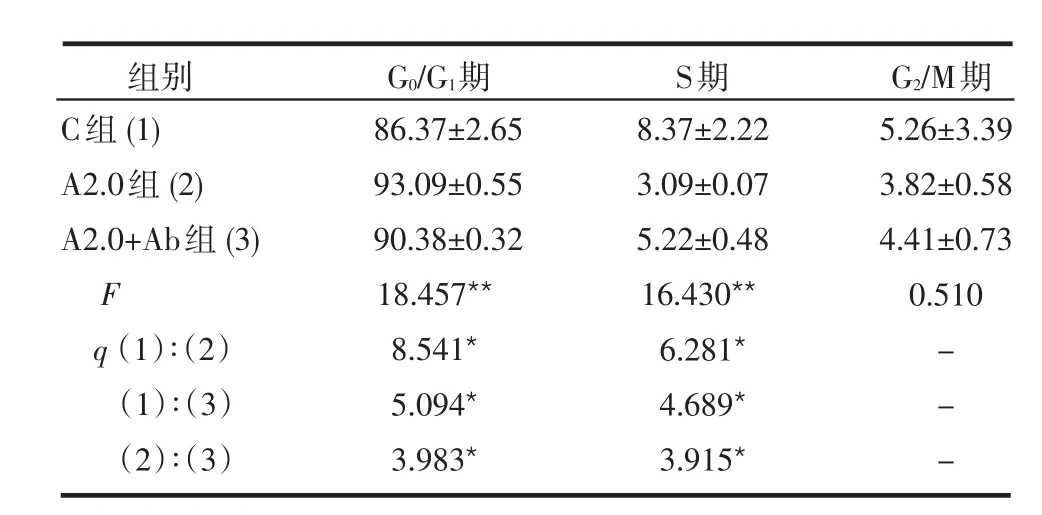
表2 阿司匹林(2.0 mmol/L)及TGF-β1 Ab对HUASMCs细胞周期的影响
*P<0.05,**P<0.01
组别 G0/G1期 S期 G2/M期C组(1)A2.0组(2)A2.0+Ab组(3)F q(1)∶(2)(1)∶(3)(2)∶(3)86.37±2.65 93.09±0.55 90.38±0.32 18.457**8.541*5.094*3.983*8.37±2.22 3.09±0.07 5.22±0.48 16.430**6.281*4.689*3.915*5.26±3.39 3.82±0.58 4.41±0.73 0.510---
2.4乳酸脱氢酶法检测细胞毒性 在阿司匹林(5.0 mmol/L)作用下,HUASMCs释放LDH-C水平与对照组比较差异无统计学意义[(51.6±6.62)IU/L vs(54.8±4.69)IU/L,t=0.789,P>0.05)]。
3 讨论
TGF-β是一类多功能的细胞因子,在维持动脉粥样硬化斑块稳定性方面发挥重要的作用[5];体内研究证实激活TGF-β信号传导途径可能为粥样硬化病变治疗提供新的靶点[6]。自20世纪70年代发现阿司匹林具有抑制前列腺素合成作用以来,其临床用途不断增多,特别是在心脑血管疾病的防治方面可明显减少急性心肌梗死后近期和远期的病死率,以及再梗死的发生率[7]。而这些临床效果己不能单纯地用抗血小板聚集的作用来解释。研究表明,小剂量阿司匹林在不影响前列环素(PGI2)的情况下能通过降低炎症因子的水平,改善血管炎症反应状态及斑块的组成使其更加稳定;而大剂量阿司匹林则可通过影响细胞周期来抑制血管平滑肌的增殖[8]。本研究结果显示,阿司匹林可导致细胞增殖抑制,与相关研究[8-9]结果相近。LDH检测未发现阿司匹林增加细胞毒性,表明这种抗增殖作用不是由于药物的细胞毒性所引起的。该抑制效应在阿司匹林作用第6天最为明显,且可被TGF-β1 Ab所逆转。通过流式细胞技术发现阿司匹林(2 mmol/L)可使G0/G1期的细胞百分率增多,S期的细胞百分率减少,而G2/M期的细胞百分率无显著变化,表明阿司匹林是通过对G0/G1期的阻滞而抑制VSMC的增殖,与上述研究结果[3,8-9]一致。此外,本研究结果显示在加入TGF-β1 Ab后,G0/G1期比例下降,而S期比例上升,减弱了阿司匹林对G0/G1期的阻滞作用,提示TGF-β1及其下游信号途径可能参与了阿司匹林抑制细胞增殖的作用。近年来人们对于阿司匹林抑制VSMCs增殖的多种作用机制进行了探索[3-7],结合本实验研究结果,笔者认为阿司匹林可使HUASMCs的增殖阻滞于G0期从而抑制HUASMCs增殖,这种抑制作用可能在一定程度上是通过TGF-β1信号途径所介导的。
[1] Jankowski J,Attwood S,deCaestecker J,et al.,Aspirin in the pri⁃mary prevention of vascular disease[J].Lancet,2009,374(9693):877-878.
[2] WolffT,MillerT,Ko S.Aspirin for the primary prevention of cardiovascular events:an update of the evidence for the U.S.Pre⁃ventive Services Task Force[J].Ann Intern Med,2009,150(6):405-410.
[3] Redondo S,Ruiz E,Gordillo-Moscoso A,et al.Role of TGF-be⁃ta1 and MAP kinases in the antiproliferative effect of aspirin in hu⁃man vascular smooth muscle cells[J].PLoS One,2010,5(3):e9800-e9807.
[4] Redondo S,Santos-Gallego CG,Ganado P,et al.Acetylsalicylic acid inhibits cell proliferation by involving transforming growth fac⁃tor-beta[J].Circulation,2003,107(4):626-629.
[5] Pennison M,Pasche B.Targeting transforming growth factor-beta signaling[J].Curr Opin Oncol,2007,19(6):579-585.
[6] Lutgens E,GijbelsM,Smook M,et al.Transforming growth fac⁃tor-beta mediates balance between inflammation and fibrosis dur⁃ing plaque progression[J].Arterioscler Thromb Vasc Biol,2002,22(6):975-982.
[7] Pyrgakis,VN.Aspirin in primary prevention[J].Hellenic J Cardiol,2009,50(5):441-442.
[8] Voisard R,FischerR,Osswald M,et al.Aspirin(5 mmol/L)in⁃hibits leukocyte attack and triggered reactive cell proliferation in a 3D human coronary in vitro model[J].Circulation,2001,103(12):1688-1694.
[9] Marra DE,Simoncini T,Liao JK.Inhibition of vascular smooth muscle cell proliferation by sodium salicylate mediated by upregula⁃tion of p21(Waf1)and p27(Kip1)[J].Circulation,2000,102(17):2124-2130.
The Inhibitory Effect of Aspirin on the Proliferation of Human Umbilical Artery Smooth Muscle Cells by Transforming Growth Factor β1
WANG Lin,HUANG Tigang,LI Guangping,CAO Lu,ZHOU Lijuan,LIU Hongmei,ZHEN Qin
Cardiology Department,Tianjin Chest Hospital,Tianjin 300051,China
Objective:To investigate the inhibitory effect of aspirin on the proliferation of human umbilical artery smooth muscle cells(HUASMCs),and the potential mechanisms of transforming growth factor(TGF)-β1 signaling thereof.Methods:HUASMCs were isolated and cultured in vitro with or without specific anti-TGF-β1 neutralizing antibody.The cell proliferation and cell cycles were measured by MTT and flow cytometry after treatment with different concentrations of as⁃pirin(0.5,l.0,2.0 and 5.0 mmol/L).Results:There were significant differences in the values of OD and time effects in HUASMCs treated with different concentrations of aspirin(0.5,1.0,2.0 and 5.0 mmol/L)with specific anti-TGF-β1 neutraliz⁃ing antibody(P<0.05).The G0/G1phase was restrained by aspirin(2.0 mmol/L)in HUASMCs(P<0.05).There was a de⁃crease in G0/G1phase and an increase in S phase by specific anti–TGF-β1 neutralizing antibody in HUASMCs with aspirin of 2.0 mmol/L(P<0.05).Conclusion:Aspirin,independent of its cytotoxicity,can inhibit the proliferation of HUASMCs in vitro,in which TGF-β1 signaling might be involved.
umbilical arteries muscle,smooth,vascular cell proliferation cell cycle aspirin in vitro trans⁃forming growth factor beta1
300051 天津市胸科医院心内科(王林,曹路);天津医科大学第二医院心脏科(黄体钢,李广平,周丽娟);武警医学院附属医院(刘红梅);上海市第一人民医院(甄琴)
(2010-08-13收稿 2010-10-28修回)
(本文编辑 陆荣展)
