小鼠胃体部黏膜内分泌细胞的超微结构及与主细胞、壁细胞的关系
2011-01-15乔从进山西医科大学组织胚胎学教研室太原030001通讯作者mailwangtong4911hotmailcom
宋 励, 王 彤, 乔从进 (山西医科大学组织胚胎学教研室, 太原 030001;通讯作者,E-mail:wangtong4911@hotmail.com)
小鼠胃体部黏膜内分泌细胞的超微结构及与主细胞、壁细胞的关系
宋 励, 王 彤*, 乔从进 (山西医科大学组织胚胎学教研室, 太原 030001;*通讯作者,E-mail:wangtong4911@hotmail.com)
目的 观察小鼠胃体部黏膜内分泌细胞的超微结构,及其与胃底腺主细胞、壁细胞的相互关系。 方法 取成年小鼠胃体部黏膜在透射电镜下观察内分泌细胞及主细胞、壁细胞的超微结构。 结果 根据胞质中颗粒超微结构的不同特点,将内分泌细胞分为Ⅰ、Ⅱ、Ⅲ型。三型细胞均可见与主细胞及壁细胞紧密相邻,内分泌细胞的胞膜局部呈“Ω”型凹陷。 结论 基本确认Ⅰ型内分泌细胞即为肠嗜铬样细胞(enterochromaffin like cell,ECL细胞),推测ECL细胞除影响壁细胞泌酸外,在功能上与主细胞也存在密切关系。胃体部内分泌细胞除以经典内分泌方式释放激素外,也可以旁分泌方式对周围细胞产生影响。
超微结构; 胃体部; 内分泌细胞; 主细胞; 壁细胞; 透射电镜; 小鼠
胃体部黏膜存在多种内分泌细胞,对这些细胞进行形态学研究,有助于揭示其分泌物的释放方式,细胞功能活动,以及这些细胞与胃黏膜其他细胞之间的关系。近年采用电镜观察内分泌细胞超微结构的报道较少。尤其是对肠嗜铬样细胞(enterochromaffin like cell,ECL细胞),国内更缺乏形态学研究资料[1-6]。本室前期已采用光镜技术对ECL细胞和其他内分泌细胞进行了研究[5-7],本次拟采用透射电镜观察小鼠胃体黏膜内分泌细胞的超微结构及其与主细胞、壁细胞的位置关系,为揭示内分泌细胞与其他细胞之间的功能关系,进一步开展对临床某些疾病的发病机制的研究提供形态学资料。
1 材料与方法
出生后45 d的正常雄性昆明小鼠2只,体重约30 g,取材前禁食24 h,采用颈椎脱位法处死动物,剖腹取新鲜胃体部黏膜约1 mm3大小,经2%戊二醛(二甲砷酸钠配制,pH7.4),1%锇酸双重固定,丙酮逐级脱水,环氧树脂618包埋,制作超薄切片,经醋酸双氧铀、枸橼酸铅双重染色,在JEM-CX100透射电镜下观察内分泌细胞及主细胞、壁细胞的超微结构。
2 结果
2.1 内分泌细胞和主细胞、壁细胞的超微结构特点根据胞质中分泌颗粒超微结构的不同特点,将内分泌细胞分为Ⅰ、Ⅱ、Ⅲ型。Ⅰ型内分泌细胞:胞质内含大量分泌颗粒,按形态特点可分两类,一类颗粒为泡状,内含一个不规则的、偏心的电子密度高的芯(图1),颗粒膜与芯之间有很宽的空晕;另一类颗粒膜完整,颗粒中有圆形、均质或不均质的芯,两者间形成清晰的窄隙。另外,胞质内还可见许多无致密芯、有膜包被的空泡(图1)。Ⅱ型内分泌细胞分泌颗粒电子密度不等,与颗粒膜之间有狭窄的空晕(图2)。Ⅲ型内分泌细胞分泌颗粒大小不等,也可分两类:一类颗粒电子密度较高、均质状,与颗粒膜之间可见狭窄间隙,有时在均质的颗粒中可见一电子密度更高的芯(图3);另一类颗粒电子密度较低、均质或不均质状,与颗粒膜之间可见较宽间隙。此外,胞质中还可见许多有膜包被的空泡。
主细胞胞质内含大量粗面内质网,可见体积大、圆形或卵圆形的分泌颗粒,颗粒的电子密度较高,呈均质状,有膜包裹(图4)。壁细胞胞质内含大量线粒体及表面光滑的小管泡(图3)。

图1 Ⅰ型内分泌细胞(Ⅰ)与主细胞(Ch),内含一偏心的高电子密度芯的颗粒(↑),内含一圆形芯的颗粒(⬆)(×8 000)Fig 1 TypeⅠ endocrine cell(Ⅰ)and chief cell(Ch).The granule contained a decentered electron dense core(↑),or a round core(⬆)(×8 000)
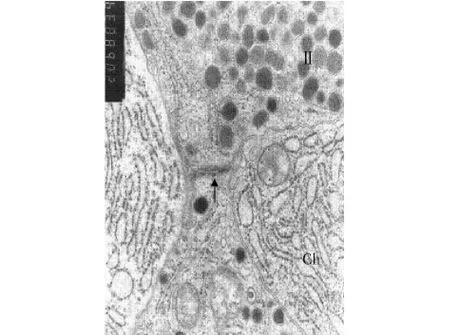
图2 Ⅱ型内分泌细胞(Ⅱ)、主细胞(Ch)及相邻内分泌细胞之间的细胞连接(↑)(×20 000)Fig 2 TypeⅡ endocrine cell(Ⅱ),chief cell(Ch)and the cell junction between adjacent endocrine cells(↑)(×20 000)
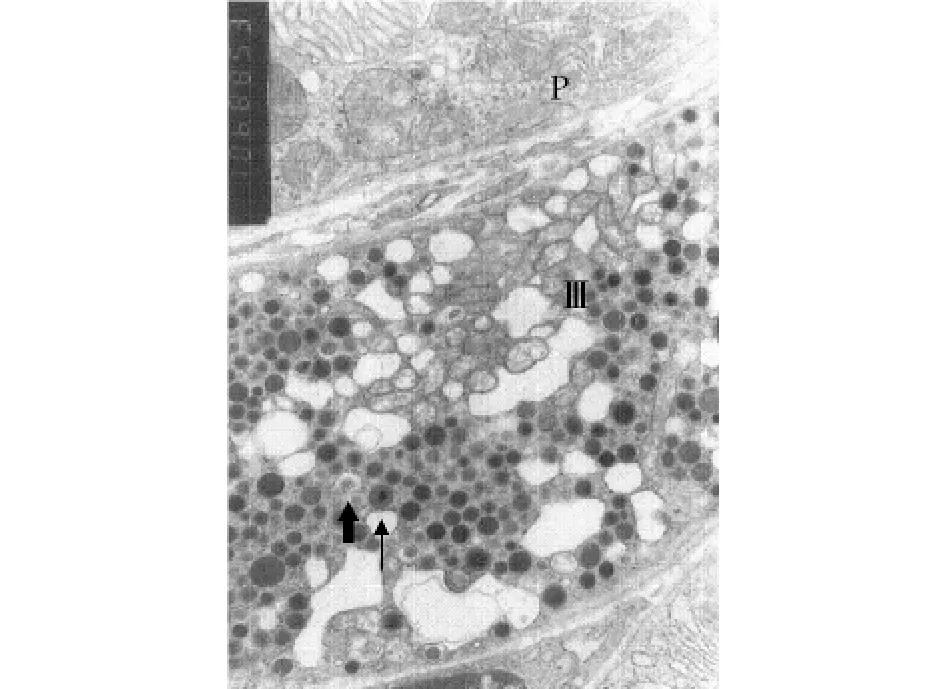
图3 Ⅲ型内分泌细胞(Ⅲ)与壁细胞(P),内含一高电子密度芯的颗粒(↑),内含一低电子密度芯的颗粒(⬆)(×10 000)Fig 3 TypeⅢ endocrine cell(Ⅲ)and parietal cell(P).The granule contained an electron dense core(↑),or a low electron density core(⬆)(×10 000)
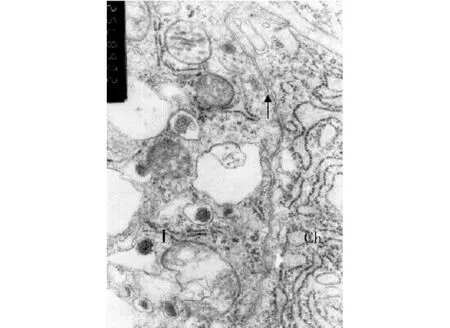
图4 Ⅰ型内分泌细胞(Ⅰ)与主细胞(Ch)相邻一侧细胞膜上的Ω型凹陷(↑)(×20 000)Fig 4 The Ω-shaped invagination(↑)between type Ⅰ endocrine cell(Ⅰ)and chief cell(Ch)(×20 000)
2.2 内分泌细胞与主细胞及壁细胞之间的相互关系 各型内分泌细胞均可见与主细胞或壁细胞紧密相邻。多见Ⅰ型内分泌细胞与主细胞紧密相邻,二者之间的细胞间隙狭窄(图4)。在Ⅰ型内分泌细胞的胞质内可见许多分泌颗粒靠近与主细胞相邻一侧的细胞膜,有的颗粒甚至已与胞膜相接触(图1)。此处Ⅰ型内分泌细胞的细胞膜出现“Ω”型凹陷,凹向胞质内,与主细胞之间的细胞间隙中可见电子密度低的物质(图4)。
其他内分泌细胞胞质内可见分泌颗粒靠近或接触与主细胞、壁细胞相邻一侧的细胞膜(图2、5)。一个内分泌细胞与主细胞相邻处的细胞膜可见较大的“Ω”型凹陷,凹向胞质内,此处细胞间隙中可见电子密度较高的分泌颗粒(图5)。电镜下还见到一个内分泌细胞夹于两个壁细胞之间,内分泌细胞与壁细胞之间的细胞间隙大部分模糊不清,可见细胞连接。并且该内分泌细胞的细胞膜表面形成微绒毛,微绒毛根部的胞质中可见分泌颗粒(图6)。

图5 内分泌细胞(E)与主细胞(Ch)间Ω型凹陷中的分泌颗粒(↑)(×20 000)Fig 5 The secretory granule in the Ω-shaped invagination(↑)between endocrine cell(E)and chief cell(Ch)(×20 000)

图6 内分泌细胞(E)与壁细胞(P)之间的细胞连接(↑),内分泌细胞表面的微绒毛(⬆)(×20 000)Fig 6 The cell junction(↑)between endocrine cell(E)andparietal cell(P),the microvillus(⬆)on endocrine cell(×20 000)
此外,不同的内分泌细胞也可见彼此紧密相邻,并可见细胞连接(图2)。镜下还可见到内分泌细胞与毛细血管紧密相邻。
3 讨论
3.1 内分泌细胞的超微结构特征 胃体部(泌酸部)黏膜内主要可见ECL细胞、肠嗜铬细胞(Enterochromaffin cell,简称EC细胞)和生长抑素细胞(D细胞)[2,7-9]。电镜下内分泌细胞主要根据其分泌颗粒的超微结构特点并配合免疫电镜技术进行分类[3]。据国外的研究报道,ECL细胞位于黏膜深部,为闭合型内分泌细胞,胞质内含有两类颗粒,一类为泡状,内含一个偏心的电子密度高的芯,颗粒膜与芯之间有很宽的空晕;另一类颗粒为圆形、均质或不均质状,膜完整,颗粒膜与颗粒芯之间有清晰的窄隙。除分泌颗粒外,胞质中还可见大量胞质小泡,国内外学者认为,这些胞质小泡可能用来储存组胺及其他的分泌物[2,4,8-10]。由于 ECL 细胞的颗粒超微结构特点明显,因此,可基本确认本实验所见的Ⅰ型内分泌细胞即为ECL细胞。另据文献报道,D细胞的分泌颗粒大,呈圆形或卵圆形,颗粒中有电子密度低的芯,芯与颗粒膜之间有狭窄的空晕。EC细胞的分泌颗粒较小,形态多样,电子密度高,有的颗粒显示双相内部结构,颗粒的中央有电子密度高的芯,芯与颗粒膜之间可见电子密度低的均质状物质[2,3]。根据上述描述,本研究中所见的Ⅱ型内分泌细胞可能为D细胞,所见的Ⅲ型内分泌细胞可能为EC细胞。但由于在不同内分泌细胞中也会见到超微结构特点相同的分泌颗粒,因此,确认本研究中所见的Ⅱ型和Ⅲ型内分泌细胞是否为D细胞和EC细胞,尚需进一步作免疫电镜技术的观察。
3.2 内分泌细胞与胃底腺主细胞、壁细胞的关系ECL细胞是胃体部黏膜中数量最多的一种内分泌细胞。国内外学者对ECL细胞的研究多集中在该细胞与壁细胞的关系方面。我室前期研究发现,光镜下小鼠胃黏膜中可见ECL细胞环抱相邻的壁细胞[7],ECL细胞分泌的组胺对壁细胞分泌胃酸起着至关重要的调节作用。根据“胃泌素细胞-ECL细胞-壁细胞轴”学说,胃黏膜中的胃泌素细胞分泌胃泌素,作用于ECL细胞上的 CCK-2受体,激活ECL细胞内组氨酸脱羧酶的活性,加快合成组胺;ECL细胞释放的组胺再作用于壁细胞上的H2受体,激活壁细胞内腺苷酸环化酶,催化CAMP形成,从而刺激胃酸分泌[8,10,11]。
近年也有少数学者在研究中关注ECL细胞与胃底腺主细胞的关系。Kamoshida等对豚鼠胃黏膜进行电镜观察发现,ECL细胞不仅与壁细胞相接触,也与主细胞相接触,而且,与主细胞的接触频率明显高于与壁细胞的接触频率[1];另据我室前期研究发现ECL细胞密集分布于小鼠胃黏膜下1/3处的上皮内[7],而此处主细胞分布集中,提示ECL细胞与主细胞之间在功能上可能存在密切的关系。有报道发现,ECL细胞分泌的组胺对主细胞分泌胃蛋白酶原也起着重要的调节作用。组胺刺激胃酸分泌,当胃内酸度增高时胃蛋白酶原的分泌量也相应增高。在活体狗生理学实验中,低浓度的组胺可以促进胃蛋白酶原的释放[1,12]。但也有研究报道,分离的主细胞上未能发现H2受体,提示组胺并不能直接作用于主细胞;ECL细胞的分泌产物除组胺外还有胰抑素、胃钙素、Reg蛋白等,因此推测,ECL细胞刺激主细胞分泌胃蛋白酶原可能是一种间接的调节作用,或是通过分泌一些尚未确认的物质直接作用于主细胞,影响主细胞的分泌功能[1,3,12]。近年一些学者通过转基因小鼠及基因敲除小鼠的研究发现,ECL细胞可影响胃黏膜上皮中各种细胞的分化[13,14]。组氨酸脱羧酶缺陷小鼠无黏膜内组胺合成,其黏膜呈增生表型,壁细胞及主细胞数量增加;主细胞分布广泛,从胃底腺的底部扩展至腺的全段并在腺的颈部出现较多分化不成熟的主细胞[14]。这些研究结果提示ECL细胞可能通过调节主细胞的分化及数量间接影响胃蛋白酶原的释放。据本实验所见ECL细胞与主细胞的位置关系,以及ECL细胞膜出现的“Ω”型凹陷,提示它可能以胞吐的方式将分泌颗粒中的物质排入细胞间隙,通过旁分泌的方式作用于主细胞,但分泌颗粒中究竟是何种物质,该物质以何种方式影响主细胞的功能尚有待进一步探讨。
我室前期采用免疫组织化学技术对胃体部EC细胞与D细胞进行观察,发现两种细胞都发出长突起伸至邻近细胞之间,据此推测,这些细胞可通过旁分泌方式释放激素影响周围细胞[5,6]。国外有学者在电镜下观察G细胞和D细胞,发现其胞膜出现“Ω”型凹陷,该凹陷与邻近细胞间可见分泌颗粒,其电子密度稍低于胞质中分泌颗粒的电子密度,据此认为这是内分泌细胞分泌物的分泌(胞吐)过程[1]。本实验中,我们除观察到内分泌细胞邻近毛细血管外,也见到内分泌细胞胞膜出现的“Ω”型凹陷,以及相邻内分泌细胞间的细胞连接,因此我们认为,胃体部内分泌细胞除以经典的内分泌方式释放激素外,也可以旁分泌方式释放激素对周围细胞产生影响。
[1] Kamoshida S,Saito E,Fuzuda S,et al.Anatomical location of enterochromaffin-like(ECL)cells,parietal cells and chief cells in the stomach,demonstrated by immunocytochemistry and electron microscopy[J].J Gastroenterol,1999,34:315 -320.
[2] 王鲁平,虞积要,梁延杰.胃内分泌细胞的超微结构及定量免疫组织化学研究[J].解剖学杂志,1996,19(2):143 -147.
[3] Dey R,hoffpauir J.Ultrastructural immunocytochemical localization of 5-hydroxytryptamine in gastric enterochromaffin cells[J].Histochem Cytochem,1984,32(6):661 -666.
[4] Zanner R,Gratzl M,Prinz C.Expression of the endocytic proteins dynamin and amphiphysin in rat gastric enterochromaffin-like cells[J].Cell Sci,2004,117:2369 - 2376.
[5] 张素娟,王彤,蔡玉瑾,等.胚胎小鼠胃肠道5-羟色胺及生长抑素免疫反应细胞的个体发生[J].山西医科大学学报,2008,39(5):391 -394.
[6] 蔡玉瑾,王彤,景雅,等.小鼠胃肠道胃泌素细胞的个体发生[J].解剖学杂志,2004,27(3):269 -272.
[7] 乔爱秀,王彤,景雅.新生小鼠胃内组胺免疫反应细胞的形态及分布[J].解剖学杂志,2005,28(5):520 -522.
[8] Hakanson R,Sundler F.Histamine producing cell in the stomach and their role in the regulation of acid secretion[J].Scand J Gastroenterol Suppl,1991,180:88 - 94.
[9] Zhao CM,Chen D,Lintunen M,et al.Secretory organelles in ECL cells of the rat stomach:an immunohistochemical and electron-microscopic study[J].Cell Tissue Res,1999,298:457 -470.
[10] Chen D,Zhao CM,Lindstrom E,et al.Rat stomach ECL cells update of biology and physiology[J].General Phamacol,1999,32:413-422.
[11] Lindstrom E,Chen D,Norlen P,et al.Control of gastric acid secretion:the gastrin - ECL cell- parietal cell axis[J].Comp Biochem Physiol Part,2001,128:505 -514.
[12] Kamoshida S,Saito E,Fukuda S,et al.Is the function of chief cells closely influenced by ECL cells?[J].J Gastroenterol,1999,34:424 -425.
[13] Miyaoka Y,Kadowaki Y,Ishihara S,et al.Transgenic overexpression of Reg protein caused gastric cell proliferation and differentiation along parietal cell and chief cell lineages[J].Oncogene,2004,23:3572 -3579.
[14] Nozaki K,Weis V,Wang TC,et al.Altered gastric chief cell lineage differentiation in histamine-deficient mice[J].Am J Physiol Gastrointest Liver Physiol,2009,296:G1211 - G1220.
Ultrastructure of endocrine cells in the mucosa of the body of stomach and its relations with chief cells and parietal cells in mice
SONG Li,WANG Tong*,QIAO Cong-jin(Dept of Histology and Embryology,Shanxi Medical University,Taiyuan 030001,China;*Corresponding author,E-mail:wangtong4911@hotmail.com)
ObjectiveTo observe the ultrastructure of endocrine cell in the mucosa of stomach and identify its relations with chief cells and parietal cells in mice.MethodsThe mucosa of the adult mouse stomach was observed with the transmission electron microscope.ResultsThe endocrine cells could be divided into three types,namely type Ⅰ,Ⅱ,Ⅲ based on their ultrastructure of the secretory granules.All types of endocrine cells were in contact with the chief cells or parietal cells and the“Ω”-shaped invagination was observed on the endocrine cell membrane.ConclusionTypeⅠendocrine cells could be basically confirmed as enterochromaffin like cells(ECL cells).It could be assumed that ECL cells not only could functionally exercise influence on the acid secretion from the parietal cells,but also have a close relation with the chief cells.Furthermore,the endocrine cells also have a paracrine effect on the adjacent cells.
ultrastructure;body of stomach;endocrine cells;chief cells;parietal cells;transmission electron microscope;mice
R329.2
A
1007 -6611(2011)02 -0102 -04
10.3969/J.ISSN.1007 -6611.2011.02.002
宋励,女,1977-12生,硕士,讲师,E-mail:springsl2002@163.com
2010-12-08]
