“紫娟”绿茶发酵过程中茶褐素理化性质及微生物变化*
2011-01-12谭超龚加顺保丽萍
谭超,龚加顺,保丽萍
(云南农业大学食品科学技术学院,云南昆明,650201)
普洱茶是中国历史名茶,是云南最具特色的名茶,距今已有1 700多年历史[1]。普洱茶通过潮水固态发酵,蒸压成型,冲泡汤色红浓明亮,香气独特陈香,滋味醇厚回甘。茶叶中的色素化合物包括存在于鲜茶叶中的天然色素以及加工过程中形成的色素。这些色素是茶叶色泽、汤色及叶底色泽的基础[2]。普洱茶茶色素属于天然色素,是从普洱茶中提取的一类水溶性酚性色素,包括茶黄素(TF)、茶红素(TR)、茶褐素(TB)。而茶褐素系非透析性高聚物,主要组分是多酚类、多糖、蛋白质和核酸等。非透析性多酚含量会随茶汤发热而增加[3]。传统普洱茶发酵过程中,因水热的作用会促使茶黄素和茶红素含量减少,而茶褐素含量增加。一般普洱茶中茶褐素含量为4% ~9%[4]。
“紫娟”茶属于茶树变种 (C.var.assamica),是云南大叶群体茶树品种中的一种特异品种,具有紫茎、紫叶、紫芽的特征,含较高的花青素。关于它的基本化学组成,特别是茶褐素目前的研究鲜见报道。在“紫娟”普洱茶发酵过程中,微生物如何变化,对茶褐素、茶红素等主体色素物质形成有何影响等研究报道极少。本课题以“紫娟”晒青绿茶为原料,通过茶叶适度潮水后固态发酵,制成“紫娟”普洱茶。通过分析在不同发酵时间段,其中主要微生物含量变化和茶褐素的基本组成、理化性质,阐明微生物与“紫娟”茶褐素形成的关系,明确“紫娟”茶褐素的理化性质与光谱学性质。为进一步研究“紫娟”普洱茶茶褐素与普通普洱茶茶褐素的差异奠定基础。
1 材料与方法
1.1 材料与试剂
“紫娟”茶晒青绿茶(云南省茶叶研究所)。试剂:无水乙醇、乙酸乙酯、正丁醇、氯仿、葡聚糖(分子量10 000)、硫酸、蒽酮、考马斯亮蓝、硫酸亚铁、酒石酸钾钠、磷酸氢二钠、磷酸二氢钾,所有试剂均为分析纯。
1.2 仪器与设备
101-3ABS恒温恒湿发酵箱,宁波东南仪器有限公司制造;紫外可见分光光度计,日本岛津UV1700;红外光谱仪,BIO-RAD FTS–40;氨基酸自动分析仪,Hitachi L-8900;等离子体发射光谱仪,岛津ICPS-7510;BCD-208K冰箱,青岛海尔。
1.3 试验方法
1.3.1 “紫娟”普洱茶发酵
以“紫娟”晒青绿茶为原料(10 kg),潮蒸馏水至茶叶含水量30%,静止3 h让水分充分被茶叶吸收,随后将潮水后的“紫娟”茶原料放入45℃,相对湿度75%的恒温恒湿发酵箱中发酵。发酵5 d取样作为一翻样;发酵10 d取样作为二翻样;发酵20 d取样作为三翻样;发酵30d取样作为四翻样。同时,分析各翻堆样的微生物以及理化性质。
1.3.2 茶褐素的提取流程
将茶样加入70%乙醇溶液中浸泡4 h(去除醇溶性色素),将浸泡后的茶渣再用85℃热水浸泡2 h,过滤后取滤液并浓缩。浓缩液逐次用乙酸乙酯、氯仿、正丁醇萃取,剩余水层加入无水乙醇至80%,沉淀茶褐素,收集沉淀,冷冻干燥。茶褐素含量分析方法参照文献[5-6]。
1.3.3 茶褐素理化性质的研究
(1)微生物分析:菌落总数测定参照 GB/T 4789.2-2008。霉菌与酵母菌检测计数与菌落总数测定相似。样品稀释液的制备:称取茶样10.00 g于250 mL锥形瓶并加入90 mL无菌水,置于静音振荡器上振荡20 min,此液为1×10-1g/mL浓度的茶样悬浮液,用无菌纱布在超净台上过滤并吸取1 mL的滤液于预先装好9 mL无菌水的(18×18)mm的试管中,此液为1×10-2的茶样稀释液。以此类推,制成 1 ×10-3、1 × 10-4、1 ×10-5、1 ×10-6、1 × 10-7g/mL等一系列稀释浓度液,供平板接种用。本试验分离霉菌、酵母采用 10-4、10-5、10-6三个稀释度;菌落采用10-2、10-3、10-4三个稀释度。接种:将样品稀释液用1 mL的无菌吸管吸取1 mL放入到配制好、已灭菌的相应培养基中,用接种刷把样品液抹匀,放到(28±1)℃下培养4~5 d即可观察鉴定及计数。每个样品采用3个稀释度,每个稀释度采取3重复。微生物的分离计数:采用混合平板计数法。同一稀释度各处理重复的菌落相差不能太大,霉菌以每皿10~100为宜,酵母、细菌以每皿30~300为宜。计算结果时,常按从接种后的3个稀释度,选择一个合适的稀释度,计算出每毫升菌剂中的含菌量。计数公式:每毫升样品的菌数=同一稀释度几次重复的菌落平均数×稀释倍数。
(2)多糖含量的测定[7]:蒽酮-硫酸法,以葡聚糖(分子质量10 000)为标准品。
(3)蛋白质含量的测定[7]:考马斯亮蓝法,牛血清白蛋白作标准蛋白。
(4)茶色素含量的测定[7]:萃取比色法。
(5)茶褐素总酸性基团、总羟基、总羧基的测定[8]:茶褐素和氢氧化钡反应生成茶褐素的钡盐,用过量的标准酸中和氢氧化钡,然后用标准的氢氧化钠溶液回滴过量的酸测定总酸性基团。茶褐素与醋酸钙反应生成茶褐素钙和醋酸,然后用标准氢氧化钠溶液滴定生成的醋酸,测定羧基。红外光谱分析表明,茶褐素中的酸性基团主要是羧基和酚羟基。因此,只要测出总酸性基团的含量减去羧基含量即为酚羟基含量。
(6)氨基酸含量分析:采用酸水解法,利用氨基酸自动分析仪测定样品中水解氨基酸含量。取100 mg样品于水解管内,加入15 mL浓度为6 mol/L的HCl,抽真空并封管,置于(110±1)℃恒温干燥箱内,水解22 h后,将管内水解液过滤,取1 mL干燥并用1 mL pH 2.2的柠檬酸钠缓冲液溶解,供仪器测定用。
(7)矿物质元素分析:等离子体发射光谱仪。
1.3.4 茶褐素光谱学性质分析
(1)样品的UV-vis分析:将“紫娟”茶褐素配成溶液,于190~1 100 nm波长范围内扫描。
(2)IR分析:将“紫娟”茶褐素经KBr压片,于红外光谱上扫描分析,扫描范围500~4 000 cm-1,分辨率为8 cm-1,扫描次数为16。
2 结果与分析
2.1 不同发酵阶段“紫娟”茶叶中的茶褐素含量变化
茶褐素系指一类能溶于水而不溶于乙酸乙酯、正丁醇和乙醇等有机溶剂的褐色色素。在普洱茶加工过程中,茶褐素的含量,对茶的品质形成有十分重要的作用[9]。不同发酵阶段“紫娟”茶叶中茶褐素含量结果见表1。由表1可看出,在发酵的前20天,样品中的茶褐素含量随发酵时间的延长而不断增加,第三翻样品中的茶褐素含量达到最高(18.36%),第四翻样茶褐素含量又减少。这可能与微生物的变化密切相关,微生物数量在第三翻达到最高,而后数量急剧减少(见表2)。
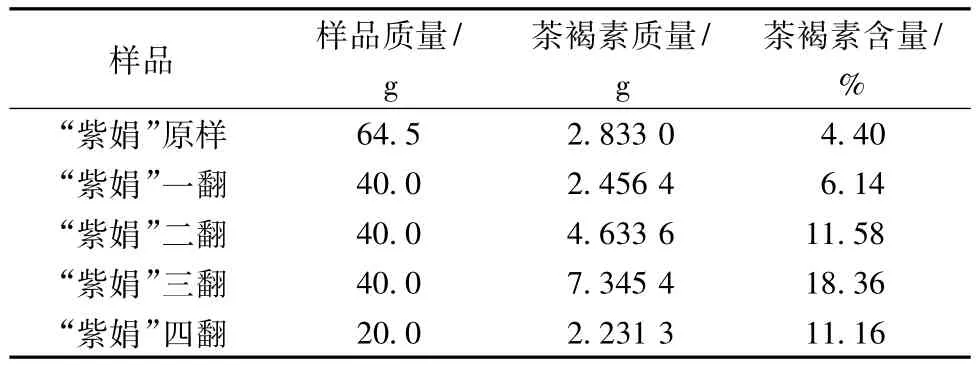
表1 不同发酵阶段“紫娟”茶中茶褐素含量变化

表2 不同发酵阶段“紫娟”茶中微生物含量
刘勤晋等研究表明,普洱茶渥堆过程中黑曲霉(Asp.niger)生长最为旺盛,其次是青霉、根霉和酵母[10]。通过对普洱茶发酵过程中的氧化酶(多酚氧化酶、过氧化物酶、抗坏血酸氧化酶)的活性进行检测,发现在发酵过程中有强烈的多酚氧化酶和抗坏血酸氧化酶的活性。此前,我们对接种外源优势菌酵母菌发酵普洱茶过程中各种酶活性的结果变化显示[11],发酵10d后多酚氧化酶和纤维素酶活性达最高,分别从原料中的9.29 u/g和0.377u/g增加到34.2u/g和1.27 u/g;发酵20 d后,糖化酶活性由原料的8.23 u/mL增加到58.42 u/mL;发酵30d后,淀粉酶活性由原料的164.28 u/g增加到239.19 u/g;发酵40 d后,果胶酶活性由原料的0.08 u/mL增加到2.8 u/mL,过氧化氢酶活性由原料的5.6 u/mL增加到58.9 u/mL。
由此可见,在普洱茶发酵过程中,生物分泌的多种酶协同作用于茶叶,使茶叶内含成分与酶分子间以及成分与成分间的相互接触,特别是多酚氧化酶(PPO)酶促作用更为激烈,从而促进了普洱茶品质特征的形成,特别是茶褐素的大量形成。
2.2 不同发酵阶段“紫娟”茶褐素中的多糖、蛋白质、茶色素及酸性基团含量变化
“紫娟”茶褐素在发酵过程中多糖、蛋白质、茶色素等组成会随发酵时间延长而变化,从表3可以得出,随着发酵时间的延长,茶褐素中的多糖、蛋白质不断增加,但到第四翻时,含量有一些下降,这可能是与微生物有很大关系,因为这一阶段的微生物减少了很多,从而影响了多糖、蛋白质的含量。不同茶样提取的茶褐素中的茶色素含量也有明显变化,从整体变化趋势看,茶黄素和茶红素的含量是随着发酵时间的延长而不断地减少的,茶褐素的含量则不断地增加。然而,茶黄素和茶红素的减少量并不等于茶褐素的增加量,均小于茶褐素的增加量。这种量的差别可能显示茶褐素的形成并不只是通过茶黄素和茶红素转化而来,还可能有多糖、蛋白质的参与。活性基团总羟基及总羧基的变化复杂,仅总羧基的变化与微生物、茶褐素的变化规律一致,这显示普洱茶的发酵是一个非常复杂的化学变化过程。
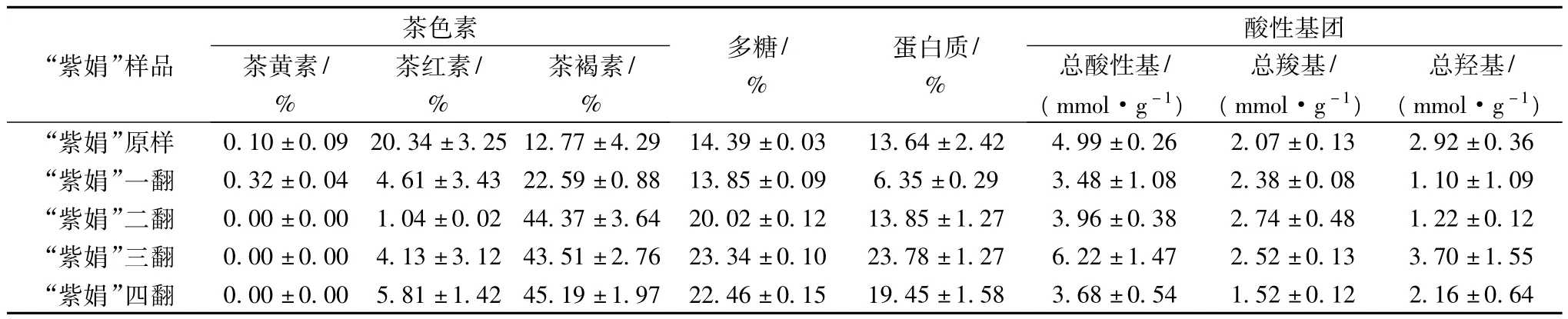
表3 不同发酵阶段“紫娟”茶褐素中多糖、蛋白质、茶色素及酸性基团含量
2.3 不同发酵阶段“紫娟”茶褐素中主要氨基酸含量
从表4得出,单体氨基酸如天门冬氨酸、谷氨酸、胱氨酸的含量随着发酵时间的延长,含量不断减少;而苏氨酸、丝氨酸、甘氨酸、丙氨酸、缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、酪氨酸、苯丙氨酸、脯氨酸以及水解氨基酸总量等均随着发酵时间的延长,含量不断增加。赖氨酸、组氨酸、精氨酸这3种氨基酸的含量先是不断增加,发酵10d后含量达到最高,而后逐渐下降。单体氨基酸含量的变化反映了与茶褐素结合的蛋白质随发酵时间也在变化。
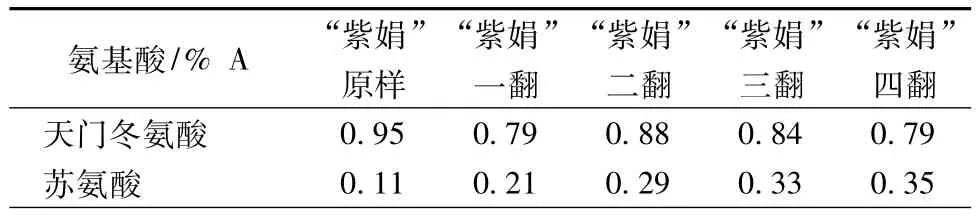
表4 不同发酵阶段“紫娟”茶褐素中主要氨基酸的含量

续表4
2.4 不同发酵阶段“紫娟”茶褐素的矿物质含量
测定茶褐素中矿物质元素的含量,可反映茶褐素结合基团的变化,特别是羧基、羟基的变化。由表5可知,随发酵时间的延长,“紫娟”茶褐素中矿物质元素的含量呈下降趋势。硫、磷、钾、镁、锌、锰元素的含量,总趋势是随发酵时间延长而下降,而钙、铁、铜元素的含量,总趋势是随发酵时间延长,先逐渐减小,到发酵30d时(第四翻)又逐渐增加。钾元素的含量最高。对比检测发现,普洱茶速溶茶粉中钾元素的含量可达7%。这些矿物质元素的变化可能与微生物的滋生、繁殖有密切的关系。

表5 不同发酵阶段“紫娟”茶褐素中矿物质含量/(mg/kg)
2.5 不同发酵阶段“紫娟”茶褐素UV-vis性质
不同发酵时间的“紫娟”茶褐素样品在280 nm左右处均有一个吸收峰,此处是蛋白质和核酸的最大吸收峰。因此,不论经过多长时间的发酵,“紫娟”普洱茶提取的茶褐素中都含有一定量的蛋白质和核酸。样品在200 nm左右有最大吸收峰,有研究表明,植物多糖糖苷的最大吸收峰在200nm左右,说明在茶汤中可能含有小分子糖形成的糖苷或多糖复合产物存在。
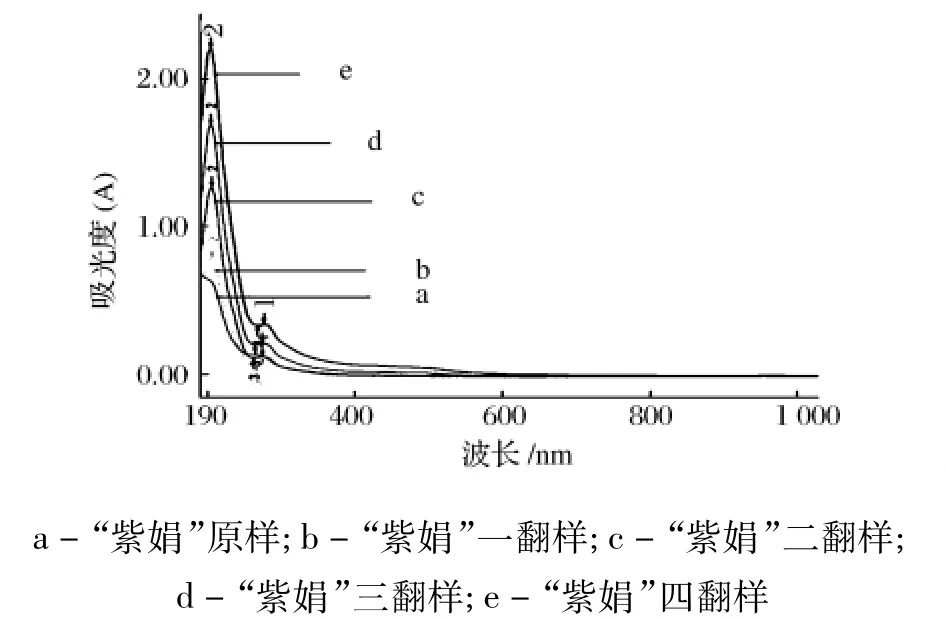
图2 不同发酵时间“紫娟”茶褐素的UV-vis
2.6 不同发酵阶段“紫娟”茶褐素IR性质
由图3得出,“紫娟”普洱茶不同发酵阶段茶褐素提取物的红外光谱图差异不大;茶褐素提取物在3 410 cm-1处的强宽吸收峰为 O—H伸缩振动;在3 600~3 000 cm-1范围内出现的宽峰还可能包含N—H伸缩振动;2 929 cm-1处为亚甲基的C-H伸缩振动峰,1 626 cm-1处为C=O的伸缩振动峰,结合1 531 cm-1处的吸收峰可以判断该处可能还含有芳环骨架振动引起的吸收,1 409 cm-1处为COO-的对称伸缩振动峰;1 313 cm-1处为芳香族的C—N伸缩振动峰,1 242 cm-1处为酚的 C—O的伸缩振动峰,1 098、1 050 cm-1两处为 C—O—C的伸缩振动峰,787、701 cm-1两处为苯环的C—H面外曲振动。“紫娟”茶褐素为多羟基酚类物质,并含有羧基,结合有蛋白质和多糖,更确切的基团情况尚需进一步做其他的相关分析来确定。

图3 不同发酵阶段“紫娟”茶褐素红外光谱图
3 讨论
微生物在普洱茶的发酵过程中发挥了非常重要的作用[12-13]。测定不同发酵阶段(不同翻堆)样“紫娟”普洱茶的微生物指标,从表2可以得出,样品中的菌落总数、霉菌、酵母菌数量随着发酵的时间的延长,呈上升趋势。在“紫娟”原样中,含有一些本身就携带的微生物,这对不接种任何微生物,只是控制发酵温度和湿度的普洱茶发酵过程是非常有利的。这些微生物在恒温恒湿的条件下迅速滋生、繁殖,表现出来的就是一翻样中的微生物数量都增长了很多。随着发酵时间的延长,微生物的数量继续增多,在三翻,即发酵20d的时候达到微生物数量的最高点,随后,微生物的数量急剧的减少,这可能是因为随着发酵到达一定的时期,普洱茶中能供给这些微生物生长繁殖的营养物质差不多耗尽,微生物的数量就会减少很多。
“紫娟”普洱茶在发酵前后变化明显,从扫描电镜图片(图4)可以看出。茶原样中微生物含量较少,而四翻中则存在大量微生物。发酵前,茶叶表面比较完整光滑,细胞结构、纤维素、木质素等没有被破坏。而晒青绿茶经发酵后,茶叶表面长满微生物,并且茶叶结构已经被破坏。两组电镜图的直观对比,说明微生物一方面生长需要碳源,同时,又可分泌一些酶将茶叶细胞结构破坏,组成成分纤维素、半纤维素、原果胶等物质被降解。可见微生物在普洱茶发酵中起了重要作用。

图4 “紫娟”茶叶一翻样和四翻样扫描电镜图(“紫娟”原样(a);“紫娟”四翻样(b))
“紫娟”普洱茶中的成分在发酵的中后期呈现明显的增减变化。关于微生物的变化。何国藩、林月禅、徐福祥等人[14]的研究表明,渥堆早期霉菌最先发展起来,酵母菌早渥堆开始几天数量甚少,到中后期大量发展起来,成了优势菌种。这是因为霉菌能利用各种多糖作为碳源,代谢的结果产生了大量的双糖和单糖,使酵母有了足够的营养。普洱茶以晒青毛茶作为原料,经发水、渥堆陈化及干燥工序精制而成的后发酵茶。渥堆陈化实际上是在酶促作用、湿热作用和微生物的作用下共同完成的,但微生物起最主要的作用。试验中发现茶褐素中含有多糖和蛋白质。要对茶褐素的化学结构作进一步的分析,就需要将茶褐素进行分离纯化,才能得到更加准确的分析结果,而如何将茶褐素分离纯化,在以后的研究中是重点需要攻克的地方。
4 结论
(1)“紫娟”茶叶中菌落总数、霉菌、酵母菌数量以及茶褐素提取量变化随发酵时间的延长呈现先增后降的变化;茶褐素组成中的多糖、蛋白质残基等含量不断增加,茶色素含量、总羟基及总羧基的含量变化明显,天门冬氨酸、谷氨酸等含量不断减少;而苏氨酸、丝氨酸等含量不断增加。赖氨酸、组氨酸、精氨酸的含量先增加后下降。矿物质元素硫、磷、钾、镁、锌、锰元素的含量下降,钙、铁、铜元素的含量先逐渐减小后逐渐增加。
(2)UV-vis表明,不同发酵时间“紫娟”茶褐素在200nm处有一个最大吸收峰,280nm左右有一个特征吸收峰。IR表明,“紫娟”普洱茶茶褐素为多羟基酚类物质,并含有羧基,结合有蛋白质、多糖。
(3)霉菌和酵母菌对“紫娟”茶褐素的形成起重要作用,影响了茶褐素的理化性质,特别是化学组成。
[1] 周红杰.云南普洱茶[M].昆明:云南科技出版社,2004.
[2] 王汉生.茶叶色香味的化学基础[J].广东茶叶,2005(1):39-41.
[3] 陈宗道.茶叶化学工程学[M].重庆:西南师范大学出版社,1999.
[4] 洪德臣,范兆义,李楠.茶色素及其化学成分[J].现代诊断与治疗,1995(6):32-33.
[5] Edwin H.Thoughts on theatubigins[J].Phytochemistry,2003,64(1):61-73.
[6] 安徽农学院.茶叶生物化学[M].2版.北京:农业出版社,1994.
[7] 黄意欢.茶学实验技术[M].北京:中国农业出版社,1995.
[8] 李建武.生物化学试验原理和方法[M].北京:北京大学出版社,2001.
[9] 易恋,黄建安,刘仲华.普洱茶多酚与茶褐素研究进展[J].中国食物与营养,2009(12):29-31.
[10] 刘勤晋.普洱茶之科学读本[M].广州:广东旅游出版社,2005.
[11] 朱春华.云南普洱茶加工和贮藏过程中酶活性及成分变化研究[D].昆明:云南农业大学,2008.
[12] 赵龙飞,周红杰.云南普洱茶渥堆过程中的主要微生物初探[J].商丘师范学院学报,2005,21(2):129-133.
[13] 赵龙飞,徐亚军,周红杰.黑曲霉在云南普洱茶发酵过程中生长特性的研究[J].食品研究与开发,2007,28(10):1-3.
[14] 何国藩.广东普洱茶渥堆过程中咖啡碱和茶多酚含量变化及饮效[J].中国茶叶,1986(5):8-9.
