橄榄酚类提取物的抗氧化性能*
2011-01-12冯英委何志勇陈洁曾茂茂秦昉陶冠军王林祥
冯英委,何志勇,陈洁,曾茂茂,秦昉,陶冠军,王林祥
(江南大学食品科学与技术国家重点实验室,江苏无锡,214122)
橄榄(Canarium albumL.Rauesch),又名青果、白榄、黄榄、山榄。我国橄榄品种资源丰富,其与原产欧洲地中海地区的油橄榄(OleaeuropaeaL.)实为不同科属的植物[1]。橄榄具有很高的食用药用价值,属卫生部批准的既是食品又是药物的69种物品之一,具有解酒护肝、抗菌消炎、抗病毒、解毒、抑制血糖升高和增加骨密度与骨钙含量等药理功效,酚类化合物是其主要药效成分[2]。
酚类化合物由于其分子含有酚羟基结构,具有较强的抗氧化作用,不仅有益于人体健康,而且对于食品的抗氧化也具有潜在的积极作用。随着工业化社会的发展,在崇尚绿色天然的消费观念下,人们越发对天然提取物产生兴趣。从天然产物中提取酚类化合物并开发应用于食品、制药、生化、日化、精细化工、营养、功能高分子材料等领域的研究已成为当前热点[3]。我国橄榄酚类物质的开发利用尚处于起步阶段,目前有关橄榄酚类物质功能活性的研究报道较少,其抗氧化活性的评价方法体系还比较单一。本研究通过测试还原力、金属离子螯合能力及4种不同自由基清除能力,以考察橄榄酚类提取物的抗氧化性能。
1 材料与方法
1.1 材料与仪器
福建檀香橄榄:无锡朝阳果蔬批发市场采购;橄榄酚类提取物:新鲜橄榄去核,果肉打浆,再用体积分数70%的乙醇溶液搅拌提取,提取液经真空浓缩、冷冻干燥得到粗提物产品;橄榄酚类纯化物:橄榄酚类粗提物用水溶解后上AB-8大孔树脂纯化,洗脱液经真空浓缩、冷冻干燥即得橄榄酚类纯化物产品;2,2'-氨基-二(3-乙基-苯并噻唑啉-6-磺酸)(ABTS)、1,1-二苯-2-苦基苯肼 (DPPH)、Fe3+-三吡啶三吖嗪(TPTZ)、3-(2-吡啶基)-5,6-双(4-苯磺酸)-1,2,4-三嗪(Ferrozine)、6-羟基-2,5,7,8-四甲基苯并二氢吡喃-2-羧酸(Trolox)、丁基羟基茴香醚(BHA)、Vc、没食子酸,均为美国Sigma公司产品;其他试剂为国产分析纯。
UV-2800H型紫外可见分光光度计,上海仪器有限公司;TGL-16G台式离心机,上海安亭科学仪器厂;Lab Dancer圆周振荡器,广州仪科实验室技术有限公司;pH计,梅特勒-托利多仪器(上海)有限公司。
1.2 实验方法
1.2.1 样品处理
分别称取3 g橄榄酚类粗提物和1 g橄榄酚类纯化物,以体积分数为70%的乙醇溶解并定容于100 mL的容量瓶中,各超声10 min,离心取上清液备用。
1.2.2 样品总酚含量的测定
精确吸取样品液1 mL与Folin-Ciocalteu试剂2.5 mL于10 mL容量瓶,振摇混匀后放置5 min,加入碳酸钠溶液(75 g/L)2 mL,用超纯水定容后混匀。30℃下反应2 h,于760 nm波长处测定吸光值,以超纯水作为空白对照。以没食子酸配制成10~50 mg/mL的系列标准溶液,作标准曲线。样品的总酚含量表示为与每毫升样品溶液相当的没食子酸(gallic acid equivalent,GAE)的毫克数(mg GAE/mL)[4]。
1.2.3 ABTS自由基(ABTS+·)清除能力的测定
工作液制备:用超纯水将ABTS和高硫酸钾分别溶解并混合,使其浓度分别为7 mmol/L和2.45 mmol/L,在室温、避光条件下放置 12~16 h,形成ABTS自由基储备液,使用前用磷酸盐缓冲液(0.2 mol/L,pH 7.4)稀释,使其 734 nm处吸光度为(0.700±0.020)。
测定方法:将橄榄酚类粗提物和纯化物分别稀释成不同浓度(0.01、0.02、0.03、0.05 和 0.1 mg/mL),以BHA和Vc作为阳性对照。精确吸取样品稀释液0.1mL,加入3.9mL ABTS工作液充分混合,在30℃反应10 min后,于734 nm波长处测定吸光值得A1,以超纯水作空白得A0,计算ABTS自由基清除率。以0~1 000μmol/L的Trolox标准溶液绘制标准曲线,样品的ABTS自由基清除能力用TEAC值(trolox equivalent antioxidant capacity)表示[5]。

1.2.4 DPPH自由基(DPPH·)清除能力的测定
试剂配制:用无水乙醇溶解9.858 mgDPPH并定容至25 mL的棕色容量瓶,配置成1 mmol/L的溶液,冷藏放置。用无水乙醇稀释10倍使用。
测定方法:将橄榄酚类粗提物和纯化物分别稀释成不同浓度(0.001、0.005、0.01、0.02 和 0.1 mg/mL),以BHA和Vc作为阳性对照。将2 mL超纯水和2 mL样品液分别加入等体积DPPH溶液(0.1 mmol/L),振荡混合,30℃条件下反应30 min后在517nm测定吸光值,得到A0和A1。A2由2 mL样品液加入等体积无水乙醇测定,计算DPPH自由基清除率。以0~40μmol/L的trolox标准溶液绘制标准曲线,样品的 DPPH自由基清除能力用 TEAC值表示[6]。
DPPH·清除率/%=[1-(A1-A2)/A0]×100
1.2.5 羟自由基(·OH)清除能力测定
采用氧化邻二氮菲-Fe2+法[7],将橄榄酚类粗提物和纯化物分别稀释成不同浓度(0.01、0.02、0.05、0.1和0.2 mg/mL),以BHA和Vc作为阳性对照。取5 mmol/L邻二氮菲1.0 mL加入试管,再加入0.2 mol/L、pH 7.4的磷酸盐缓冲液2.0 mL和样品溶液1.0 mL,充分混匀。再加入7.5 mmol/L的FeSO4溶液1.0 mL,并立即混匀。再加入0.1%H2O21.0 mL,混匀后37℃保温1 h,于536 nm处测其吸光值A1,用同体积的超纯水代替样品液得空白对照A0。
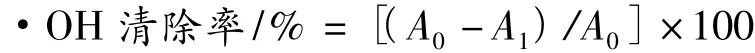
试剂配制:称取 0.1261 g邻苯三酚,溶于10 mmol/L的HCl溶液,并以10 mmol/L的HCl定容到100 mL混匀,得到10 mmol/L的邻苯三酚溶液。
测定方法:将橄榄酚类粗提物和纯化物分别稀释成不同浓度(0.05、0.1、0.2、0.5 和 1 mg/mL),以BHA和Vc作为阳性对照。参照文献[6]方法略改进,取0.1 mL样品,加入1.8 mL的Tris-HCl缓冲液(pH 8.2、50 mmol/L),再加入 2 mL 超纯水,混匀后在25℃水浴中保温10 min,再加入0.1 mL的邻苯三酚溶液(10 mmol/L),立即混匀,于320 nm下测定吸光值。从加入邻苯三酚后30 s开始读数,以后每隔30 s读数一次,直到第4 min结束。以时间和吸光值分别为横、纵坐标作图,得到的曲线斜率计为△A1,以超纯水为空白对照,得到的斜率计为△A0。
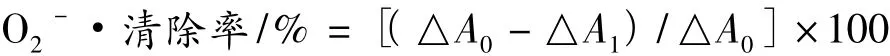
1.2.7 铁离子还原能力的测定(FRAP)
试剂配制:10 mmol/L的 TPTZ储备液(用40 mmol/L的盐酸溶解),20 mmol/L的 FeCl3溶液和0.3mol/L的醋酸缓冲液(pH 3.6)以体积比1∶1∶10混合,并在37℃下静置1 h得FRAP工作液。
测定方法:将橄榄酚类粗提物和纯化物分别稀释成不同浓度(0.01、0.02、0.05、0.1 和 0.2 mg/mL),以BHA和Vc作为阳性对照。精确吸取样品稀释液100 μL,加入 300 μL 超纯水和 3 mL 新鲜配制的FRAP工作液,充分混合,在37℃反应30 min后,于593 nm处测定吸光值,以超纯水作为空白对照。以0~600 μmol/L的Trolox标准溶液绘制标准曲线。样品的还原能力(FRAP值)以TEAC值表示[8]。
1.2.8 亚铁离子螯合能力的测定
将橄榄酚类粗提物和纯化物分别稀释成不同浓度(0.01、0.02、0.05、0.1 和 0.2 mg/mL),以 BHA 和Vc作为阳性对照。参照文献[9]方法有所改进,1 mL样品溶液与0.05 mL的FeCl2溶液(2 mmol/L)、1.85 mL超纯水混合。加入0.1 mL的ferrozine(5 mmol/L)溶液,并均匀混合。30℃条件下保温10 min,在562 nm下测定吸光值A1。以超纯水为空白对照得A0。计算螯合率。
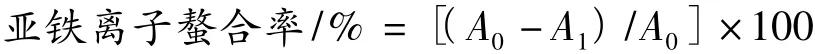
2 结果与讨论
2.1 橄榄提取物中总酚含量
经Folin-Ciocalteu法测定,橄榄粗提物粉末中总酚含量为15.4%,纯化物粉末中总多酚含量为49.7%。
2.2 橄榄酚类提取物ABTS+·清除能力

图1 橄榄酚类提取物的ABTS+·清除能力
如图1所示,橄榄酚类粗提物、纯化物,BHA和Vc清除ABTS+·的能力均随样品浓度增大而增强,橄榄酚类粗提物和纯化物ABTS+·清除能力在相同浓度下差别不大(P>0.05)。在0.01~0.05 mg/mL内,橄榄酚类粗提物和纯化物的剂量-效应关系增加很明显,而在0.05~0.1 mg/mL内清除能力增加比较平缓,在0.1 mg/mL时,其TEAC值分别为957.9 μmol/L(清除率为99.7%)和 959.4 μmol/L(清除率为99.8%)。在各浓度下,粗提物和纯化物ABTS+·清除能力均显著强于 BHA和 Vc(P<0.05)。且BHA、Vc在0.1 mg/mL时其 TEAC值才分别达到754.8μmol/L(清除率为 79.5%) 和 391.6 μmol/L(清除率为43.5%)。由此显示,橄榄酚类物质具有很强的ABTS+·清除能力。
2.3 橄榄酚类提取物DPPH·清除能力
由图2可知,在0.001~0.02 mg/mL内,各样品清除DPPH·的能力随浓度增大而增强,且剂量-效应现象非常明显,清除能力从强到弱依次为橄榄酚类纯化物,粗提物,Vc,BHA(P<0.05)。在0.02 mg/mL时,粗提物、纯化物和Vc清除DPPH·的TEAC值均接近最大值40μmol/L(清除率为95.5%),之后清除能力变化较小。而BHA清除DPPH·能力相对较弱,在0.02 mg/mL时其 TEAC值为33.3μmol/L(清除率为79.7%)。由此可见,橄榄酚类提取物具有较强的DPPH·清除能力,且粗提物和纯化物在相同浓度条件下·OH清除能力相当(P>0.05)。

图2 橄榄酚类提取物的DPPH·清除能力
2.4 橄榄酚类提取物·OH清除能力
从图3可发现,在测试浓度范围内,橄榄酚类粗提物、纯化物,BHA清除·OH的能力随样品浓度增大而逐渐增强,清除率从30%左右增加到最大的50%左右。而Vc的·OH清除能力则明显很弱,其清除率均在6%以下。浓度在0.05 mg/mL以下时,橄榄酚类提取物的·OH清除能力与BHA无显著性差异(P>0.05),但在0.1 mg/mL以上时,提取物·OH清除率要高于BHA。说明橄榄酚类提取物具有一定的·OH清除能力。另外,橄榄酚类粗提物和纯化物在相同浓度条件下其·OH清除能力相差不大(P>0.05)。

图3 橄榄酚类提取物的·OH清除能力
2.5 橄榄酚类提取物清除能力

图4 橄榄酚类提取物的清除能力
2.6 橄榄酚类提取物铁离子还原能力
如图5所示,在试验浓度内,橄榄酚类粗提物、纯化物和BHA的铁离子还原能力均随样品浓度增大而明显增加(P<0.05),在0.2 mg/mL时,酚类提取物的FRAP值达1 700μmol/L Trolox以上,而Vc的铁离子还原能力则相对较弱(700μmol/L Trolox)。在相同浓度条件下,橄榄酚类提取物的铁离子还原能力要强于BHA和Vc,说明橄榄酚类提取物具有较强的还原能力,其总抗氧化活性较强。另外,橄榄酚类粗提物和纯化物的铁离子还原力差异较小(P>0.05)。

图5 橄榄酚类提取物的铁离子还原能力
2.7 橄榄酚类提取物金属离子螯合能力
橄榄酚类提取物和Vc的亚铁离子螯合能力均较弱,BHA在试验浓度范围内显示无亚铁离子螯合能力(见图6)。酚类纯化物金属离子螯合能力随样品浓度增大而有所增强(P<0.05),其浓度在0.2 mg/mL时,螯合率为14.9%。Vc的金属离子螯合率最高为15.8%,随浓度增大其螯合率减小并维持在5%左右的水平。而橄榄酚类粗提物的亚铁离子螯合率均在4%以下,明显低于橄榄酚类纯化物(P<0.05),这可能是由于不同纯度的酚类提取物中酚类化合物组成不同所致。

图6 橄榄酚类提取物的金属离子螯合能力
3 结论
对橄榄酚类提取物进行不同的抗氧化体系检测,结果表明,橄榄酚类提取物具有比BHA和Vc更强的ABTS+·、DPPH·和·OH清除能力及铁离子还原力,橄榄酚类提取物同时具有较好的O2-·清除能力,虽不及Vc,但强于BHA,而其亚铁离子螯合能力较弱。橄榄酚类粗提物和纯化物相同浓度下在ABTS+·、DPPH·、·OH清除能力和铁离子还原能力方面相差不大(P>0.05),而在O2-·清除能力和亚铁离子螯合能力方面表现有所差异,纯化物亚铁离子螯合能力要强于粗提物,其O2-·清除能力要弱于粗提物。综合而言,橄榄酚类提取物显示具有较好的抗氧化性能,可作为天然抗氧化剂进一步开发利用。
[1] 刑湘臣.橄榄杂谈[J].森林与人类,1995(2):28.
[2] 陈岗,蒋和体,唐春红.橄榄多酚的保健功效及其应用[J].中国食品添加剂,2009(1):138-141.
[3] 宋立江,狄莹,石壁.植物多酚研究与利用的意义及发展趋势[J].化学进展,2000,12(2):161-170.
[4] Cai Y,Luo Q,Sun M,et al.Antioxidant activity and phenolic compounds of 112 traditional Chinese medicinal plants associated with anticancer[J]. Life Sciences,2004,74(17):2 157-2 184.
[5] Re R,Pellegrini N,Proteggente A,et al.Antioxidant activity applying an improved ABTS radical cation decolorization assay[J].Free Radical Biology & Medicine,1999,26(9/10):1 231-1 237.
[6] Tang X,He Z,Dai Y,et al.Peptide fractionation and free radical scavenging activity of zein hydrolysate[J].Journal of Agricultural and Food Chemistry,2010,58(1):587–593.
[7] 阮征,邓泽元,严奉伟,等.菜籽多酚和Vc在化学模拟体系中清除超氧阴离子和羟自由基的能力[J].核农学报,2007,21(6):602 -605.
[8] Benzie I F,Strain J.The ferric reducing ability of plasma(FRAP)as a measure of"antioxidant power":the FRAP assay[J].Analytical Biochemistry,1996,239(1):70 -76.
[9] Wang L L,Xiong Y L.Inhibition of lipid oxidation in cooked beef patties by hydrolyzed potato protein is related to its reducing and radical scavenging ability[J].Journal of Agricultural and Food Chemistry,2005,53(23):9 186–9 192.
