2,4-D对小麦胚愈伤组织诱导及其形成的影响
2011-01-12邹亚丽王廷璞刘瑞媛马伟超李一婧
邹亚丽,王廷璞,刘瑞媛,马伟超,李一婧
(天水师范学院 生命科学与化学学院,甘肃 天水 741001)
2,4-D对小麦胚愈伤组织诱导及其形成的影响
邹亚丽,王廷璞,刘瑞媛,马伟超,李一婧
(天水师范学院 生命科学与化学学院,甘肃 天水 741001)
为建立有效的小麦细胞诱导再生培养体系,以中梁22小麦幼胚和成熟胚为材料,分别在含不同浓度2,4-D的HB和MS培养基上进行组织培养,研究其对小麦幼胚和成熟胚愈伤组织形成的影响.结果表明:不同浓度2,4-D的处理之间存在显著差异,浓度为0.5mg/L的2,4-D的诱导率最高达到78.6%,有利于形成胚性愈伤组织;不同培养基之间差异显著,HB培养基的诱导率高于MS培养基;不同外植体之间差异不显著.
小麦;幼胚;成熟胚;愈伤组织
小麦作为重要的粮食作物,在世界范围内的种植面积和总量均超过其他农作物,在我国小麦的种植面积和总产量仅次于水稻.小麦蛋白质含量可达其干重的10%,是人类蛋白质的主要摄入来源.但在小麦的生产过程中,因不断受到生物、非生物等因素的胁迫,严重影响了其产量和品质.随着现代生物技术的发展,应用基因工程技术对小麦进行品种改良越来越受到重视.自20世纪80年代人们开始研究转基因植物以来,利用转基因等生物技术对小麦进行抗虫、抗病、抗逆及品质改良等方面已取得较大进展.[1]但在小麦组织培养体系中,外植体离体再生频率低,因此研究小麦组织培养条件和植株再生频率的影响因素仍然是小麦转基因育种技术的重要课题之一.近年来,研究者对影响小麦组织培养的因素如基因型、外植体来源、培养基类型及成分等进行了大量的研究.[2-12]研究表明,2,4-D是诱导禾本科植物体细胞发生的重要因素[13],不同的外植体和培养基同样也影响着小麦愈伤组织的诱导.[14]本文对天水地区主栽小麦品种中梁22号的幼胚和成熟胚进行了组织培养,研究了不同外植体、培养基和激素对愈伤组织诱导的影响,目的在于为小麦育种寻求较好的转基因受体并建立成熟的小麦再生体系奠定基础.
1 材料与方法
1.1 材料
供试材料为中梁22号,天水市农科所中梁站提供.
1.2 方法
1.2.1 成熟胚愈伤组织的诱导
将选好的小麦种子用无菌水洗5~8遍后在室温下浸泡约12h,在超净工作台上用70%酒精将泡好的种子浸10s后用无菌水洗3遍,再用0.1%的HgCl2灭菌15min后用无菌水洗5遍.用解剖刀将处理好的小麦放入预先灭完菌的培养皿中剥取胚,移胚时将胚夹破,盾片朝上分别接入诱导愈伤组织培养基中培养.培养室温度为25℃,光源为日光灯,每天光照12h,诱导愈伤组织时用散射光.[15]
1.2.2 幼胚愈伤组织的诱导
取开花15d左右的小麦幼穗放入预先灭完菌的空锥形瓶中用70%的酒精浸泡20s,倒出酒精用无菌水冲洗3次后再用HgCl2泡5min,最后用无菌水冲洗3遍.用镊子或解剖针剥开叶鞘取出幼胚,盾片朝上接于诱导培养基上进行暗培养.
1.3 培养基
本实验采用的是MS培养基和HB培养基,每种培养基均添加0.5mg/L、2.0 mg/L和3.0 mg/L3个不同浓度水平的2,4-D,共六种培养基.
1.4 统计方法
愈伤组织诱导率计算公式:愈伤组织诱导率=(诱导愈伤组织数/离体胚数)×100%.
利用最小差数检验法和t检验法处理实验数据.
2 结果与分析
2.1 不同外植体对小麦愈伤组织诱导的影响
小麦幼胚愈伤组织在接种6d后长出愈伤组织,诱导出的愈伤组织在形态上主要有两种类型:一种为白灰色水浸状愈伤组织,较少;另一种为淡黄致密型胚性愈伤组织,居多.成熟胚接种2d后,离体胚有出芽现象;4d后大多数离体胚都能看到明显的半透明状的愈伤组织.虽然小麦幼胚的诱导率高于小麦成熟胚的诱导率(见表1),但方差结果表明小麦幼胚与成熟胚愈伤组织诱导率的差异并不显著(见表2).

表1 不同外植体对小麦愈伤组织诱导的影响
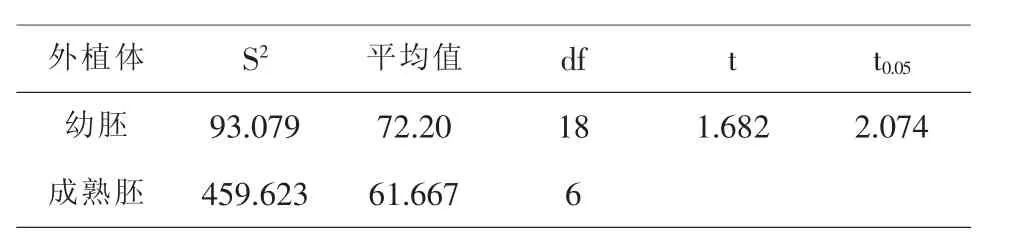
表2 不同外植体对小麦愈伤组织诱导影响的t检验结果
2.2 2,4-D对小麦愈伤组织诱导的影响
由表3可知,培养基中添加的2,4-D浓度不同,愈伤组织的类型、质地、颜色和生长状况等都有较大差异;浓度为0.5mg/L的2,4-D培养基诱导率最高.通过最小显著差数法比较(见表4)可知,浓度为0.5mg/L的2,4-D的诱导率最高,浓度为2.0mg/L和3.0mg/L的2,4-D培养基之间差异不显著.
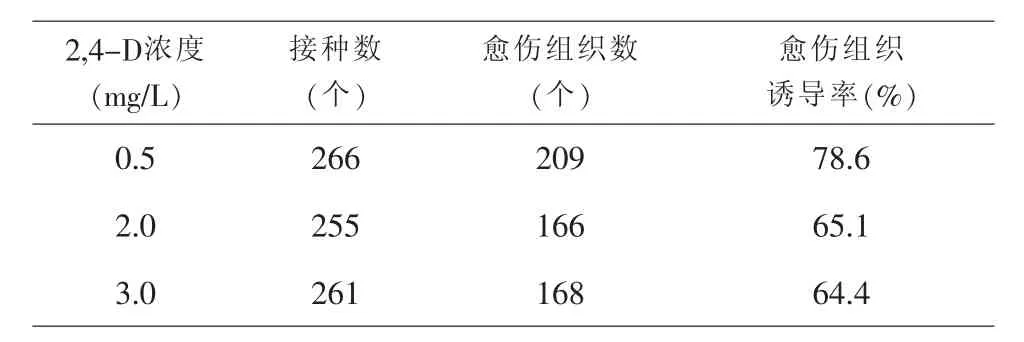
表3 不同2,4-D浓度对小麦愈伤组织诱导的影响
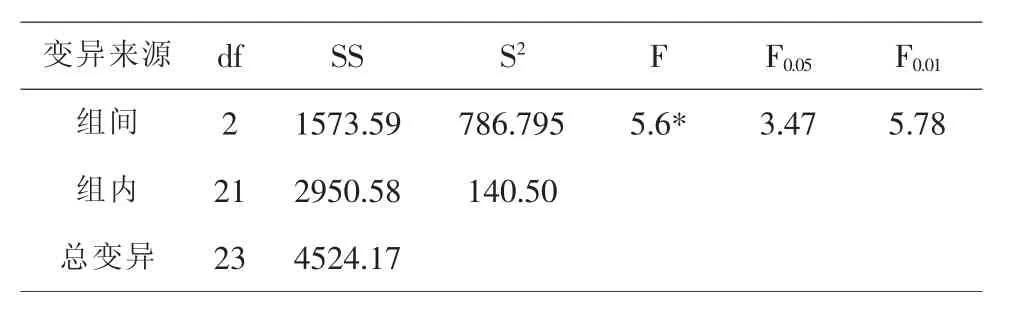
表4 不同2,4-D浓度对小麦愈伤组织诱导影响的方差分析表
2.3 不同培养基对小麦愈伤组织诱导的影响
由表5和表6可知,HB培养基和MS培养基对小麦愈伤组织诱导有显著差异.实验中发现,在HB培养基上,不论是小麦幼胚还是成熟胚均大约在2~5d左右即可诱导产生愈伤组织,而在MS上则需要大约8~9d才可诱导产生愈伤组织;所产生的愈伤形态主要有淡黄致密和白至灰色松软两种;在同一种培养基上,不同外植体的愈伤组织诱导率和愈伤组织的质量相差不大.

表5 不同培养基对小麦愈伤组织诱导的影响

表6 不同培养基对小麦愈伤组织诱导的影响的方差分析表
3 讨 论
3.1 小麦愈伤组织诱导外植体的选择
愈伤组织的诱导和增殖主要依赖于外植体本身、培养基和培养条件三方面因素的共同作用.在目前的组织培养技术条件下,选择适宜的外植体和培养基是主要的研究内容.其中在外植体的选择方面,除基因型之外,外植体的生长发育阶段和生理状态是人们较难控制的,因而对外植体的筛选是植物组织培养中的关键技术.目前,诱导小麦胚性愈伤组织的外植体包括幼胚、幼穗、花药、成熟胚等,其中幼胚因其具有容易产生胚性愈伤组织且再生能力较强等优点而得到了广泛应用.[16]成熟胚与幼胚相比,虽然愈伤组织的芽分化频率较底,但因其易于获取,不受季节植株发芽时期的限制,具备取材方便、操作简单、愈伤组织成长快和一次成苗率高等特点已得到广泛的研究和应用.[17-19]
本研究发现,幼胚比成熟胚易于诱导,这是由于幼胚组织比较幼嫩,接近于胚性细胞,因此更加容易脱分化.但小麦幼胚愈伤组织的褐变现象较严重,其可能有两方面的原因:一是半透明状的愈伤组织含水量大,在转移过程中容易造成机械损伤;二是培养基中的激素成分对愈伤组织造成了一定伤害.[15]同时,小麦幼胚的生长发育阶段和生理状态也会对愈伤组织的诱导、增殖和愈伤组织的质量产生重要影响.本实验还发现,在成熟胚愈伤组织的诱导过程中,把成熟胚夹破有助于愈伤组织的形成.
3.2 2,4-D浓度在小麦愈伤组织诱导中的确定
2,4-D是大多数植物离体培养诱导愈伤组织最有效的物质,它能诱发细胞分裂活动,引起细胞脱分化和无序增殖,产生愈伤组织.在以前的研究报道中,大多数认为2.0mg/L的2,4-D是小麦成熟胚和幼胚诱导愈伤组织的适宜浓度.[20-22]而通过本实验表明,0.5mg/L的2,4-D对小麦愈伤组织的诱导率最高,这和赵永英等人对郑麦9203胚性愈伤组织诱导的研究结果是一致的.[11]通过方差分析表明,三种浓度的2,4-D对小麦愈伤组织出愈数的影响显著,而2mg/L与3mg/L的2,4-D对小麦愈伤组织诱导的影响差异并不显著,这也许与小麦的基因型有关。因此,确定适宜的外源激素及其浓度对小麦愈伤组织的影响还有待于进一步的研究.
3.3 不同培养基对小麦愈伤组织诱导的影响
由于不同培养基所含的各种营养成分和激素种类有所不同,从而直接地影响着愈伤组织的形成、增殖和愈伤组织的质量.因此,必须根据所需诱导的外植体选择相应的培养基.本实验结果表明,在诱导效果上,不论是幼胚还是成熟胚的愈伤组织的诱导,在HB培养基诱导的愈伤组织生长快、体积大、色泽鲜润,质量、生长量等指标均优于MS培养基诱导的愈伤组织.
3.4 其他因素对小麦愈伤组织诱导的作用
在组织培养中,避免污染是获得理想结果的关键.因此,接种和培养都要求在严格的无菌条件下操作.在本实验中,出现了一些染菌情况,且多为霉菌和细菌.此外,盾片的接入方式也会影响愈伤组织诱导率和愈伤组织的质量,并会对分化产生一定的影响.
总之,小麦愈伤组织的诱导是一个复杂的连续的体系,针对某一个方面进行单一因素的研究势必要受到其他因素的影响.因此,在今后的相关研究中,应该综合考虑多种因素对小麦愈伤组织的诱导率和胚性愈伤组织形成的影响.
[1] 赵慧,徐萍,牛灿芳.小麦转基因研究现状及展望[J].科学前沿与学术评论,2005,27(3):32-36
[2] 梁静静,吕德彬,陈军营,等.不同基因型对小麦成熟胚愈伤组织诱导及植株再生的影响[J].河南农业大学学报,2003,37(2):107-114.
[3] 李根英,黄承彦,隋新霞,等.小麦不同外植体的组织培养研究[J].麦类作物学报,2006,26(1):21-25.
[4] 孙果忠,马民强.一种适于小麦愈伤组织诱导与继代培养的培养基[J].河北农业科学,1996,3(2):24-26.
[5] 尹钧,任江萍,宋丽,等.小麦不同转基因受体材料的植株再生研究[J].麦类作物学报,2004,24(2):1-4.
[6] 蔡黎明.小麦单倍体幼胚离体培养研究[J].中国农学通报,2006,22(7):313-315.
[7]SHOHAEL AM,AKANDA MAL,PARVEZ S,et al.Somatic embryogenesis and plant regene-ration from immature embryo derived callus of inbred maize(ZeamaysL.)[J].Biotechnology,2003,2(2):154-161.
[8] AN H L,WEI Z M,HUANG J Q.High efficiency regeneration of wheat plants from immature embryos[J].Acta Phytophysiol.Sin,2000,26(6):532-538.
[9] CASWELL K L.An efficient method for in vitro regeneration from immature inflorescence explants of Canadian wheat cultivars[J].Plant Cell,Tissue and Organ Culture,2000,60(1):69-73.
[10]孙岩.提高小麦幼胚组织培养效果的初步研究[J].黑龙江农业学,2004,(1):25-27.
[11]赵永英,李翠香,苗红梅.影响小麦组织培养效率的重要因素研究[J].河南农业科学,2007,(1):23-26.
[12]PATNAIK D,KHURANA P.Genetic transformation of Indian bread(T.aestivum)and pasta(T.durum)wheat by particle bombardment of mature embryo-derived calli[J].BMC Plant Biology,2003,3(5):461-471.
[13]伍碧华,郑有良,周永红,等.四川小麦幼胚脱分化特性研究[J].麦类作物学,2001,(2):25-30.
[14]刘香利,刘缙,郭蔼光,等.小麦幼穗的离体培养及其影响因素研究[J].西北农林科技大学学报,2007,35(2):79-82.
[15]杨淑慎,郭振,徐虹.小麦胚愈伤组织的诱导和植株再生[J].西北农业学报,2002,11(4):46-48.
[16]范学科,王亚红,奚亚军,等.小麦幼胚愈伤组织诱导影响因素的研究[J].农业生物技术科学,2007,(11):68-71.
[17]MARIA G,HEIDI F.Auxin and sugar effects on callus induction and plant regeneration frequencies from mature embryos of wheat[J].In Vitro Cellular&Developmental Biology,2002,38(1):39-46.
[18]何勇刚,郭振,徐虹.小麦胚愈伤组织的诱导和植株再生[J].西北农业学报,2002,(4):46-48.
[19]贺杰,常景玲.小麦成熟胚愈伤组织的诱导及植株再生体系的研究[J].安徽农业科学,2007,35(5):1280-1281.
[20]周淼平,黄益洪.低浓度2,4-D及外源激素诱导小麦体细胞快速成苗[J].江苏农业学报,2000,16(3):139-142.
[21]谷立坤,张建云,张世敏,等.不同质量浓度2,4-D对硬粒小麦成熟胚愈伤组织诱导及植株再生的影响[J].河南农业大学学报,2004,12(4):452-455.
[22]赵占军,陈茂盛,王贵娟.胚龄和激素对小麦幼胚组织培养的影响[J].生物技术,2003,5(7):7-8.
S512.1+1
A
1671-1351(2011)02-0033-03
2010-08-22
邹亚丽 (1971-),女,甘肃天水人,天水师范学院生命科学与化学学院讲师,硕士.
天水师范学院科研基金资助项目“小麦转β-1,3-葡聚糖酶及几丁质酶基因抗条锈的研究”(TSA0624)阶段性成果
〔责任编辑 马旭光〕
