海洋枯草芽孢杆菌HS-A38产直链脂肽活性物质的初步检测
2011-01-11丛丽娜侯英敏李爱民谢三群
张 欢, 丛丽娜, 侯英敏, 李爱民, 谢三群, 王 丹
(大连工业大学, 辽宁 大连 116034)
海洋枯草芽孢杆菌HS-A38产直链脂肽活性物质的初步检测
张 欢, 丛丽娜, 侯英敏, 李爱民, 谢三群, 王 丹
(大连工业大学, 辽宁 大连 116034)
从海参肠道中分离得到了一株海洋枯草芽孢杆菌(Bacillus subtilis)HS-A38, 将其发酵上清液经盐酸沉淀、有机溶剂萃取得到具有广谱抗菌活性的代谢物质。采用薄层层析和茚三酮显色检测到4种物质, 分别命名为化合物1、2、3和4; 应用层析板覆盖指示菌的生物自显影技术对其抗菌活性成分进行追踪、检测, 结果发现化合物1和2具有显著抑制弧菌的作用。进一步检测分析表明, 化合物1、2和 4具有很强的热稳定性, 初步推断它们属于直链的脂肽类化合物, 并且这 4种物质出现在不同的发酵代谢时期, 这将为研究群体效应提供基础检测依据。
枯草芽孢杆菌(Bacillus subtilis); 抗菌活性; 生物自显影; 直链脂肽化合物
枯草芽孢杆菌(Bacillus subtilis)能够产生多种抗菌代谢产物, 被认为是具有潜在的、能有效抑制病原菌并促进动植物生长的有益菌[1], 具有很高的农用及医用价值[2]。近年来, 微生态制剂的研究日益受到重视, 关于水产养殖中有益菌抑菌特性的研究也陆续有见报道。储卫华等[3]将海洋致弧菌(Bdellovibrio)应用于南美白对虾养殖中疾病的防治,发现该菌能有效预防虾弧病的发生。郭秀春等[4]研究证明了海绵共栖细菌 NJ6-3-1的代谢物质与种内和种间存在群体感应调控系统。因此, 研究该类菌的抑菌成分, 了解代谢物分泌的基本特点, 这对从水产养殖安全角度考虑利用微生物之间的拮抗作用, 以及探索代谢物产出的生物群体效应研究具有重要意义。
目前已知的枯草芽孢杆菌大多产生环脂肽类(Cyclic lipopeptides)的抗菌物质, 包括枯草菌表面活性素(Surfactin)、伊枯草素(Iturin)和芬枯草素(Fengycin), 这些环肽物质在茚三酮染色前需要酸水解才能显色, 而对于直链的脂肽类物质则可以用茚三酮直接显色[5,6]。目前对于直链脂肽类抗菌物质的报道很少见。本实验室近年来从海参肠道中筛选得到一株枯草芽孢杆菌HS-A38, 本研究首先检测了该菌株活性粗提物质的抑菌谱; 应用薄层色谱(TLC),茚三酮直接染色和生物自显影技术, 检测到其中的4种物质能与茚三酮直接显色, 而且其中的两种化合物具有明显的抑菌效果。接着检测了这 4种物质的温度耐受性和它们产生的代谢时期。这些结果将为下一步活性物质的纯化分析和结构确定, 以及生物种内的群体效应的研究提供翔实依据。另外, 该海洋枯草芽孢杆菌 HS-A38的研究和开发, 为今后在水产养殖中生产安全有效的益生菌打下应用基础。
1 材料和方法
1.1 材料
1.1.1 供试菌株
枯草芽孢杆菌(Bacillus subtilis)HS-A38为实验室自行分离, 其16S rDNA序列在GenBank的检索号为GQ 466597。
供试指示菌: 金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtili)、溶壁微球菌(Micrococcus lysodeikticus)、志贺菌(Shigellaspp.)、大肠杆菌(Escherichia coli)、副溶血性弧菌(Vibrio parachaemolyticus), 均由本实验室保存。
1.1.2 培养基
菌株 HS-A38发酵培养基: 葡萄糖 5 g/L, 豆粕粉12 g/L, 尿素1 g/L, 酵母膏0.6 g/L, K2HPO44 g/L,ZnSO40.09 g/L ; pH 7.2~7.4。
指示菌液体培养基: 牛肉膏 3 g/L, 蛋白胨10 g/L, 氯化钠 5 g/L, pH 7.2~7.4。
指示菌固体培养基: 在指示菌液体培养基中另加入1.5%~2.0%的琼脂粉。
1.1.3 主要试剂和仪器
茚三酮、氯化三苯基四氮唑(TTC), 均购自国药集团化学试剂有限公司, 其他试剂均为进口或国产分析纯。E41型紫外扫描仪, 清华紫光股份有限公司;TLC分析板(20 cm×20 cm silica gel 60F254, 德国Merck公司); 制备型硅胶板(10 cm×5 cm, 0.5 mm,青岛海洋化工有限公司)。
1.2 方法
1.2.1 菌株HS-A38抗菌粗品的制备
将菌株HS-A38种子液按5%的接种量分别接入5个 1 L摇瓶中, 装液量为 200 mL, 共 1 000 mL,30℃、摇床转速160 r/min下培养48 h后, 将发酵液8 000 r/min离心20 min除去菌体, 上清液用6 mol/L HCl调至 pH 2.0, 放置于 4℃冰箱中过夜; 然后8 000 r/min离心10 min收集沉淀, 用甲醇充分溶解沉淀, 过滤得棕色液体提取物, 接下来蒸干该提取物, 再用丙酮洗涤3次, 得到黄色液体产物; 再浓缩该产物后用饱和正丁醇萃取 3次, 最后取出正丁醇层, 浓缩后得到浅棕色固粗提物体, 即抗菌物质。
1.2.2 菌株HS-A38抗菌粗品的抑菌谱测定
采用纸片扩散法测定菌株 HS-A38抗菌粗品对指示菌的抗菌活性。分别在平板上接种不同的病原指示菌, 涂布均匀, 然后在上面放上无菌滤纸片, 再向纸片上加入过滤除菌的粗品水溶液 20 µL, 并以无菌水作空白对照。经37℃培养 24 h后, 用游标卡尺测定平板上出现抑菌圈的直径。做3次平行试验,取平均值。
1.2.3 菌株 HS-A38抗菌粗品的茚三酮和生物自显影分析
称取0.1 g活性粗提物溶解于2 mL的甲醇, 各取5 μL点样于两块TLC分析板上, 分别同时在展层缸中展开(氯仿: 甲醇: 水=65: 25: 4); 干燥后, 其中一块薄板用 0.5%茚三酮水溶液直接染色, 高温吹干显色, 扫描并保存。另一块采用生物自显影技术[7,8], 并针对本实验的特点进行方法改良: 即将薄板置入紫外灯下灭菌 20 min, 然后放入无菌培养皿中, 再将一定浓度的弧菌菌悬液均匀涂布在上面, 37℃培养18 h, 再在薄板上喷上无菌的 0.005%TTC溶液, 接着继续培养3~4 h, 观察显影斑点并照相。
1.2.4 化合物1和2的分离及活性检测
为了分离大量的活性化合物1和2, 采用制备型层析板制取技术。取上述粗提物质甲醇溶解液 100 μL, 点样在制备板上, 每点取10 μL; 该板经展开剂(氯仿: 甲醇: 水=65: 25: 4)展开后, 干燥; 以其中一个点样的茚三酮显色区域为标准, 确定化合物1和2的位置, 再将与此斑点对应的制备板区域的硅胶刮取出来, 用甲醇充分溶解, 离心除去硅胶粉, 得到待检测的活性物质。将该提取物分别点样于两块 TLC板, 用原粗提物甲醇溶解液作为对照, 展层后干燥,其中一块板经 0.5%茚三酮水溶液染色, 高温显影,照相并保存, 另一块板采用上述生物自显影技术显影检测活性。
为了进一步验证化合物1和2是否具有活性, 分别将这两种化合物的甲醇溶解液过滤除菌, 然后自然挥发甲醇, 得到的化合物 1和2再用无菌水溶解;接着采用平板对峙法检测其活性[9]: 即在均匀涂布含弧菌的平板上, 放置 0.8 cm灭过菌的滤纸片, 在滤纸片上滴加15 μL的活性样品1和2, 并以无菌水为对照, 37℃培养24 h后观察是否出现抑菌圈。
1.2.5 脂肽类物质温度耐受性的检测
取上述粗提物的甲醇溶解液各 100 μL, 加入 5支无菌 EP管中, 分别置于 40、60、80、100℃保温30 min, 余下的一支管放入灭菌锅, 经1×105Pa灭菌20 min。然后, 每样取15 μL点样于TLC板上, 以未处理的样品为标准, 展层干燥后再茚三酮染色显影。根据显影情况推断 4种脂肽类物质对温度的耐受性。
1.2.6 脂肽类产物发酵代谢时期的测定
将斜面保存的HS-A38菌种接种到30 mL液体培养基, 30℃、160 r/min振荡培养16 h。培养液经8 000 r/min离心20 min, 收集菌体。用20 mL无菌生理盐水稀释该菌体, 然后取稀释的菌体液按照5%的接种量接种于50 mL的液体发酵培养基中, 30℃,160 r/min振荡培养19 h。之后每隔3 h取样6 mL, 其中1 mL用稀释涂布法测各样品的菌体浓度, 以绘出HS-A38的生长曲线; 剩下的5 mL发酵液样品, 按照1.2.3的方法萃取得到含活性物质的正丁醇萃取液,然后点样于 TLC分析板, 展层干燥后茚三酮显影,以检测4种脂肽类物质分泌产生的发酵时段。
2 结果与分析
2.1 菌株HS-A38抗菌粗品的抑菌谱
采用纸片法对菌株 HS-A38 的粗体物水溶液进行抑菌谱实验。抗菌活性结果(表1)表明, 该粗提物质对革兰氏阳性菌金黄色葡萄球菌、志贺菌、枯草芽孢杆菌和溶壁微球菌均有很强的抑制作用, 并且对革兰氏阴性菌大肠杆菌和副溶血性弧菌也具有较好的抑菌作用。

表1 菌株HS-A38粗品的抑菌活性Tab. 1 Antimicrobial activity of the crude extract from Strain HS-A38
2.2 茚三酮染色和生物自显影分析
根据化合物 N端的游离氨基酸能与茚三酮发生颜色反应, 实验首先采用茚三酮染色直接显影技术。结果如图1所示, 共有4个斑点, 将各斑点对应的物质分别命名为化合物1、2、3和4。根据枯草芽孢杆菌代谢产物的报道, 初步推断这 4种物质为直链的肽类化合物[10]。为了验证这 4种物质是否具有生物活性, 采用生物自显影技术跟踪, 以 TTC溶液作为检测指示菌活细胞的生物显色剂, 即一定浓度的TTC和活菌体内的琥珀酸脱氢酶反应, 生成红色的还原产物, 使菌落变红色[11]。通过抑菌斑点检测这些化合物在层析板上的位置及活性大小。结果发现, 在A到B区间内有明显的抑菌斑点, 而A与 B区间对应的为化合物 1和 2(图2)。因此初步推断, 化合物1和2即为活性成分。
2.3 化合物1和2的分离及活性检测
为了确定化合物1和2是否具有抗菌活性, 采用制备型层析板, 得到化合物质1和2。再用甲醇溶解样品, 经TLC检测, 分离结果如图3所示。在TLC板上能明显观察到化合物1和2的单一斑点, 这说明这两种物质已得到了很好的分离; 另一块板再经生物自显影检测化合物1和2的抑菌活性, 结果如图4所示。化合物1和2点样的b和c泳道均出现了抑菌斑点, 表明这两种物质确实有生物活性存在。
为了进一步验证自显影技术的可靠性, 再采用纸片法检测并验证化合物的活性。以弧菌作为指示菌, 将化合物1和2滴加在无菌的滤纸片上, 培养一段时间后, 这两种物质各自的周围均出现了抑菌圈(图5)。从而表明化合物1和2确实具有抗菌活性, 而且生物自显影技术能够直接检测到活性物质的位点。

图1 菌株HS-A38粗提物质TLC图谱Fig. 1 TLC of the crude extract of Strain HS-A38
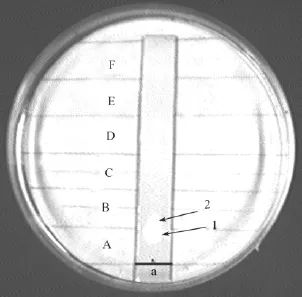
图2 菌株HS-A38粗提物质生物自显影Fig. 2 TLC-Bioautography of the crude extract of Strain HS-A38
2.4 脂肽类物质温度耐受性的影响
在确定了活性物质在TLC板上的迁移率和显影特点后, 采用 TLC法检测活性物质经不同温度处理后的显影情况。如图 6所示, 对比未处理过的样品a, 各样品在经过40、60、80、100℃处理后, 活性物质1和2、化合物3和4仍然能够保持显影特性, 这说明大部分的脂肽类物质具有很好的抗热性; 同时, 样品在 121℃高温高压处理后, 仅有物质 3的显影消失,活性物质1和2、化合物4的显影斑点只是变浅, 说明大部分的脂肽类物质还具有耐高温和高压力的特性。

图3 化合物1和2的TLC图谱Fig. 3 TLC of the active substances
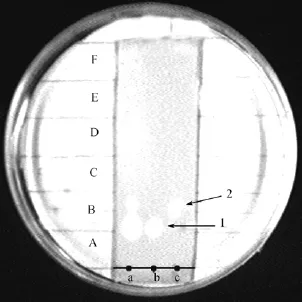
图4 化合物1和2的生物自显影Fig. 4 TLC-Bioautography of the active substances
2.5 脂肽类物质发酵代谢时期分析
通过TLC板检测和分析菌株HS-A38发酵产生活性物质和代谢时期的关联性。根据测定的菌株HS-A38部分生长曲线(图 7)和对应的不同时期发酵液活性物质检测的TLC图谱(图8), 可知活性物质1和 2出现在发酵生长的末期, 因此它们属于次级代谢产物; 而化合物3出现在发酵的对数期末期, 化合物 4出现在发酵稳定期, 因此这两种化合物均属于初级代谢产物。实验表明, 应用 TLC技术和茚三酮显影可以直接检测到直链化合物的分泌时期, 这将为后期的代谢物群体效应的研究提供检测依据。
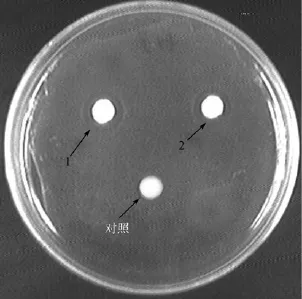
图5 化合物1和2对副溶血弧菌的抑制作用Fig. 5 Antimicrobial activities of the compounds 1 and 2 against V. parachaemolyticus
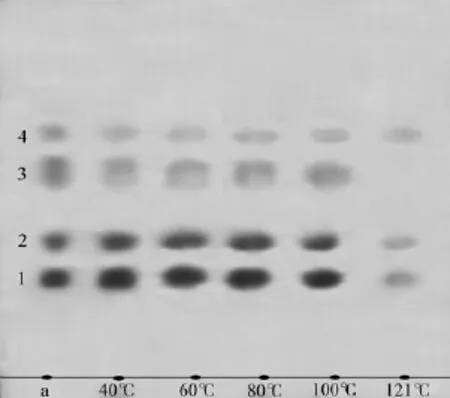
图6 温度对脂肽类物质的影响Fig. 6 Effect of temperature on the liner lipopeptides
3 结论与展望
菌株 HS-A38分离来自海参肠道, 属于枯草芽孢杆菌(B. subtilis), 其发酵液通过盐酸沉淀、有机溶剂萃取分离, 采用茚三酮直接染色, 发现4种化合物,并应用生物自显影技术快速跟踪、检测, 发现两个具有抗弧菌的活性物质1和2。这4种物质能与茚三酮直接显色, 表明其结构上含有游离的氨基酸, 初步说明它们是线性的脂肽类化合物。进一步研究表明这类化合物对温度耐受性高, 这一点在对化合物进行加工过程中因加热而减少损失极为有利。近年来,关于耐药基因的报道使人们越来越关注和意识到水产和畜牧业中细菌抗药性的产生直接威胁了人类健康和生命安全[12]。本实验产生菌来自可食用的生物活体体内, 具有安全, 可靠的特点, 而且属于水产有益菌常见芽孢杆菌属, 并表现出广谱的抗菌活性,因而是具有很大潜能的有益菌。在研究代谢物质产生与发酵时期的关联性时, 发现其中化合物3和4出现在发酵对数期, 而活性物质出现在发酵末期, 这可能存在一种群体感应信号刺激代谢物的产生, 这一类研究群体种内和种间与抗菌代谢物分泌效应的调控机制已成为现在研究的热点[13]。本次实验找到了一种跟踪活性物质发酵代谢的检测方法, 这将为进一步的提取和检测提供依据。

图7 菌株HS-A38生长曲线Fig. 7 Growth curve of Strain HS-A38
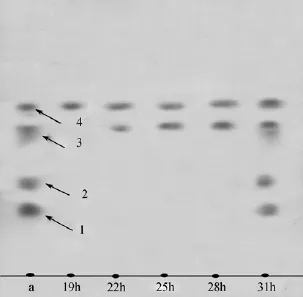
图8 脂肽类物质代谢时期TLC检测Fig. 8 TLC detection of liner lipopeptides at various fermentation stages
[1]Bais HP, Fall R, Vivanco J M. Biocontrol ofBacillus subtilisagainst infection of arabidopsis roots by pseudomonas syringae is facilitated by biofilm formation and surfactin production [J]. Plant Physiol, 2004,134(1): 307-319.
[2]Stein T.Bacillus subtilisantibiotics: structures, syntheses and specific functions [J]. Mol Microbiol, 2005,56(4): 845-857.
[3]储卫华, 朱卫, 康春涛. 海洋致弧菌的分离鉴定及其对副溶血弧菌的作用[J]. 微生物学通报, 2009, 36(1):20-24.
[4]郭秀春, 郑立, 崔志松, 等. 海绵共栖细菌 NJ6-3-1基于群体感应调控的抗菌活性[J]. 微生物学报, 2008,48(4): 545-550.
[5]侯红漫, 靳艳, 金美芳, 等. 环脂肽类生物表面活性剂结构、功能及生物合成[J]. 微生物学通报, 2006,33(5): 122-128.
[6]裴炎, 李先碧, 彭红卫, 等. 抗真菌多肽 APS-1的分离纯化与特性[J]. 微生物学报, 1999, 39(4): 344-349.
[7]Zhang Y, Mu J, Gu X, et al. A marine sulfate-reducing bacterium producing antibiotics: biological and chemical investigation [J]. Mar Drugs, 2009, 3: 341-354.
[8]何佳, 赵启美, 陈钧. 利用二维生物自显影技术快速检测追踪金钱松内生真菌抗细菌活性成分[J]. 食品科学, 2008, 29(2): 252-256.
[9]邱服斌, 李雁津, 张晓霞, 等. 人参内生细菌ge21菌株的鉴定及抑菌活性测定[J]. 微生物学通报, 2010,37(1): 43-47.
[10]白士茂. 氯化三苯基四氮唑对细菌生长指示的适用性研究[J]. 浙江实用医学, 1997, 2: 12-13.
[11]赵秀香, 赵柏霞, 马镝, 等. 枯草芽孢杆菌 SN-02抑菌物质的分离、纯化及结构鉴定[J]. 植物保护学报,2008, 35(4): 322-326.
[12]Schwarz S, Kechrenberg C, Walsh TR. Use of antimicrobial agents in veterinary medicine and food animal production [J]. Int J Antimicrob Agents, 2001, 17(6):431-437.
[13]郭鹏飞, 张海涛, 张卫, 等. 共培养海绵微生物诱导抗菌活性物质的研究[J]. 微生物学通报, 2006, 33(1):33-37.
Antimicrobial activity of liner lipopeptides produced byBacillus subtilisHS-A38
ZHANG Huan, CONG Li-na, HOU Ying-min, LI Ai-min, XIE San-qun, WANG Dan
(Dalian Polytechnic University, Dalian 116034, China)
Oct., 11, 2010
Bacillus subtilis; antimicrobial activity; bioautography; liner lipopeptides
A marineBacillus subtilisstrain HS-A38 was isolated from the sea cucumber intestine. The crude extract of fermentation broth was prepared by methods of hydrochloric acid precipitation and solvent extraction. The extract showed broad-spectrum antimicrobial activity using the paper disc agar diffusion method.Four components, named as compound 1, 2, 3, and 4 were found by the thin layer chromatography and ninhydrin color printing. The compounds with antimicrobial activity were detected and tracked by bioautography ofVibrio parahaemolyticusand triphenyltetrazolium chloride (TTC) coloration on the plate of thin layer chromatography. Two inhibition spots were found, corresponding to compound 1 and 2. The further study showed that the compound 1, 2, and 4 were stable at high temperature. Therefore, it was preliminarily deduced that the four compounds were all straight-chain lipopeptide produced at different phase of fermentation.
S917.1
A
1000-3096(2011)08-0037-06
2010-10-11;
2011-03-02
国家自然科学基金项目(31072224) , 辽宁省教育厅创新团队资助项目(LT2010012); 辽宁省自然科学基金项目(20102009)
张欢(1984-), 男, 湖北孝感人, 硕士研究生, 研究方向:海洋微生物生物活性物质, E-mail: lsm52421@yahoo.com.cn; 丛丽娜,通信作者, E-mail: congln@dlpu.edu.cn
康亦兼)
