条斑紫菜叶状体不同区域光合活性的研究
2011-01-11杨睿灵乔洪金王广策潘光华
杨睿灵, 乔洪金, 周 伟,3, 王广策, 潘光华
(1. 天津科技大学 海洋科学与工程学院, 天津 300457; 2. 中国科学院海洋研究所 海洋生物学重点开放实验室, 山东 青岛 266071; 3. 江苏省海洋水产研究所, 江苏 南通226007)
条斑紫菜叶状体不同区域光合活性的研究
杨睿灵1, 乔洪金2, 周 伟2,3, 王广策2, 潘光华1
(1. 天津科技大学 海洋科学与工程学院, 天津 300457; 2. 中国科学院海洋研究所 海洋生物学重点开放实验室, 山东 青岛 266071; 3. 江苏省海洋水产研究所, 江苏 南通226007)
以幼嫩条斑紫菜(Porphyra yezoensisUeda)为材料, 研究了叶状体基部到梢部组织的固碳率和光合活性的变化。结果表明: (1)基部到梢部不同区域组织的固碳率不同, 基部区域组织固碳率明显低于其他区域, 靠近梢部区域的固碳率最高; (2)基部到梢部不同区域的光合活性和叶绿素水平也不一样, 基部和梢部组织的光合活性偏低, 藻体中间部位组织的光合活性偏高, 叶绿素水平则表现出从基部到梢部逐渐减少的趋势。研究表明, 条斑紫菜基部梢部除外的中间区域离体组织成苗率较高。因此, 在进行条斑紫菜体细胞育苗时, 选择具有较高光合作用活性梢部以下到中部的组织细胞比较合适。
条斑紫菜(Porphyra yezoensisUeda); 叶状体; 固碳率; 光合活性
紫菜隶属于红藻门(Rhodophyta)红藻纲(Rhodophyceae)红毛菜亚纲(Bangiophycidae)红毛菜目(Bangiales)红毛菜科(Bangiaceae)紫菜属(Porphyra)。目前, 世界上约有 140种紫菜, 中国约有22种, 条斑紫菜(Porphyra yezoensisUeda)是常见的经济品种之一[1-4], 多生长在潮间带附近的岩礁上,主要分布在中国浙江舟山群岛以北的东海北部和黄、渤海沿岸、包括日本列岛和朝鲜半岛沿岸等, 是日本、韩国和中国长江以北紫菜人工栽培的主要种类。条斑紫菜蛋白质含量高(高达 36.31%), 脂肪含量低, 是一种质优价廉、营养丰富、味道鲜美的海洋绿色食品[5-6]。中国是紫菜的主要生产国之一, 年产量超过130 000 t(干质量), 年产值超过20亿美元[7];日本每年大约生产60 000 t紫菜(干质量)[8]。
在紫菜的养殖技术中, 后续兴起的体细胞育苗法指叶状体营养细胞(组织切块)在一定培养条件下,经过一系列的变化可直接产生出幼苗的方法, 有着育苗时间短、投资少、效益大的特点[9]。因此, 条斑紫菜体细胞育苗法有着潜在的广阔应用前景[10]。在紫菜体细胞育苗技术研究中, 刘忠松[11]认为应选择较小藻体作为苗种来源。因此, 深入研究幼嫩紫菜对紫菜养殖业的发展有着重要的作用。
高等被子植物不同的组织、器官甚至细胞中存在着极性, 使得细胞物质发生不均等分裂, 表现在不同轴向上的形态结构和生理生态的形态差异[12]。王秀玲等[13]的研究表明, 西瓜胚的合子第一次分裂是不均等分, 形成基细胞和顶细胞。在低等藻类植物中, 虽然由于藻类一般结构简单, 没有明显的组织分化[14], 但是有报道指出藻类组织细胞中存在着极性。Kropf[15]研究了墨角藻受精卵的极性问题, 他把墨角藻受精卵极性的诱导分为两个阶段, 轴向的选择和延伸。早在 1966年, 周百成等[16]发现, 条斑紫菜同一藻体不同部位间色素含量和光合作用存在差异性。杨晓玲等[17-18]报道了条斑紫菜叶状体基部到梢部在形态和颜色上都存在差异, 不同部位外植体的成活率、生长量、分化率均不同。由此可见, 条斑紫菜叶状体不同区域组织的细胞极性是普遍存在的。已有报道指出, 条斑紫菜叶状体不同区域的离体组织成苗率不同[19], 然而目前为止, 还没有相关报道指出造成藻体不同区域离体组织成苗率不同的原因。因此, 作者以幼嫩条斑紫菜为材料, 研究了叶状体基部到梢部 5个不同区域组织的固碳率和光合活性的变化, 研究其不同区域的光和作用能力特点,从而为深入研究条斑紫菜体细胞育苗技术提供一定的理论基础。
1 材料与方法
1.1 条斑紫菜的采集和培养
条斑紫菜叶状体采自山东青岛第二海水浴场的礁石上, 长度2~5 cm, 没有性细胞的分化。藻体采回后, 用过滤的海水洗净, 在阴凉通风处干燥至相对含水量为 20%左右[20], -20℃保存。实验前, 在过滤的海水中复苏培养保存的条斑紫菜。培养条件为: 温度 10℃; 光照强度 40 µmol/(m2·s); 光周期 12L:12D。2d换1次海水。
1.2 不同叶状体部位的固碳率的测定
挑选颜色大小一致的条斑紫菜叶状体, 用打孔器将叶状体不同区域组织(从根部至梢部分别为Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ区, 如图1所示)分别打出0.7 cm直径的圆片, 放入培养皿中, 然后加10 mL海水, 并迅速向其中添加 50 µL NaHCO3溶液(2.5 uCi), 并于700 lx光照下15℃保温30 min, 取出叶片放入5 mL管中, 酸化过夜后, 于40℃烘干, 加入3 mL液闪液计数, 测定叶状体不同区域位置的固碳率。

图1 条斑紫菜叶状体简图Fig. 1 Diagram of Porphyra yezoensis thalli
1.3 不同部位光合活性的测定
利用调制叶绿素荧光成像系统(IMAGING-PAM,Walz, Effeltrich, Germany)对条斑紫菜叶状体不同部位的光合活性进行测量。具体操作是: 将条斑紫菜叶状体暗适应15 min后, 置于Imaging-PAM的大探头配置的盒子里, 打开测量光(ML)测定本底荧光(F0); 打开光化光(AL)测定叶绿素荧光的光系统II的实际量子产量(Y(II))、相对电子传递速率(ETR)等其他参数。
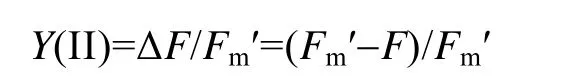
1.4 统计分析
在Microsoft Office Excel 2003中进行数据处理,进行均值、方差(STDEV)及差异性(TTEST)统计分析。
2 结果
2.1 叶状体不同部位固碳率分析
14C同位素跟踪观测条斑紫菜固碳率的结果显示(图 2): 不同区域的组织细胞固碳率不同。Ⅰ区细胞固碳率最低, 约为 6 µg/L, 与其他区域固碳率有显著差异(P<0.05)。Ⅳ区组织细胞固碳率最高, 超过了20 µg/L,极其显著地高于其他四个区域的固碳率(P<0.01)。Ⅱ区、Ⅲ区和Ⅴ区的细胞固碳率没有显著性差异(P>0.1),固碳量约12 µg/L, 处于Ⅰ区和Ⅳ区中间。
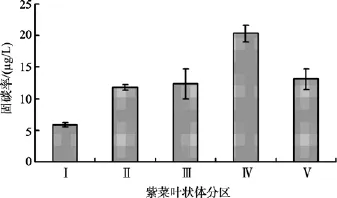
图2 条斑紫菜叶状体不同区域固碳率的变化Fig. 2 Variations of carbon fixation in different tissue areas in P. yezoensis
2.2 叶状体不同部位的光合活性变化
叶状体基部到梢部的F0值是逐渐减低的(图3)。Ⅰ区的F0显著高于其他任意一个区(P<0.01)。Ⅱ区的F0显著高于Ⅳ区和Ⅴ区(P<0.05); Ⅲ区的F0显著高于Ⅴ区(P<0.05)。Ⅱ-Ⅴ区之间相邻两个区域之间的F0则无显著性差异(P>0.05)。
光合活性的几种参数结果如图 3所示。从图 3可以看出, 条斑紫菜叶状体Ⅱ、Ⅲ和Ⅳ区实际量子产量Y(II)偏高于Ⅰ区和Ⅴ区。但是只有Ⅱ区、Ⅲ区的Y(II)与Ⅰ区有着显著性差异(P<0.05), 其余几个区域间则没有显著性差异(P>0.05)。条斑紫菜叶状体基部到梢部5个区域的潜在量子产量Fv/Fm都比Y(II)高。Fv/Fm在这几个区域间的差异性与Y(II)类似, 也是Ⅱ区、Ⅲ区和Ⅳ区偏高于Ⅰ区和Ⅴ区, 但差异性不大。
条斑紫菜叶状体光合活性参数F0、Y(II)和Fv/Fm的荧光变化如图 4所示, 从红色到紫色的颜色变化表示各个参数值从0到1的变化。叶状体的F0荧光值偏低(0.10左右), 颜色偏向红色。Y(II)的荧光为黄绿色, 荧光值约为0.35。Fv/Fm较Y(II) 的荧光强, 颜色为蓝绿色, 荧光值(0.40)也比Y(II)的高。从基部到梢部的变化来看, 这 3种参数的荧光颜色变化也不一样:F0从黄色逐渐变成红色;Y(II)从黄绿色逐渐变成橙色;Fv/Fm从亮绿色逐渐变成了黄绿色。
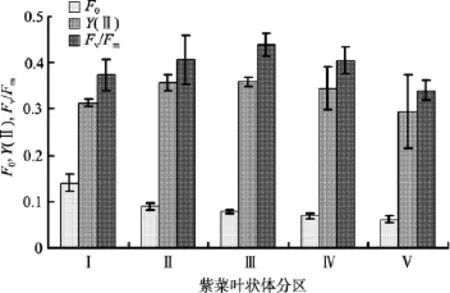
图3 条斑紫菜叶状体不同区域本底荧光F0、实际量子产量Y(II)和潜在量子产量Fv/Fm的变化Fig. 3 Variations of intrinsic fluorescence F0, the effective quantum yields of PSII, and the maximum quantum yields of PSII in different tissue areas in P. yezoensis

图4 条斑紫菜叶状体不同区域光合活性参数F0、Y(II)和Fv/Fm的荧光变化Fig. 4 Variations of fluorescence of F0, Y(II), and Fv/Fm in different tissue areas in P. yezoensis
3 讨论
在植物界中, 普遍存在着极性的实例, 如植物的幼苗和根的垂直分布的不同, 又如细胞、组织或器官的不同生理和生化特点[21]。关于藻类, 也有学者报道了藻体的极性问题[15,19]。
本实验固碳率的结果表明, 同一条斑紫菜叶状体不同区域具有不同的固碳能力(图 2): 基部(Ⅰ区)区域的固碳能力显著(P<0.05)低于其他4个区域; 靠近梢部的Ⅳ区与其他区域相比, 有着显著高的固碳能力(P<0.01); 处于中间区域的Ⅱ区、Ⅲ区和Ⅴ区的固碳能力在5个区域中也处于中间水平。梅俊学等[19]研究认为, 不同区域的离体组织成苗情况不一样; 除了基部外, 其他4个区域的组织块均能产生健康苗, 但是梢部的成苗率较低; 基部与梢部中间的 3个区域组织块成苗率也不一样, 距离基部越远的区域成苗率越高。因此, 我们推测, 细胞固碳能力的高低可能和成苗率的高低存在一定的关系, 组织细胞高的固碳能力可能是可能是其离体组织高成苗率的一个原因。
近几年来, 调制叶绿素荧光仪(PAM)以快速、便捷和对研究材料无损伤等特点, 受到越来越多学者的青睐[22-25]。Imaging-PAM 是一种新型的调制叶绿素荧光仪, 它可以检测得出各种参数的荧光成像。利用Imaging-PAM测定条斑紫菜叶状体不同区域的光合活性显示(图3),Y(II)和Fv/Fm代表PSII的实际和最大量子产量, 表示其光和作用活性, 从图3看出, 基部和梢部的Y(II)和Fv/Fm值偏低, 表明它们的光合活性偏低, 这一结果和基部和梢部较低的固碳能力结果一致(图2)。本底荧光F0和叶绿素水平相关,F0从基部到梢部的变化趋势表明, 基部的叶绿素水平较高, 离梢部越近, 叶绿素水平越低(图3)与杨晓玲等[17]的结果一致。三种参数的荧光成像(图4)则直观的表明了条斑紫菜叶状体不同区域光合活性和叶绿素水平的差异。
综上所述, 条斑紫菜叶状体不同区域组织的光和作用能力同样存在着极性。中部到梢部以下区域组织较高的固碳能力和光合作用活性, 说明了其较高的光合作用能力。梅俊学等[19]研究发现, 中部到梢部以下区域组织的再生苗成苗率较高, 这一结果和我们的结果相对应。因此, 我们推测, 条斑紫菜叶状体离体组织再生苗的成活率的高低可能取决于其光合作用活性的高低, 生产中可以选择较小条斑紫菜藻体具有较高光合作用活性的梢部以下到中部的区域组织获取体细胞苗源[19]。
[1]张学成, 马家海, 秦松, 等.海藻遗传学[M].北京:中国农业出版社, 2005:185-186.
[2]Yoshida T, Notoya M, Kikuchi N, et al.Catalogue of species ofPorphyrain the world, with special reference to the type locality and bibliography [J].Natural History Research (special issue), 1997, 3: 5-18.
[3]Silva P C.Porphyrafrom the Index Nominum Algarum[EB/OL].http://ucjeps.berkeley.edu/rlmoe/porphyra.html.University Herbarium, University of California at Berkley.Review, 1999: 12/20/99.
[4]Neefus C D, Mathieson A C, Klein A S, et al.Porphyra birdiaesp. nov. (Bangiales, Rhodophyta): A New Species from the Northwest Atlantic[J]. Algae, 2002, 17(4): 203-216.
[5]范晓, 韩丽君, 郑乃余.我国常见食用海藻的营养成分分析[J].中国海洋药物杂志, 1993, 12(4): 32-38.
[6]姚兴存, 邱春江, 穆春林.条斑紫菜营养成分与季节变化研究[J].水产养殖, 2002, (5): 34-35.
[7]Sahoo D, Tang X R, Yarish C.Porphyra: the economic seaweed as a new experimental system [J].Current Science, 2002, 83(11): 1313-1316.
[8]Zemke-White W L, Ohno M.World seaweed utilization:An end-of-century summary [J].Journal of Applied Phycology, 1999, 11: 369-376.
[9]石斌, 何健, 吉传礼.条斑紫菜苗种培育的新途径[J].水产科学, 1992, 11(4): 16-18.
[10]王素娟, 何培民, 周一红. 条斑紫菜体细胞育苗和下海养殖的进展[J]. 上海水产大学学报, 1995, 4(2): 128-138.
[11]刘忠松.紫菜——体细胞育苗技术[J].中国水产, 1992,(7): 31.
[12]王丽燕.植物的分化及其影响因素[J].生物学通报,2003, 38(6): 19.
[13]王秀玲, 高新起, 任秋萍.西瓜胚和胚乳的发育[J].广西植物, 2002, 22(5): 437-440.
[14]周云龙.植物生物学[M ].北京: 高等教育出版社,2004: 294.
[15]Kropf D L.Induction of polarity in fucoid zygotes[J].The Plant Cell, 1997, 9: 1011-1020.
[16]周百成, 武宝玕, 曾呈奎, 等.条斑紫菜的色素系统和光合作用的差异性[J].科学通报, 1966, 11(9): 427-429.
[17]杨晓玲, 郭金耀.连云港条斑紫菜叶状体的细胞发育特性研究[J].淮海工学院学报(自然科学版), 2009,18(2): 90-92.
[18]杨晓玲, 郭金耀.条斑紫菜外植体的生长与分化研究[J].水产科学, 2007, 26(9): 497-499.
[19]梅俊学, 费修绠.条斑紫菜离体组织再生苗的研究[J].海洋科学, 2000,24(6): 39-42.
[20]马家海, 蔡守清.条斑紫菜的栽培与加工[M].北京:科学出版社, 1996.
[21]Bloch R.Polarity in plants [J].The Botanical Review,1943, 9(5): 261-310.
[22]Lin A P, Wang G C, Yang F, et al. Photosynthetic parameters of sexually different parts ofPorphyra katadaivar.hemiphylla(Bangiales, Rhodophyta) during dehydration and re-hydration [J]. Planta, 2009, 229: 803-810.
[23]Lin A P, Wang C, Qiao H J, et al. Study on the photosynthetic performances ofEnteromorpha proliferacollected from the surface and bottom of the sea of Qingdao sea area [J].Chinese Science Bulletin, 2009, 54(3): 399-404.
[24]Sussman M, Mieog J C, Doyle J, et al.Vibrio zinc-metalloprotease causes photoinactivation of coral endosymbionts and coral tissue lesions [J].PLOS ONE,2009, 4(2): e4511.
[25]Gao S, Chen X Y, Yi Q Q, et al.A strategy for the proliferation of Ulva prolifera, main causative species of green tides, with formation of sporangia by fragmentation [J].PLOS ONE, 2010, 5(1): e8571.
Variations of photosynthetic activities in different tissue areas inPorphyra yezoensisthalli
YANG Rui-ling1, QIAO Hong-jin2, ZHOU Wei2,3, WANG Guang-ce2, PAN Guang-hua1
(1. College of Marine Science and Engineering, Tianjin University of Science & Technology, Tianjin 300457,China; 2. Key Laboratory of Experimental Marine Biology, Institute of Oceanology, Chinese Academy of Sciences,Qingdao 266071, China; 3. Marine Fisheries Institute of Jiangsu, Nantong 226007, China)
Oct., 29, 2010
Porphyra yezoensis, thalli, carbon fixations, photosynthetic activities
In this article, young thalli ofPorphyra yezoensiswere used to study carbon fixation and photosynthetic activities of the five parts from the basis to the top in the same thallus.The results indicated that: (1) there were variations of carbon fixation in different tissue areas, with the basis part possessing significantly the lowest carbon fixation while the part closing to the top the highest in the five parts; (2) photosynthetic activities and chlorophyllacontents were also different among tissue areas from the basis to the top, with the photosynthetic activities of the root and the top parts lower than the other parts and the contents of chlorophyllashowing a decrease tendency from the basis to the top. It has been reported that there was higher seeding regeneration in the excised fragments from the midst locations ofP. yezoensisthalli. Our results revealed higher photosynthetic activities in the middle parts, suggesting a correlation between seeding regeneration and photosynthetic activities.
S968
A
1000-3096(2011)08-0063-04
2010-10-29;
2011-01-19
国家自然科学基金资助项目(30830015, B49082401); 国家科技支撑计划资助项目(2006BAD09A04); 国家 863计划资助项目(2006AA10A402, 2006AA10A413, 2007AA09Z406)
杨睿灵(1986-), 女, 河南周口人, 硕士研究生, 主要从事藻类生理研究, 电话: 15922035615, E-mail: yangruiling@163.com; 王广策, 通信作者, 研究员, E-mail: gcwang@qdio.ac.cn
梁德海)
