甜菊醇及其衍生物的研究进展
2011-01-11胡艳秋
胡艳秋 石 浩
(浙江工业大学,浙江 杭州 310014)
0 前言
甜叶菊又名甜菊,属菊科、斯台维亚属的多年生草本植物。原产南美巴拉圭与巴西两国交界的阿曼拜山脉中,当地土著族很早就将甜菊作为糖料使用,比如做甜茶、饮料等。
甜菊糖苷(steviol glycosides,SGs)是从甜叶菊叶片中提取出来的一类天然甜味剂,到目前为止,至少已分离出8种不同甜度的糖苷。其中Stevioside为主要成分,甜度为蔗糖的143倍,而热量仅为蔗糖的1/300,甜味好,特别适合三高人群。通过致突变、致癌、致畸试验及急性毒性和亚急性毒性研究表明,甜菊苷具有安全低毒的特点,已获得了中国卫生部、中国食品添加剂协会、美国食品及药物管理局(FDA)的认证,在全世界广泛地用作天然甜味剂或营养食品补充剂。
甜菊醇(Steviol)为甜菊苷的苷元,分子具有对映-贝壳杉烯型四环二萜骨架结构,而对映-贝壳杉烯型二萜类化合物大多具有广泛的生理活性,如清热解毒、抗菌消炎、抗肿瘤等作用[1-2]。药理研究显示,甜菊醇可降低仓鼠肠道内的ATP含量和吸收面积,从而抑制葡萄糖的吸收,并可以降低线粒体酶的活性而不影响Na+、K+、ATP酶的活性[3]。Kelmer-Bracht等通过对甜菊中的成分对大鼠肝脏线粒体的影响研究发现,甜菊醇对氧化磷酸化具有一定的抑制作用,而其对ATP/ADP转化和氧化磷酸化的抑制作用,可能是通过对磷酸化的解耦联作用及对呼吸链酶的抑制作用实现的[4]。
1 甜菊醇的制备
1.1 化学合成法
甜菊醇在酸性条件下不稳定,易发生Wagner-Meerwein重排,从而变成其同分异构体异甜菊醇,所以不能通过甜菊苷酸水解的方法制备。1963年Mosetting等人[5]首次报道确定了甜菊醇和异甜菊醇的绝对构型:

在20世纪80年代,Ogawa等[6]报道了甜菊醇的化学合成方法。甜菊醇可由甜菊苷(stevioside)经高碘酸钠或四醋酸铅氧化,再经碱水解得到:
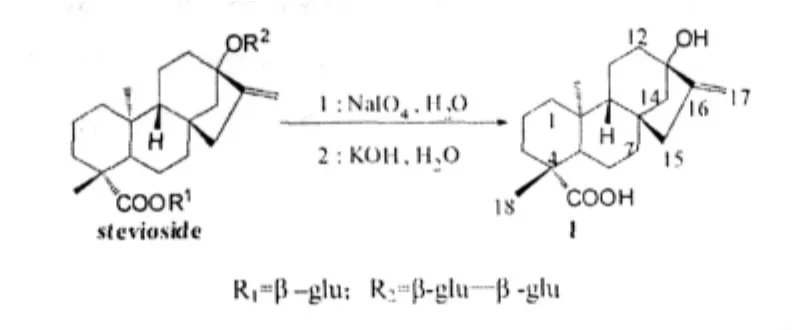
此法需要大量的高碘酸钠将甜菊糖分子中的糖苷打成碎片,获得的甜菊醇产率较低,且要经过多次的重结晶才能得到较纯的产物。
1.2 蜗牛酶水解法
降解天然产物及多糖的方法已有很多报道,比如:化学水解法;专一性酶降解法;非专一性酶降解法。目前,国际上多采用酶法降解天然产物及多糖。我国学者刘铸晋[7]曾报道了用蜗牛酶水解甜菊糖苷的方法。蜗牛酶中含有β-糖苷酶,在降解甜菊糖苷时以内切方式切断β(1-4)糖苷键。具体的水解方法如下:

1.3 微生物发酵法
Oliveira等人[8]将甜菊糖置于含有赤霉菌Gibberella fujikuroi的培养基中培养,可得到甜菊醇。

1.4 从天然植物中提取分离得到
我国学者张巧云[9]以甜茶叶为原料,水提物经大孔树脂吸附、75%乙醇洗脱、无水乙醇精制,得到甜茶叶总提取物。再经聚酰胺柱,硅胶柱层析和重结晶等方法从该提取物中分离得到了甜菊醇,这是首次从甜茶提取物中分得。
2 甜菊醇的结构修饰及其活性
甜菊醇的对映-贝壳杉烯型结构具有良好的生物活性,在医药领域有着广阔的应用前景,因此,国内外研究人员对其进行了一系列结构修饰及活性研究。目前,对甜菊醇的结构改造大多集中在13位羟基、4位羧基以及16和17位的碳碳双键部位。
2.1 13位羟基及4位羧基部位的化学结构修饰
经过多年的研究,人们认为甜菊醇C-16和C-17之间的一个双键能影响细胞色素P-450传递的代谢活性,它能产生至今仍未被人们所认识的诱变因子。甜菊醇第13位羟基团是诱变的表现式,但在13位上的乙酰化会阻止其诱变活性。并且还发现具有代谢活性的甜菊醇在能观察到有诱变活性的浓度范围内是很有杀菌活力的[10]。
甜菊醇的环外双键具有生物活性,但是它在酸性介质中又相当的不稳定,Khaibullin等人[11]采用了KOH-DMSO体系,对甜菊醇的4位羧基进行酯化反应,该方法有效地降低了甜菊醇在反应中发生重排的可能性。
根据生源学说,赤霉素和甜菊醇均由乙酸板块通过甲瓦龙酸,贝壳杉烯酸等中间体次生代谢而来,它们具有同源性。在母体结构上,赤霉素和甜菊醇十分相似:

在植物体内的生物合成途径中,凡在C-13位上具有羟基的赤霉素类似物的生物合成均可能经过了以甜菊醇为中间体的阶段。因此,甜菊醇与赤霉素有着密切的关系,生物活性与赤霉素类似,能调节植物生长。甜菊醇与赤霉素的生长有关,促进赤霉素的生物合成。Bearder等[12]发现甜菊醇在赤霉菌突变体B1-14a的作用下,转变为赤霉素GA1、HA19等。
柏正武等人[13]将一些生物活性基团和甜菊醇化合物连接合成8个化合物:

并将这些化合物和水对照,做了棉花拌种和小麦拌种试验。其中化合物4、6、7、8对作物的生长有较好的促进作用,发芽率分别为75%、69%、69.5%、82.5%。甜菊醇对植物生长的促进作用可能是通过转化为赤霉素而实现,以赤霉素的生理机能表现出来。
刘秀芳等人[14]以甜菊醇为起始原料,对其进行结构改造:
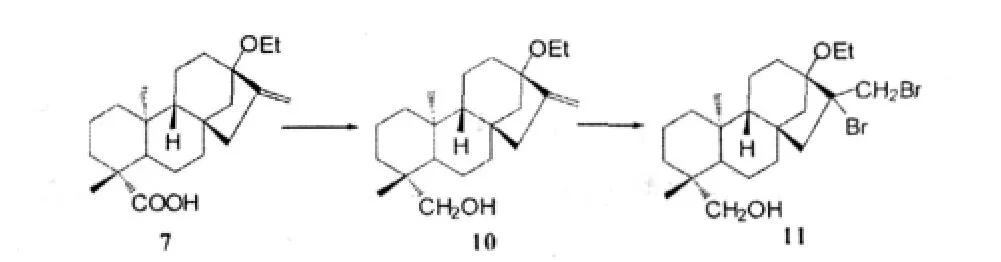
然后将这些化合物和赤霉素对照,做了水稻发芽试验。发现在化合物10、11以及赤霉素的作用下,水稻的发芽率分别为98%、92%、100%,胚芽长为2.8cm、2.0cm、2.8cm。表明了这些化合物在促进水稻发芽、胚芽生长方面表现出与赤霉素相当的活性。
2.2 双键部位的化学结构修饰
Khaibullin等人[15]采用了一种新的更为简便的方法,对双键进行氢化加成。新方法以Raney nickel为催化剂,用水合肼作为反应试剂,取代了之前用H2-Pd/C的反应体系(会产生差向异构体12-1和12-2),新的方法更经济,而且立体选择性强(反应只生成化合物12-1)。正如预期的一样,反应所得化合物在浓度为20%的硫酸中加热后,没有发生重排。

2.3 形成二聚物
Lin L H等人[16]将甜菊醇的一系列衍生物在PyBOP和DIEA的作用下与脂肪烷基胺或脂肪烷基二胺反应,制备其酰胺二聚物,并运用MTT分析法研究了该系列化合物对癌细胞及人胚胎肺细胞的细胞毒素作用。研究结果发现化合物13对癌细胞株HL260、HepG2、H460及人胚胎肺细胞株MRC25有抑制作用。
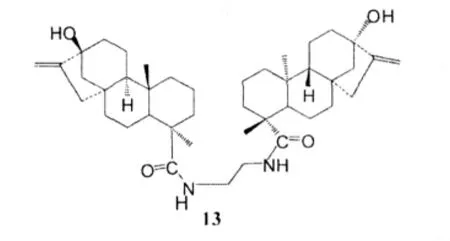
其IC50值(μmol·L-1)分别为4.3±0.3、17.9±0.3、10.7±0.65及17.0±1.2。通过对该化合物进行构效关系研究发现,二聚物对癌细胞不同的细胞毒作用与二聚物间不同的链长相关,这可能是由于不同的链长可以改变配体与受体间的相互作用,从而对生物活性产生影响。
2.4 甜菊醇的氧化
Hanson J R和Oliveira B H[17]利用黑曲霉菌和赤霉菌等真菌将甜菊醇进行了微生物转化,生成化合物14,Yang L M等人[18]利用B.megaterium ATCC 14581,M.recurvatus MR 36,和A.niger BCRC 32720对甜菊醇进行结构修饰,得到了多个羟基代谢物(14-18)。


此研究证明,这种生物转化羟基化的方法是区域选择性和立体选择性地引入羟基的一种非常有效的方法,也被应用于其他二萜型二萜化合物,而且,天然化合物的微生物转化在肿瘤抑制剂的发展中具有很高的价值。
2.5 引入α-环外亚甲基环戊酮活性基团
对映-贝壳杉烯型二萜化合物具有广泛的生理活性。其中,许多对映-贝壳杉烯型二萜化合物的抗肿瘤活性与其分子中具有α-环外亚甲基环戊酮结构有关,该结构可以与受体氨基酸的亲核基团,如氨基、羟基等发生不可逆Micheal亲核加成反应,从而体现出较好的抗肿瘤活性[19]。
由于具有α-环外亚甲基环戊酮结构的对映-贝壳杉烯型二萜化合物主要来自于天然产物,化合物来源有限。天然、廉价易得的甜菊醇亦具有对映-贝壳杉型结构,但因分子中没有α-环外亚甲基环戊酮基团,抗菌、抗肿瘤活性不强。通过对甜菊醇分子的结构改造,向分子中引入α-环外亚甲基环戊酮活性基团,可获得新的抗肿瘤先导化合物。
张大永等人[20]以甜菊醇为原料,向分子中引入了以α-环外亚甲基环戊酮为特征的活性基团,同时对C-4位羧基进行了修饰,以改善目标化合物的活性。因胺型二萜化合物易与α-环外亚甲基环戊酮反应,在制备含氮衍生物时,应首先进行羧酸的衍生化再构建α-环外亚甲基环戊酮基团。羟基保护时,因为位阻原因,相比C-19位羟基,C-13位羟基不易被乙酰化。目标化合物20-24、26-29、32-34(路线1)化合物38(路线2)的合成方法如下所示:
将目标化合物用人肝癌细胞系(BEL-7402),人卵巢癌细胞系(HO-8910),人乳腺癌细胞系(MCF-7)以及人急性粒细胞白血病细胞系(HL-60)进行活性测试。化合物20-24、26-29、32-34、38均表现出较好的细胞毒活性。事实证明了α-环外亚甲基环戊酮结构是关键的药效基团。其中,酰胺化合物(26-29)表现出相对较好的抑制活性,可能与其较适中的油水分配系数有关。与单纯酯基相比,在酯基端位上连接哌啶基的化合物(32-34)有较好的活性,判断可能是哌啶取代基能增加水溶性,起到了增强细胞毒活性的作用。C-4位取代基类型对细胞毒活性影响较大。

3 结语
在药物研发方面,目前临床应用的药物1/3以上源自天然产物。它们有的直接来自天然产物,有的是以天然产物的活性成分为先导进一步发展的衍生物、类似物或全合成产物。甜菊醇来源于甜菊苷,甜菊苷来源广,毒副作用低,而且已实现工业化生产。因此,选择甜菊醇作为先导化合物,利用前药原理、拼合原理、生物电子等排原理等对其进行合理结构修饰,以改善其水溶性和脂溶性,改变其在体内的脂水分布系数,提高其生物利用度及选择性,增强其药理活性,进行新药的研究与开发,将具有广阔的应用前景。
[1]Fujita T,Takeda Y,Yuasa E,et al.Structure of inflexinol,a new cytotoxic diterpene from Rabdosia inflexa[J].Phytochemistry,1982,21(4):903-905.
[2]Fuji K,Node M,Ito N,et al.Terpenoids.L.Antitumor activity of diterpenoids from Rabdosia shikokiana var.occidentalis[J].Chem Pharm Bull,1985,33(3):1038-1042.
[3]Toskulkao C,Sutheerawattananon M,Piyachaturawat P.Inhibitory effect of steviol,a metabolite of stevioside,on glucose absorption in everted hamster intestine in vitro[J].Toxicol Lett,1995,80:153-159.
[4]Kelmer Bracht A,Alvarez M,Bracht A.Effects of Stevia rebaudiana natural products on rat liver mitochondria[J].Biochem Pharmacol,1985,34:873-882.
[5]Mosetting E,Beglinge U,et al.J.Am.Chem.Soc[J].1963,85:2305.
[6]Ogawa T,Nozaki M,Matsui M.Total synthesis stevioside[J].Tetrahedron,1980,36(18):2641-2648.
[7]刘铸晋,周文华,高峰,等.甜叶悬钩子叶的甜味成分研究[J].植物学通报,1983,01:33-37.
[8]Heleno de Oliveira,Bras,Ferreira da Trindade,Jose Luiz.Production of hydroxysteviol and its application as a plant growth regulator:Brazil,2004006278[P].2006-08-22.
[9]张巧云.广西甜茶中甜茶素和其他化学成分的研究[D].广西师范大学,2007.
[10]刘树楷,郑建仙.良好的天然甜味剂-甜菊苷[J].中国甜菜糖业,1992,3:50-58.
[11]Khaibullin R N,Strobykina I Yu,Kataev V E,et al.O-Alkylation of Diterpenoid Steviol in the System KOH-DMSO[J].Russian Journal of General Chemistry,2009,79(5):2197-2200.
[12]John R,Bearder J M,Colin M W.Phytochemistry,1975,14(8):1741.
[13]柏正武,刘秀芳,徐汉生.甜叶醇衍生物的合成及其生物活性[J].应用化学,1993,10(4):35-38.
[14]刘秀芳,黄曦,徐汉生.甜叶醇的结构改造及生物活性试验[J].武汉大学学报,1994,2:74-78.
[15]Khaibullin R N,Strobykina I Yu,Kataev V E,et al.New Synthesis of Diterpenoid(16S)-Dihydrosteviol[J].Russian Journal of General Chemistry,2009,79(5):967-971.
[16]Lin L H,Lee L W,Sheu S Y,et al.Study on the stevioside analogues of steviolbioside steviol and isosteviol 19-alkyl amide dimers:synthesis and cytotoxic and antibacterial activity[J].Chem Pharm Bull,2004,52(9):1117-1122.
[17]JamesR Hanson,BrasH De Oliveira.The microbiological transformation of steviol derivatives by Rhizopus stolinifer and Gibberella fujikuroi[J].Phytochemistry,1990,29(12):3805-3807.
[18]Yang Li Ming,Hsu Feng Lin,Chang Shwu Fen,et al.Microbial metabolism of steviol and steviol 16α,17-epoxide[J].Phytochemistry,2007,68(4):562-570.
[19]Lee C N,Wong K L,Liu J C,et al.Inhibitory effect of stevioside on calcium Influx to produce antihypertension[J].Planta Med,2001,67:796-799.
[20]张大永,汤涌,王可,等.ent-贝壳杉烯型二萜化合物的合成及其抗肿瘤活性[J].中国药科大学学报,2010,41(1):20-25.
