MCM-48负载磷钨酸光催化降解甲基橙
2011-01-10杨水金张义军张海丽
杨水金,张义军,张海丽
(湖北师范学院化学与环境工程学院 污染物分析与资源化技术湖北省重点实验室,湖北 黄石435002)
MCM-48负载磷钨酸光催化降解甲基橙
杨水金,张义军,张海丽
(湖北师范学院化学与环境工程学院 污染物分析与资源化技术湖北省重点实验室,湖北 黄石435002)
以分子筛MCM-48负载磷钨杂多酸制备光催化剂H3PW12O40/MCM-48,考察其在光照条件下对模拟染料废水甲基橙溶液的光催化脱色性能。结果表明,当H3PW12O40/MCM-48催化剂用量为6.0 g/ L,甲基橙的初始含量为7.0 mg/ L,光照5.5 h 时,甲基橙溶液的脱色率可达84.53%。
分子筛 磷钨酸 光催化 降解 甲基橙
随着染料工业的迅速发展,染料品种和数量的日益增加,由各种途径进入环境的染料废水直接或间接地危害人类的健康。自1972年Fujishima等[1]利用TiO2光催化分解水和1977年Frank等[2]利用TiO2粉末光催化降解含CN-的溶液以来,半导体光催化法已广泛用于各种废水的降解[3-6]。常用的半导体催化剂有TiO2,CdS,ZnO,Fe2O3,SnO2和WO3等。与其他半导体催化剂相比,TiO2具有较高的催化能力和较好的化学稳定性,并具有无毒和价格较低等优点[7],因此成为光催化中常用的催化剂。TiO2主要有两种晶型:锐钛矿型和金红石型。因为锐钛矿型TiO2的比表面积大、吸附O2的能力高、光生电子-空穴对的简单复合发生较慢,所以锐钛矿型TiO2催化性能高于金红石型[8]。近年来,杂多酸因其氧化性、酸性和溶解性的优势在有机合成和环境保护等领域表现出了良好的催化活性[9-11],并在光催化中得到了广泛的应用。但采用杂多酸作为光催化剂处理有机废水时,大多采用紫外光(锐钛矿结构的TiO2的禁带为3.2 eV,多金属氧酸盐(POM)的能级间隔为3.1~4.6 eV)[12],而只有3%的太阳光在紫外光区,因此寻找合适的光催化体系以便在较宽的可见光区内显得尤为必要[13,14]。由于POM种类繁多,结构独特,且具有特殊的氧化还原性、酸碱性和表面性质,成为人们研究的热点,但以POM为光催化剂在自然光的作用下降解染料废水的报道不多。为此,本工作制备了分子筛MCM-48负载磷钨酸催化剂(H3PW12O40/MCM-48),考察其在甲基橙溶液降解反应中的催化性能。
1 实验部分
1.1 催化剂制备及表征
H3PW12O40的制备见参考文献[15]。MCM-48分子筛的制备方法是根据文献[16,17]中的方法改进的,具体操作如下:将十六烷基三甲基溴化铵(CTAB)溶解在水和2 mol/L的NaOH中,搅拌混合均匀后,逐滴加入四乙氧基硅烷(TEOS),使SiO2,Na2O,CTAB和H2O的物质的量之比为1:0.23:0.55:112。出现白色混合物后,室温下搅拌2 h,将白色混合物转入反应釜中于150 ℃中恒温4 h,室温冷却,然后用热水洗涤3次,抽滤,在室温下自然干燥,得到原粉,之后置于马弗炉中于550 ℃(升温速率2 ℃/min)下焙烧4 h,即得MCM-48分子筛。
H3PW12O40/MCM-48催化剂的制备:将与杂多酸等质量的MCM-48分子筛加入到H3PW12O40杂多酸水溶液中,室温搅拌1 h,静止12 h,于110 ℃下干燥12 h,在400 ℃焙烧3 h,即得H3PW12O40/MCM-48催化剂。
采用德国Bruker公司的D8 ADVANCE型X射线衍射(XRD)仪和Nicolet 5700型傅立叶变换红外光谱(FT-IR)仪(美国尼高力公司产,KBr压膜法)分析样品的结构。XRD采用石墨单色器滤波,铜靶Kα辐射,管电压40 kV,管电流30 mA,扫描范围2θ为1.5~60.0°。
1.2 光催化反应
选用500 W的碘钨灯作为光源,光源的外面套上一个带循环水的玻璃夹套,在光源的正上方是一个盛放反应溶液的玻璃容器,采用机械搅拌。在反应容器中加入一定浓度的甲基橙溶液和一定量的H3PW12O40/MCM-48,先在避光处磁力搅拌30 min,然后在光照下机械搅拌,每隔一定时间取样,采用分光光度法分析其溶液的变化,根据分析的结果计算甲基橙溶液的脱色率。
2 结果与讨论
2.1 表征结果
样品的XRD谱见图1。由图可知,焙烧后的MCM-48分子筛的XRD特征峰强度明显,与文献[18]报道的立方相的MCM-48基本一致,在2θ为3.094°处有一个归属于(211)面的强衍射峰, 在2θ为3~6°还出现了归属于(220),(420)和(332)等晶面的衍射峰,在2θ为10°之后没有衍射峰。说明得到的分子筛是介孔MCM-48分子筛,且焙烧后立方有序结构仍保持良好。H3PW12O40的XRD特征衍射峰分别位于8.48,8.90,10.36,25.44和29.46°,与文献值[19]基本一致,说明制得的杂多酸为Keggin结构的H3PW12O40。H3PW12O40质量分数为50%的H3PW12O40/MCM-48催化剂的XRD谱图在5.94°处有一个宽的衍射峰,且没有观察到H3PW12O40的晶相峰,说明H3PW12O40已较好地负载在MCM-48分子筛上,且中介孔道结构保持完好。
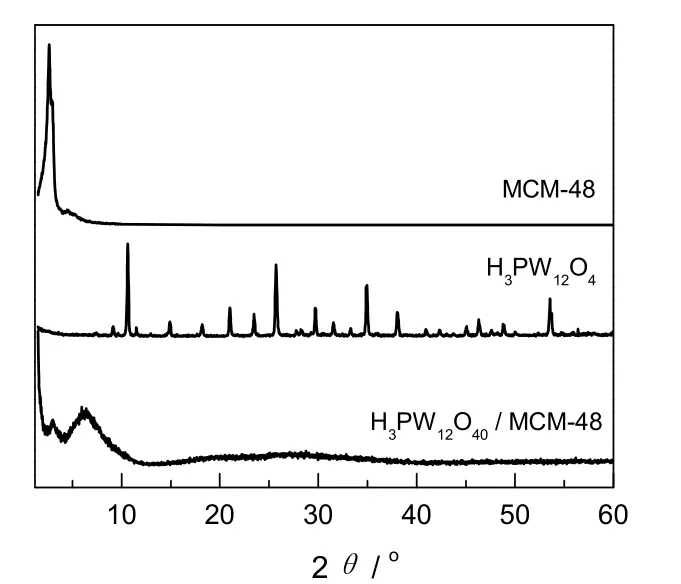
图1 样品的XRD图谱Fig.1 XRD patterns of samples
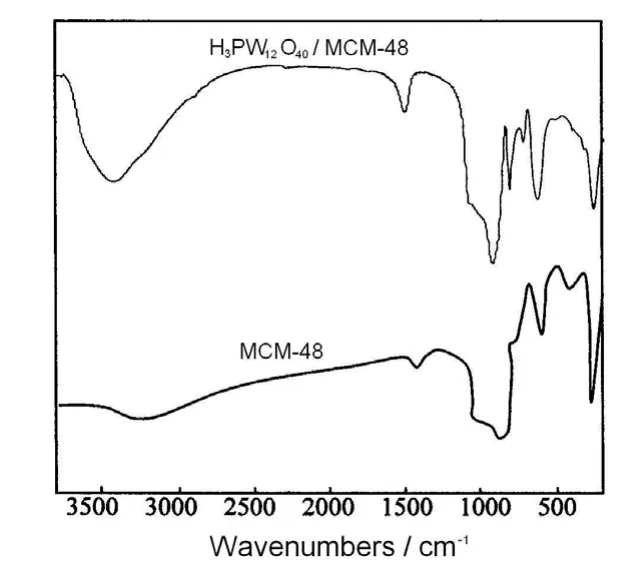
图2 样品的FT-IR图谱Fig.2 FT-IR spectra of samples
样品的FT-IR谱图见图2。由图可知,焙烧后的MCM-48样品的谱图中,在1 085.8 cm-1附近的吸收峰归属于硅氧四面体的反对称伸缩振动,在640 cm-1附近的吸收峰归属于硅氧四面体的对称伸缩振动,在460 cm-1附近的吸收峰归属于硅氧键的弯曲振动。另外,在1 473 cm-1出现窄的吸收峰是CH2的面内弯曲振动引起的。焙烧后在3 448 cm-1附近的较宽吸收峰是各种表面Si-OH的振动吸收,表明分子筛的孔道表面存在大量的羟基基团。由于羟基浓度较大且存在分子间氢键而导致吸收峰宽化,因此吸收峰为强度较大的宽吸收峰。H3PW12O40/MCM-48催化剂的FT-IR谱图除保留MCM-48分子筛的基本骨架特征峰外,在982,896和809 cm-1处出现了新的特征峰。其中982,896和809 cm-1处的吸收峰分别归属为PO4四面体中的P-Od键的对称伸缩振动吸收峰、八面体中W-Ob-W键的伸缩振动吸收峰和W-Oc-W键的伸缩振动吸收峰[20]。这说明H3PW12O40/MCM-48具有H3PW12O40的特征峰,表明负载后的H3PW12O40仍保持着基本的Keggin结构。
2.2 不同光催化剂对甲基橙的光催化效果
取50 mL浓度为10.0 mg/L的甲基橙溶液3份,分别加入0.3 g的H3PW12O40,H3PW12O40/MCM-48和H4SiW12O40/MCM-48,光解2.5 h,考察催化剂对甲基橙溶液的脱色率,结果见图3。由图可知,H3PW12O40/MCM-48的光催化活性明显优于H4SiW12O40/MCM-48和H3PW12O40。主要原因是H3PW12O40的酸性比H4SiW12O40酸性强,且负载MCM-48后H3PW12O40的表面积增大,所以催化活性高。
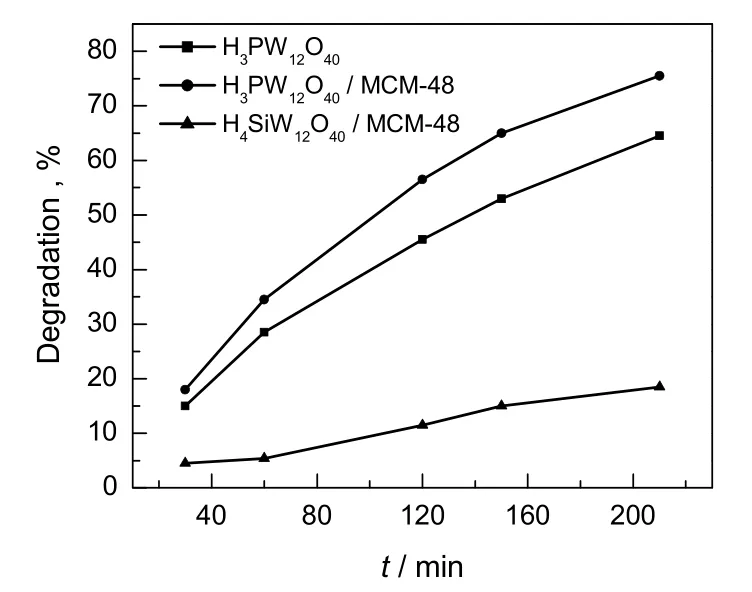
图3 不同催化剂对甲基橙溶液的降解性能Fig.3 Photocatalytic degradation performance of different catalysts for methyl orange
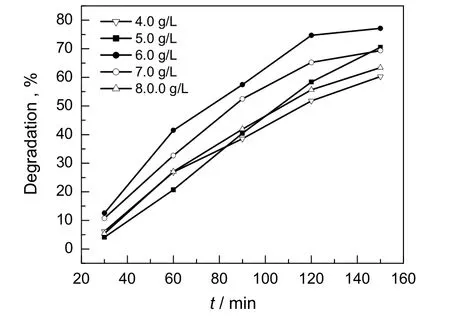
图4 催化剂用量对甲基橙脱色率的影响Fig.4 Effect of photocatalyst dosage on degradation of methyl orange
2.3 H3PW12O40/MCM-48对甲基橙的光催化效果
为了研究 H3PW12O40/MCM-48分别在避光和可见光照条件下对甲基橙溶液的光催化脱色作用,分别取50 mL 浓度为7.0 mg/L甲基橙溶液于光反应器中,机械搅拌2.5 h,做以下对照实验:(1)不加磷钨酸,避光,溶液色度不变;(2)加H3PW12O40/MCM-48,使其在溶液中浓度为6.0 g/L,避光,溶液色度几乎不变;(3)加H3PW12O40/MCM-48,使其在溶液中浓度为6.0 g/L,光照,溶液脱色率可达64.53%。由上可知, H3PW12O40/MCM-48和光的同时存在是甲基橙脱色的必要条件。
2.4 催化剂用量对脱色率的影响
在50 mL浓度为 7.0 mg/L 甲基橙溶液中分别加入不同量的H3PW12O40/MCM-48,光解2.5 h,观察脱色率的变化情况。由图4可见,在催化剂用量一定的条件下,随着H3PW12O40/MCM-48催化剂用量的增加,溶液的脱色率逐渐上升,反应到一定的时间后,脱色率增加的幅度变小。从图中还可以看出,在反应时间相同的情况下,催化剂用量增加,甲基橙脱色率先增大后降低,在催化剂用量为6.0 g/L 时比较高。这是因为催化剂用量较小时,增加催化剂用量,反应速率增加,当催化剂用量过大时,溶液的透光性变差,光催化活性下降,甲基橙脱色率反而下降。综合考虑,催化剂合适的用量为6.0 g/L。
2.5 甲基橙初始浓度对脱色率的影响
在H3PW12O40/MCM-48用量为6.0 g/L,光解2.5 h时,考察甲基橙初始浓度对其脱色率的影响,结果如图5所示。甲基橙溶液的初始浓度为7.0 mg/L时,脱色率最高。反应时间相同时,随着甲基橙溶液浓度升高,其脱色率先逐渐上升然后下降。由于光催化反应发生在 H3PW12O40/MCM-48表面,在催化剂用量一定的条件下,当甲基橙浓度较低时,甲基橙与催化剂接触的几率小,反应速率较小,脱色率较低;当甲基橙溶液而非中间产物被紧紧吸附在光催化剂的表面时,其氧化降解的速率与 H3PW12O40/MCM-48表面覆盖的甲基橙溶液成正比例[21],随着甲基橙溶液浓度增大,甲基橙与催化剂接触的几率增大,反应速率增大,脱色率增加;当甲基橙溶液浓度过高时,反应的中间产物浓度增加,与甲基橙进行竞争性吸附,减少了催化剂表面与甲基橙的接触,导致脱色率降低。因此催化剂用量为6.0 g/L时,甲基橙的浓度为7.0 mg/L时的脱色率较高。
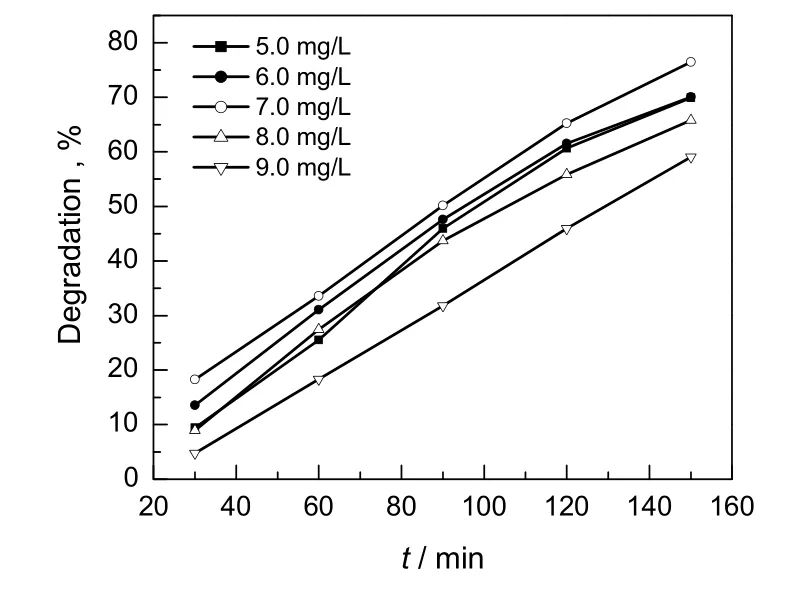
图5 甲基橙溶液浓度与脱色率的关系Fig.5 The relationship of concentration and degradation of methyl orange
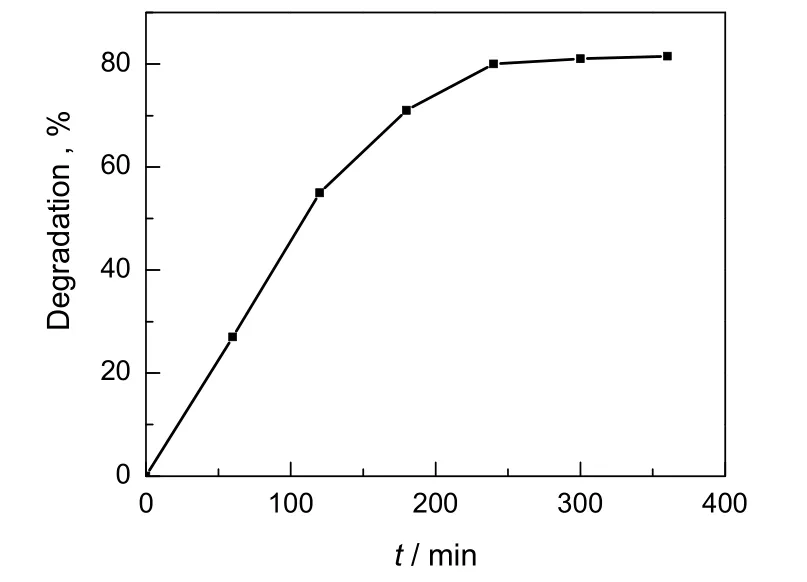
图6 光照时间对甲基橙溶液脱色率的影响Fig.6 Effect of irradiation time on degradation of methyl orange
2.6 光照时间对脱色率的影响
在催化剂用量为6.0 g/L,甲基橙的浓度为7.0 mg/L的条件下,考察光照时间对甲基橙脱色率的影响,结果见图6。由图可见,甲基橙溶液的脱色率随光照时间的增长而增大,在光照5.5 h后趋于平衡,对应的脱色率为84.53%。这是因为甲基橙溶液的降解脱色速率受扩散传质速率和氧化分解速率控制,当染料浓度较大时,降解速率主要受氧化分解速率控制,所以随反应时间延长,甲基橙溶液的降解率增大较快。当反应达到一定时间后,剩余甲基橙溶液浓度较小,降解速率主要受扩散传质速率控制,因而降解脱色率速率减小。因此合适的光照时间为5.5 h。
3 结 论
采用甲基橙溶液模拟染料废水,研究了在光照条件下H3PW12O40/MCM-48对甲基橙溶液的催化降解效果,发现H3PW12O40/MCM-48和光同时存在是甲基橙降解脱色的必要条件。该催化剂对甲基橙溶液具有良好的光催化降解效果,其光催化活性明显优于H4SiW12O40/MCM-48和H3PW12O40,7.0 mg/L的甲基橙溶液在该催化剂用量为6.0 g/L,光照5.5 h时,脱色率可达84%以上。
[1]Fujishima A, Honda K. Electrochemical photolysis of water at a semiconductor electrode[J]. Nature, 1972, 238(7): 37-38.
[2]Frank S N, Bard A J. Semiconductor electrodes photoassisted oxidation and photelectrosynthesis at polycrystalline TiO2electrodes[J]. J Am Chem Soc, 1977, 99(14): 4467-4475.
[3]Andrea M, Rossano A, Craziano V, et al. Photocatalytic processes with polyoxotungstates: pxidation of cyclohexylamine[J]. Inorg Chem, 1994,33: 2968-2973.
[4]Hiskia A, Ecke M, Troupis A, et al. Sonolytic, photolytic, and photocatalytic decomposition of atrazine in the presence of polyoxometalates[J].Environ Sci Technol, 2001, 35: 2358-2364.
[5]吴玉琪, 吕功煊, 李树本. CoOx改性 TiO2光催化剂的制备、优化及其光催化分解水析氢性能研究[J]. 无机化学学报, 2005, 21(3):309-314.Wu Yuqi, Lu Gongxuan, Li Shuben. The preparation, optimization and photocatalytic properties of CoOx-modified TiO2 photocatalysts for hydrogen generation from photocatalytic water splitting[J]. Chinese Journal of Inorganic Chemistry, 2005, 21(3): 309-314.
[6]李鸿建, 陈 刚, 李中华, 等. 烧绿石结构La2Ti2-xCoxO7 的制备及可见光分解水性能[J]. 物理化学学报, 2007, 23(5): 761-764.Li Hongjian, Chen Gang, Li Zhonghua, et al. Synthesis and photocatalytic decomposition of water under visible light irradiation of La2Ti2-xCoxO7with pyrochlore structure[J]. Acta Physico-Chimica Sinica, 2007, 23(5): 761-764.
[7]祝万鹏, 王 利, 杨志华, 等. 光催化氧化法处理染料中间体H酸水溶液[J]. 环境科学, 1996, 17(4): 7-11.Zhu Wanpeng, Wang Li, Yang Zhihua, et al. Photocatalytic oxidation of H-acid in aqueous solution[J].Chin J Environ Sci, 1996, 17(4) :7-11.
[8]Kato K. Crystal structures of TiO2 thin coatings prepared from the alkoxide solution via the dip-coating Technique affecting the photocatalytic decomposition of aqueous acetic Acid[J]. Materials Science, 1994, 29: 5911-5915.
[9]Mizuno N, Misono M. Heterogeneous catalysis[J]. Chem Rev, 1998, 98: 199-217.
[10]Guo Y H, Hu C W, Wang X L, et al. Microporous decatungstates: synthesis and photochemical behavior[J]. Chem Mater, 2001, 13: 4058-4064.
[11]Li L, Wu Q Y, Guo Y H, et al. Nanosize and bimodal porous polyoxotungstate-anatase TiO2 composites: preparation and photocatalytic degradation of organophosphorus pesticide using visible-light excitation[J]. Microporous and Mesoporous Materials, 2005, 87: 1-9.
[12]Yang Y, Wu Q Y, Guo Y H, et al. Efficient degradation of dye pollutants on nanoporous polyoxotungstate-anatase composite under visible-light irradiation[J]. Journal of Molecular Catalysis A: Chemical, 2005, 225: 203-212.
[13]Lei P X, Chen C C, Yang J, et al. Degradation of dye pollutants by immobilized polyoxometalate with H2O2 under visible-light irradiation[J].Environ Sci Technol, 2005, 39: 8466-8474.
[14]Chen C C, Wang Q, Lei P X, et al. Photodegradation of dye pollutants catalyzed by porous K3PW12O40 under visible irradiation. Environ Sci Technol, 2006, 40: 3965-3970.
[15]Weakley T J R, Malik S A. Heteropolyanions containing two different heteroatoms-I[J]. J Inorg Nucl Chem, 1967, 29(3): 2935-2944.
[16]Gallis W K, Landry C C. Synthesis of MCM-48 by a phase transformation process[J]. Chem Mater , 1997, 9: 2035-2038.
[17]Xu J, Luan Z H, He H V, et al. A reliable synthesis of cubic mesoporous MCM-48 molecular sieve[J]. Chem Mater, 1998, 10: 3690-3698.
[18]蔡 强, 魏长平, 许永宜, 等. 过渡金属(Ti, Zr, Mn, Cu, Mo, Cr, Co) 离子掺杂的MCM-48 的合成、表征与催化性能研究[J]. 高等学校化学学报, 1999, 20(3): 344-349.Cai Qiang, Wei Changping, Xu Yongyi, et al. Synthesis,characterization and catalytic acitivity of the MCM-48 framework containing Ti, Co,Cr, Mn, Cu, Mo[J]. Chemical Journal of Chinese Universities, 1999, 20(3): 344-349.
[19]王恩波, 胡长文, 许 林. 多酸化学导论[M]. 北京: 化学工业出版社, 1997: 22.
[20]Claude R D, Fournier M, Franck R. Vibrational investigation of polyoxometalates 2: evidence for anion-anioninteraction in molybdenum(VI)and tungstun(VI) compounds related to the Keggin structure[J]. Inorg Chem, 1983, 22: 207-216.
[21]Xia H L, Zhuang H S, Zhang T, et al. Photocatalytic degradation of acid blue 62 over CuO-SnO2 nanocomposite photocataltst under simulated sunlight[J]. J Environ Sci, 2007, 1996, 19: 1141-1145.
Photocatalytic Degradation of Methyl Orange Solution over H3PW12O40/MCM-48
Yang Shuijin, Zhang Yijun, Zhang Haili
(College of Chemistry and Environmental Engineering, Hubei Key Laboratory of Pollutant Analysis & Reuse Technology, Hubei Normal University, Huangshi 435002, China)
The H3PW12O40/MCM-48 photocatalyst was prepared by loading phosphotungstic acid on MCM-48 zeolite, and the effects of conditions on the degradation of methyl orange solution under illumination were investigated. The results showed that the degradation of methyl orange solution reached 84.53% under the conditions of methyl orange concentration 7.0 mg/L, H3PW12O40/MCM-48 dosage 6.0 g/L and illumination time 5.5 h.
zeolite; phosphotungstic acid; photocatalysis; degradation; methyl orange
TQ426.91 文献标识码:A
1001—7631 ( 2011 ) 06—0562—05
2010-02-09;
2011-11-30
杨水金(1964-),男,教授,博士。E-mail: yangshuijin@163.com
湖北省教育厅重点科研基金资助项目(D20102501);污染物分析与资源化技术湖北省重点实验室开放基金资助项目(KY2010G13)
