聚醋酸乙烯酯醇解动力学
2011-01-10包永忠
查 溪,包永忠
(浙江大学化学工程联合国家重点实验室,化学工程与生物工程学系,浙江 杭州 310027)
聚醋酸乙烯酯醇解动力学
查 溪,包永忠
(浙江大学化学工程联合国家重点实验室,化学工程与生物工程学系,浙江 杭州 310027)
在玻璃釜中实验考查了醇解温度、NaOH与醋酸乙烯酯单元物质的量比(碱物质的量比)和含水量对聚醋酸乙烯酯(PVAc)醇解反应的影响。发现在温度为30~45 ℃、碱物质的量比为10‰~25‰、水含量为0.25%~2.5%时,PVAc醇解反应速率与PVAc浓度成正比,并随着醇解温度的升高和碱物质量比的增加而明显增大。拟合得到PVAc醇解为一级反应,碱物质的量比为10×10-3、15×10-3、20×10-3和25×10-3时,PVAc醇解反应活化能分别为62.19、59.80、58.30和57.17 kJ/mol。无水条件下,碱对PVAc醇解无明显催化作用,水含量过高(如2.5%)导致PVAc水解反应加剧,NaOH有效浓度降低,反应速率减小。
聚醋酸乙烯酯 聚乙烯醇 醇解 动力学
聚醋酸乙烯酯(PVAc)醇解是制备聚乙烯醇(PVA)的主要方法,通过控制反应条件可得到主要用作分散剂的低醇解度PVA和中醇解度PVA、作为制备维尼纶原料的高醇解度PVA。PVA的平均分子量及分子量分布主要决定于PVAc的合成条件,用传统的以甲醇为溶剂、偶氮二异丁腈(AIBN)为引发剂的溶液聚合法能得到最大聚合度约为4 000的PVAc[1],而采用乳液聚合方法,能得到最大聚合度达到14 000的PVAc[2-4],可以满足各种不同用途对PVA分子量的要求。PVA的醇解度主要由PVAc的醇解工艺条件决定。Fabini等研究了醇解体系中碱物质的量比和水含量对醇解速度的影响,发现碱物质的量比的增加能加快醇解速度,而水含量的增加会使醇解速度下降[5]。另外,有文献指出醇解温度的升高能加快醇解反应[6]。
本实验以平均聚合度一定的PVAc为原料,研究了碱物质的量比、醇解温度和水含量等醇解条件对醇解过程的影响,以期对该醇解反应动力学进行系统分析,获得其反应速率常数和反应活化能。
1 实验部分
1.1 聚醋酸乙烯酯醇解
聚醋酸乙烯酯(PVAc,平均分子量170 000)醇解在1 L玻璃釜中进行。将充分溶解的PVAc甲醇溶液加入釜中,密封,升温,当釜内温度达到设定反应温度时迅速加入定量NaOH甲醇溶液和水,每隔一段时间用玻璃管取样,用50%的乙酸水溶液中和,置于60 ℃真空烘箱中干燥至恒重,然后测定样品的醇解度。实验反应条件如表1所示。

表1 PAVc醇解反应条件Table1 Reaction conditions of PVAc alcoholysis
1.2 醇解度的测定
采用300 MHz核磁氢谱法(NMK/300 MHZ)测定醇解样品的醇解度。醇解样品为质量浓度为3%的氘代二甲基亚砜(DMSO) 溶液,典型的核磁谱见图1,氢谱中岀峰位置及对应结构如表2所示。

图1 PVA 的300-MHz核磁氢谱图Fig.1 300-MHz 1H NMR spectrum of PVA

表2 核磁氢谱岀峰位置及对应结构Table2 1H-NMR Spectral assignments
PVAc醇解样品的醇解度采用以下公式分别计算[7,8]:

四个公式可相互验证,且误差均较小,实验采用的醇解度数据由公式(1)计算得到。
2 结果与讨论
2.1 PVAc醇解机理和反应动力学处理
在以甲醇为醇解试剂、氢氧化钠为催化剂的条件下,PVAc醇解的主要反应如下:
醇解反应:
副反应:

反应中加入少量水,使得碱的离解度增大,催化作用加强,醇解速度较无水条件大大增加,但是当水的含量较大时,水解反应加剧,生成的醋酸消耗碱,又使反应速度降低,并生成较多的醋酸钠。由于实验条件下NaOH含量相对醋酸乙烯酯单元是很少的,所以可以将生成的乙烯醇单元看成完全由醇解反应得到。
Joshi等[9]提出,以NaOH为催化剂,PVAc在甲醇中的醇解基本为PVAc浓度的一级反应,仅在反应初始和反应物醇解度很大时反应相对较慢。
2.2 温度对PVAc醇解动力学的影响
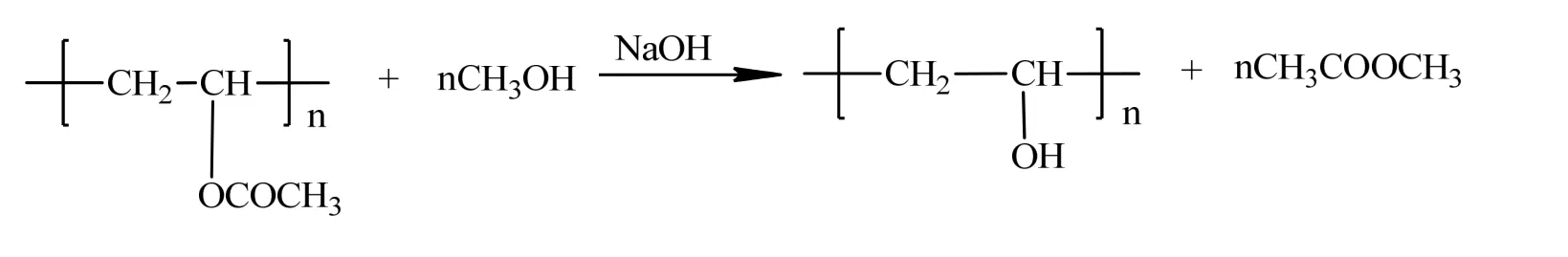
在固定碱物质的量比为15‰、水含量为1%的条件下,不同温度下的醇解反应(对应表1中5、1、6和2四组实验)的动力学曲线如图2所示,ln(a/(a-x) )与时间的关系如图3所示。

图2 不同温度下的PVAc醇解反应Fig.2 PVAc alcoholysis at different temperatures
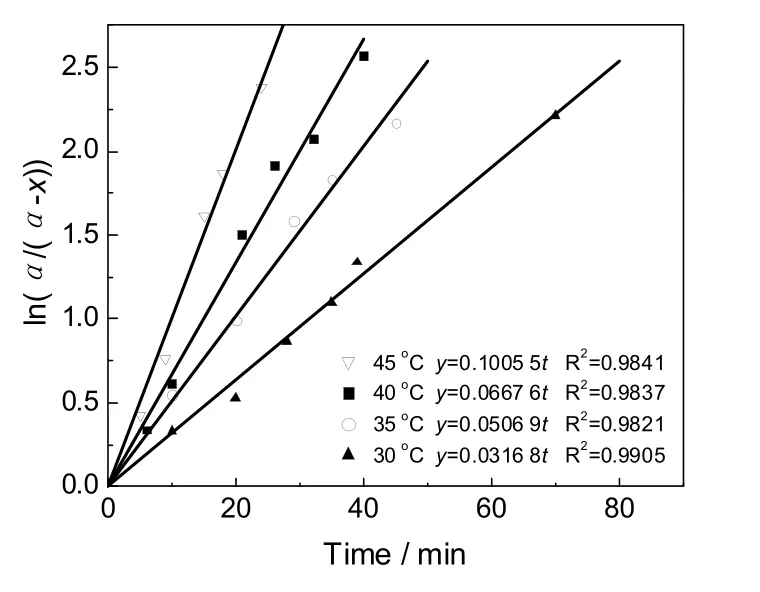
图3 不同温度下PVAc醇解与时间关系Fig.3 Relationship betweenand time at
拟合得到的直线斜率即为醇解反应速率常数k,得到30、35、40和45 ℃时k值分别为0.528×10-3s-1、0.845×10-3s-1、1.113×10-3s-1和1.676×10-3s-1。可见,随着醇解温度的升高,反应速度显著增大。用Arrhenius different temperature方程来关联反应速率常数k与反应温度T,结果如图4所示,拟合得到该反应条件下反应活化能Ea为 59.80 kJ/mol,指前因子 lnA为16.22,得到的反应活化能与按简单的酯醇解双分子取代反应机理、以碱作为催化剂的反应活化能(60~70 kJ/mol)相符[10]。
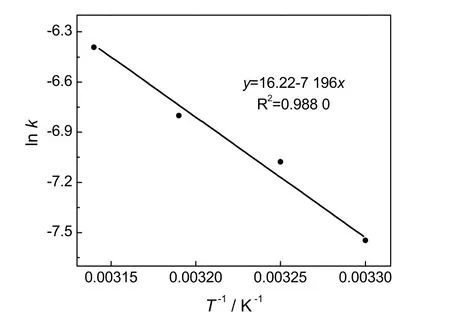
图4 Arrhenius方程拟合结果Fig.4 Fitting result for Arrhenius equation
2.3 碱物质的量比对醇解动力学的影响
为了便于实验过程连续取样(每次取样时间约20 s),同时醇解时间又不过长,选择醇解反应温度35 ℃。固定醇解温度为35 ℃、水含量为1%的条件下,分别在碱物质的量比为10‰、15‰、20‰和25‰下进行醇解反应(分别对应8、1、7和4四组实验),反应动力学曲线如图5所示,与时间的关系则如图6所示。
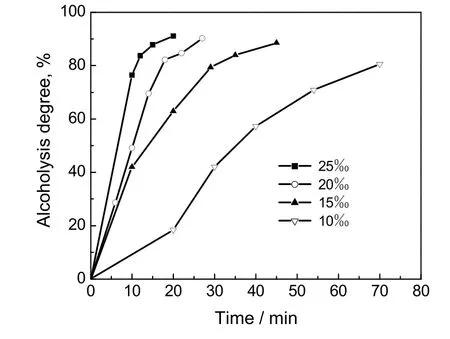
图5 不同碱物质的量比下PVAc醇解动力学曲线Fig.5 Kinetics of PVAc alcoholysis at different concentration of NaOH(35 ℃, H2O 1wt%)
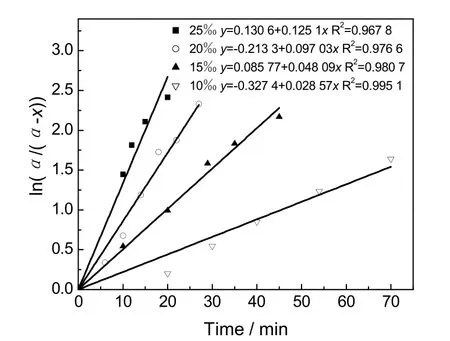
图6 不同碱物质的量比下PVAc醇解与时间关系Fig.6 Relationship betweenand time at different concentration of NaOH
拟合得到的碱物质的量比分别为10‰、15‰、20‰和25‰时的反应速率常数k值分别为0.367×10-3s-1、0.845×10-3s-1、1.433×10-3s-1、2.228×10-3s-1。可见,随着碱物质的量比的增大,反应速度也显著增大。若忽略醇解过程中催化剂的用量对副反应的影响,即NaOH仅作为反应的催化剂,而在阿伦尼乌斯公式中,指前因子A是与反应温度及系统中物质浓度无关的常数,催化剂改变的仅是反应的活化能。利用之前得到的醇解反应中lnA的结果,可以得到在不同碱物质的量比下的反应活化能,结果如表3所示。

表3 不同碱物质的量比下的醇解活化能Table3 Activation energy of PVAc alcoholysis reaction at different concentration of NaOH
可见,醇解反应活化能随着碱物质的量比的上升而下降,当碱物质的量比大于20‰时下降不明显,此时醇解速率已较大。
2.4 水含量对醇解动力学的影响
基于同样的原因,选择在碱物质的量比为15‰、温度为35 ℃的条件下考察水含量对醇解的影响研究,水含量分别为0.25%、1%、2.5%(分别对应9、1、3三组实验),得到反应动力学曲线如图7所示,与时间的关系则如图8所示。

图7 不同水含量下PVAc醇解动力学曲线(温度为35 ℃,碱物质的量比为15‰)Fig.7 Kinetics of PVAc alcoholysis at different concentration of water(35 ℃, NaOH 15‰)

图8 不同水含量下PVAc醇解与时间关系Fig.8 Relationship betweenand time at different concentration of water
由图7可见,水含量为2.5%时,前10 min的醇解速率较快,后期醇解速率减小,这与含水量过高时,水解反应加剧,生成的醋酸乙烯消耗NaOH而导致催化作用削弱有关。由图8拟合得到水含量为0.25%、1%和2.5%时,PVAc醇解反应速率常数k值分别为0.860×10-3s-1、0.845×10-3s-1、0.719×10-3s-1。可见,在实验范围内,随着水含量增加,醇解速度总体有所减小,但是水含量对反应速度的影响相对温度和碱物质的量比较小。从k值角度考虑,第3组跟第9组比水含量已经增加到10倍,而k3/k9=0.629,变化并不显著,并且水含量继续增加的话,如表1第10组实验,反应进行2 h,醇解度仅为20%,且之后反应更加缓慢。而PVAc的醇解反应体系中无水时,NaOH无法解离,起不到催化作用,说明水含量需在一定范围内醇解反应才能顺利进行。
3 结 论
在醇解温度、碱物质的量比和含水量对PVAc醇解反应速率影响的三组与时间拟合曲线中,相关系数均较接近1,说明在实验条件下PVAc醇解反应是关于PVAc浓度的一级反应。醇解温度30~45 ℃、碱物质的量比10×10-3~25×10-3条件下,PVAc醇解反应速率随温度和碱物质的量比的升高而增大,碱物质的量比为 10×10-3、15×10-3、20×10-3和25×10-3时的 PVAc醇解反应活化能分别为 62.19、59.80、58.30和57.17 kJ/mol;无水条件下,NaOH解离困难,难以起到醇解催化作用,水含量过高导致水解反应加剧,催化剂有效浓度降低,反应速率减小。
[1]Sedigheh S, Asempour H, Jamshidi H. Investigation of reaction conditions for preparation of medium molecular weight poly(vinyl alcohol) as emulsifier [J]. Iranian Polymer Journal, 2007, 16(7):439-447.
[2]Lyoo W S, Kwak J W, Choi K H, et al. Preparation of high molecular weight poly(vinyl alcohol) with high yield by emulsion polymerization of vinyl acetate using 2,2’-azobis(2-amidinopropane) dihydrochloride [J]. Journal of Applied Polymer Science, 2004, 94(6):2356-2362.
[3]Lyoo W S, Han S S, Choi J H, et al. Preparation of high molecular weight poly(vinyl alcohol) with high yield using low-temperature solution polymerization of vinyl acetate [J]. Journal of Applied Polymer Science, 2001, 80(7):1003-1012.
[4]Lyoo W S, Song D H, Lee W C, et al. Preparation of high-molecular-weight poly(vinyl alcohol) with high yield by solution polymerization of vinyl acetate in methanol using 4,4’-azobis(4-cyanovaleric acid) [J]. Journal of Applied Polymer Science, 2006, 102(5):4831-4834.
[5]Fabini M, Bobula S, Rusina M, et al. Preparation of poly(vinyl alcohol) as the dispersant for suspension vinyl chloride polymerizations [J].Polymer, 1994, 35(10):2201-2204.
[6]田仁主. 聚乙烯醇0588合成工艺研究 [D]. 湘潭: 湘潭大学, 2006.
[7]Moritani T, Fujiwara Y.13C-and1H-NMR investigations of sequence distribution in vinyl alcohol-vinyl acetate copolymers [J]. Macromolecules,1977, 10(3):532-535.
[8]Vandervelden G, Beulen J. 300-MHz1H NMR and 25-MHz13C NMR investigations of sequence distributions in vinyl alcohol-vinyl acetate copolymers [J]. Macromolecules, 1982, 15(4):1071-1075.
[9]Joshi D P, Pritchard J G. Partly alcoholized poly(vinyl acetate) polymers: kinetics of formation and reaction with iodine [J]. Polymer, 1978,19(4):427-430.
[10]Evans D P, Gordon J J, Watson H B. The influence of alkyl groups upon reaction velocities in solution [J]. Journal of the Chemical Society,1938, 1439-1444.
Kinetics of Alcoholysis of Poly(Vinyl Acetate)
Zha Xi,Bao Yongzhong
(State Key Laboratory of Chemical Engineering, Department of Chemical and Biological Engineering, Zhejiang University,Hangzhou 310027, China)
Alcoholysis of poly(vinyl acetate) (PVAc) is the main method of preparation of poly(vinyl alcohol).The effects of alcoholysis temperature, molar ratio between NaOH and vinyl acetate unit (alkali molar ratio), and concentration of water on alcoholysis kinetics of poly(vinyl acetate) were investigated. It was found that PVAc alcoholysis reaction rate was proportional to the concentration of PVAc at temperature of 30-45 ℃, alkali molar ratio of 10‰-25‰, water content of 0.25%-2.5%. The alcoholysis reaction rate was significantly increased with the increase of temperature and alkali molar ratio. The activation energies of PVAc alcoholysis reaction were 63.84, 62.55, 60.73 and 60.08 kJ/mol when the alkali molar ratios were 10×10-3、15×10-3、20×10-3and 25×10-3,respectively. The catalytic effect of NaOH to PVAc alcoholysis was not significant without the presence of water,while the presence of a greater concentration of water (i.e. 2.5%) would cause the decrease of NaOH concentration and alcoholysis reaction rate due to the increased hydrolysis of PVAc..
poly(vinyl acetate); alcoholysis; poly(vinyl alcohol); akinetics
TQ325.9 文献标识码:A
1001—7631 ( 2011 ) 05—0438—05
2011-09-19;
2011-10-17
查 溪(1986-),男,硕士研究生;包永忠(1968-),男,教授,通讯联系人。E-mail:yongzhongbao@zju.edu.cn
