缩合法合成甲基苯基二氯硅烷反应热力学研究
2011-01-10黄云龙王光润王金福
刘 彤,黄云龙,王光润,王金福
(清华大学化学工程系, 绿色反应工程与工艺北京市重点实验室, 北京 100084)
缩合法合成甲基苯基二氯硅烷反应热力学研究
刘 彤,黄云龙,王光润,王金福
(清华大学化学工程系, 绿色反应工程与工艺北京市重点实验室, 北京 100084)
本工作研究了氯苯和甲基二氯硅烷气相缩合生成甲基苯基二氯硅烷反应体系,指出在温度低于 600 ℃时,反应体系可由一个主反应和两个副反应组成的反应网络描述,并给出了此三个反应的平衡常数和反应热。利用吉布斯自由能最小化原理计算了热力学平衡组成和产品的平衡收率。计算表明由于副反应的平衡移动,温度升高有利于提高甲基苯基二氯硅烷的平衡收率。综合考虑缩合反应、副反应以及原料在高温下的裂解结炭反应,通过平衡收率与实验收率的比较,明确了随着温度的升高,反应经历了由动力学限制过渡到热力学限制,再过渡到裂解反应占主导的过程。确定了合成过程的最优反应温度为600 ℃。计算出此温度下反应热为-102 kJ/mol。产品平衡收率为36%。由于主反应的平衡常数大于107,所以原料的平衡转化率大于99%,而且配料比R=C6H5Cl:CH3SiHCl2<1时,平衡收率随R的增大而增大;当R>1时,平衡收率不再随R变化。
缩合法 甲基苯基二氯硅烷 热力学
有机硅化合物是指含有硅-碳键的化合物,其中至少有一个有机基团的碳原子与硅原子相连[1]。有机硅单体中,苯基氯硅烷的用量及重要性仅次于甲基氯硅烷,居第二位。甲基苯基二氯硅烷属于苯基氯硅烷的一种,是制备耐温、耐烧蚀、耐辐射的硅橡胶及硅油的单体之一,其下游产品广泛应用于航空、电子、汽车、建材、纺织、医疗、食品及造纸等领域。
目前甲基苯基二氯硅烷的制备方法包括格氏法、液相缩合法、气相缩合法等。格氏法由于制备格氏试剂所需金属成本高,使用易燃有机溶剂且工艺控制难度较大等缺点,如今只在实验室合成特种有机硅单体时应用。液相缩合法需在高温加压下进行,需要高额的设备投资,出于安全性的考虑,工业上仅有少量应用。气相缩合法是由甲基二氯硅烷与氯苯在高温下缩合,脱去氯化氢,生成甲基苯基二氯硅烷。该方法具有流程简单,可连续生产等优点,是合成甲基苯基二氯硅烷最有前景的途径,国内已有生产装置建成。
对于气相缩合法合成甲基苯基二氯硅烷的反应,文献[2]报道的最优工艺条件为:反应温度640 ℃,反应时间30 s,甲基二氯硅烷与氯苯的摩尔比为1:2,甲基苯基二氯硅烷的最高收率为35%。主要的副产物为甲基三氯硅烷和苯,反应一段时间后,反应器壁上会有积炭生成。关于气相缩合反应的机理,有人认为属于自由基机理[1],未见有关反应热力学及动力学方面的报道。
本实验室前期进行了初步的工艺探索,得到的最优温度为600 ℃,压力不低于0.5 MPa,以甲基二氯硅烷为基准的甲基苯基二氯硅烷收率达33%[3]。本实验将通过热力学的方法,计算产物的平衡组成和平衡收率,以达到深入认识反应体系,指导工艺开发的目的。
1 反应热力学模型
1.1 反应产物分析
缩合法合成甲基苯基二氯硅烷反应体系以甲基二氯硅烷(CH3SiHCl2,简称 MH)和氯苯(C6H5Cl)为原料,主要反应如下。首先,氯苯中的苯基取代MH中活泼氢的位置,发生缩合反应(1),生成目的产物甲基苯基二氯硅烷(CH3(C6H5)SiCl2),同时伴有氯化氢(HCl)生成:
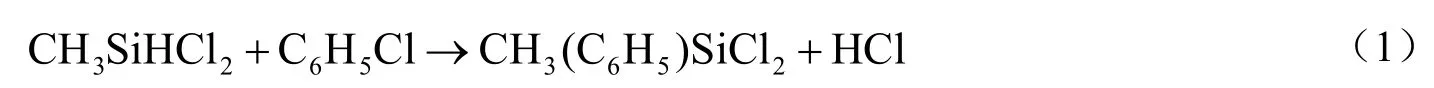
由于HCl的存在,可使生成的CH3(C6H5)SiCl2中Si-C键断裂[1],发生反应(2),生成甲基三氯硅烷(CH3SiCl3,简称M1)和苯(C6H6):
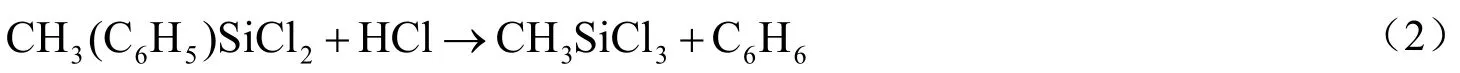
根据文献报道[4],在760 ℃以下,两个苯分子将发生反应(3),生成联苯和氢气。

此外,原料和产品中的有机基团在高于600~700 ℃后裂解结炭反应将转化为主要反应,CH3SiHCl2、CH3SiCl3等硅化物将发生裂解生成HSiCl3、SiCl4、H2、CH4和HCl等低沸物并有积炭生成[5,6]。反应网络之中若考虑到这类裂解反应,热力学平衡产物将全部是炭和SiCl4、H2等。本实验研究的反应网络中怱略此类裂解反应,故适用于温度低于600 ℃时进行的缩合反应。
1.2 热力学模型
在给定的温度T、压力p下,体系的吉布斯函数由下式给出[7,8]:

反应体系的平衡遵循吉布斯自由能最小化原理,即反应体系达到平衡时,有:

反应体系中,初始组成决定元素总量,最终限制反应的平衡组成。对每种元素k,有:

方程(4)~(6)的联立求解,要用到Lagrange未定乘数法[9,10],Smith和Van Ness[11]给出了具体计算步骤,从而得:

式(6)和(7)中,Ak为体系中第k种元素的总摩尔数,ni为体系中组分i的摩尔数,R为理想气体常数,其值取8.314 J/ (mol·K),T为绝对温度,yi为气相组分i的摩尔分率,i为组分i的逸度系数,p为体系压力,kλ为Lagrange乘子,aik为组分i分子式中第k种元素的原子个数。
取体系温度T、逸度的纯组分理想气体作为标准态。反应体系的压力为5×105Pa,温度为 600 ℃左右,在高温低压下实际体系偏离理想的程度可以忽略,则有为T温度下
组分i的标准摩尔生成吉布斯自由能,由下式得到:

各组分i的恒压热容Cp,i的温度关联式为:
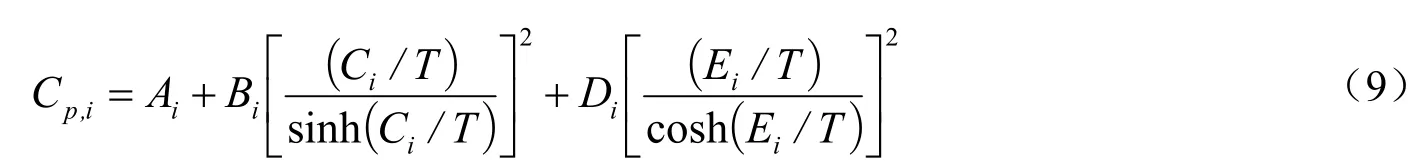
其中iA、Bi、Ci、Di、Ei为常数,由文献[12]查得。298 K的标准摩尔生成焓和标准摩尔生成吉布斯自由能数据见表1。
各反应的化学平衡常数Kθ由下式求得:


表1 组分的热力学原始数据Table1 Thermodynamic constants of species
2 模拟计算与结果讨论
2.1 关键反应平衡常数
利用表1的数据,根据公式(8)~(10),计算出 400~800 ℃范围内反应(1)~(3)平衡常数Kθ随温度T的变化,如表2所示。由表2可见,温度从400 ℃升高到800 ℃,缩合反应(1)的平衡常数Kθ虽然从2.27×108减少至 1.24×107,但始终大于 107,热力学上反应趋于完全。反应(2)的平衡常数Kθ从98.87减少至0.16,缩小618倍,说明温度升高有利于减少副反应(2)发生,对提高产品收率是有利的。反应(3)的平衡常数Kθ从0.04增大至0.19,增大4.75倍,与反应(2)相比,反应(3)对反应平衡的影响有限。

表2 关键反应的平衡常数Table2 Equilibrium constants of key reactions
2.2 反应产物平衡组成
依据 1.2中的热力学模型,即可求得平衡组成yi。图 1给出了典型条件下的平衡组成,温度区间为400~800 ℃,压力为 0.5 MPa,配料比R(C6H5Cl:CH3SiHCl2)为1。由图1可以看出,原料C6H5Cl和CH3SiHCl2已完全转化,平衡组成中含量极少。随温度的升高,CH3(C6H5)SiCl2和HCl的含量升高,C6H6和CH3SiCl3的含量下降,这说明温度升高有利于提高CH3(C6H5)SiCl2在产物中的平衡组成。上述两点与2.1中关于平衡常数的分析结论是吻合的。平衡组成中CH3SiCl3的含量始终比C6H6高10%以上,是由于副反应(3)造成的,这与实验结果也相吻合。
2.3 合成反应的热效应
计算400~800 ℃关键组分的标准摩尔生成焓,并由此计算出上述温度下反应(1)、(2)、(3)的标准摩尔反应热列于表3中。由表3可见,反应(1)和(2)均为放热反应,反应(3)为吸热反应。随着温度从400 ℃升高到800 ℃,反应(1)放热量从44.5 kJ/ mol减少至43.0 kJ/ mol,减少了3.4%;反应(2)放热量从94.8 kJ/ mol增大至97.8 kJ/ mol,增幅为3.2%;反应(3)吸热量从21.8 kJ/ mol增大至27.8 kJ/ mol,增幅为27.5%。表3最后一行给出了初始CH3SiHCl2和C6H5Cl均为1 mol,反应达到2.2中的平衡组成时体系的热效应,由此可见,缩合法合成甲基苯基二氯硅烷的反应体系为强放热体系。若反应在600 ℃下进行,反应热为-102 kJ/mol。
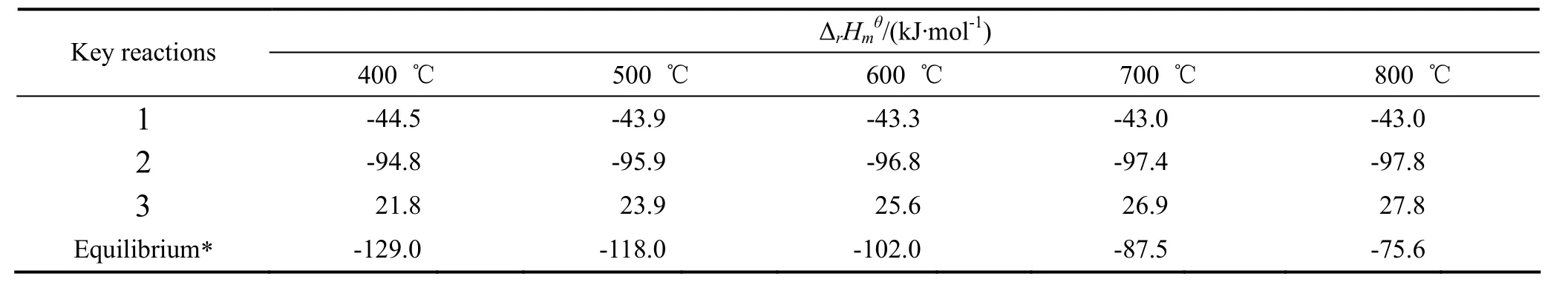
表3 关键反应的反应热Table3 Heat of key reactions
2.4 甲基二氯硅烷转化率和甲基苯基二氯硅烷收率
在原料配比R=C6H5Cl:CH3SiHCl2=1时,根据反应产物的平衡组成,可计算出CH3SiHCl2转化率X和CH3(C6H5)SiCl2收率Y(以CH3SiHCl2为基准)随温度的变化,如图2所示。本实验室前期实验所得转化率X和CH3(C6H5)SiCl2收率Y随温度的变化同样显示于图2。图中CH3SiHCl2的平衡转化率X始终大于0.99,转化近乎完全。实验所得CH3SiHCl2转化率X在温度低时因动力学原因离开平衡转化率较远。随温度的上升转化率X不断升高,温度高于600 ℃时,CH3SiHCl2转化率超过0.98,接近平衡转化率。

图1 典型工艺条件下的平衡组成图Fig.1 Equilibrium composition of typical conditions
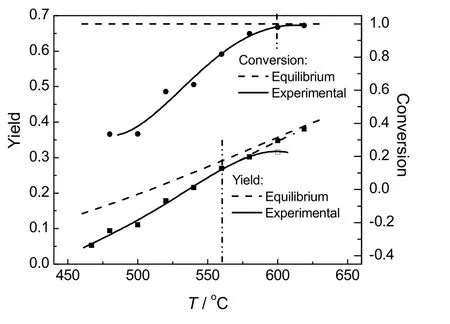
图2 CH3(C6H5)SiCl2收率与CH3SiHCl2转化率的实验与计算结果Fig.2 Experimental and calculated yield of CH3(C6H5)SiCl2 and conversion of CH3SiHCl2
CH3(C6H5)SiCl2的实验收率和平衡收率均随温度升高而大幅度上升,温度升高明显有利于气相缩合反应。低温条件下缩合反应因动力学原因远离平衡。温度从 467 ℃升高到 560 ℃时,实验收率与平衡收率的差距逐渐减小,反应由动力学限制逐渐过渡到热力学限制阶段;温度在560~600 ℃范围内,实验收率接近平衡收率;超过600 ℃,实验收率与平衡收率的差距变大,这主要是由于在600 ℃时CH3SiHCl2、CH3SiCl3等硅化物己开始发生裂解结炭反应,从而使目标产物收率下降。在600 ℃下进行反应时,已检测到占总进料质量2%左右的结炭量。考虑裂解结炭反应的限制,缩合反应温度不宜超过600 ℃。最佳的反应温度应为600 ℃。由热力学模型计算得600 ℃下的平衡收率为36%。
2.5 配料比的影响
分别在 400、500、600 ℃温度下计算平衡组成随配料比R(C6H5Cl:CH3SiHCl2)的变化,换算成CH3(C6H5)SiCl2的收率Y与R的关系,作于图3。由图3亦可得出,CH3(C6H5)SiCl2的平衡收率Y随着温度的升高而升高。当R<1时,平衡收率随R的增大而增大;当R>1时,平衡收率随R不再变化。由于反应(1)平衡常数特别大,所以两种原料必然至少有一种趋近于完全转化,而 CH3(C6H5)SiCl2的收率Y是以CH3SiHCl2为基准计算的,所以图3所示的结果是不难解释的。
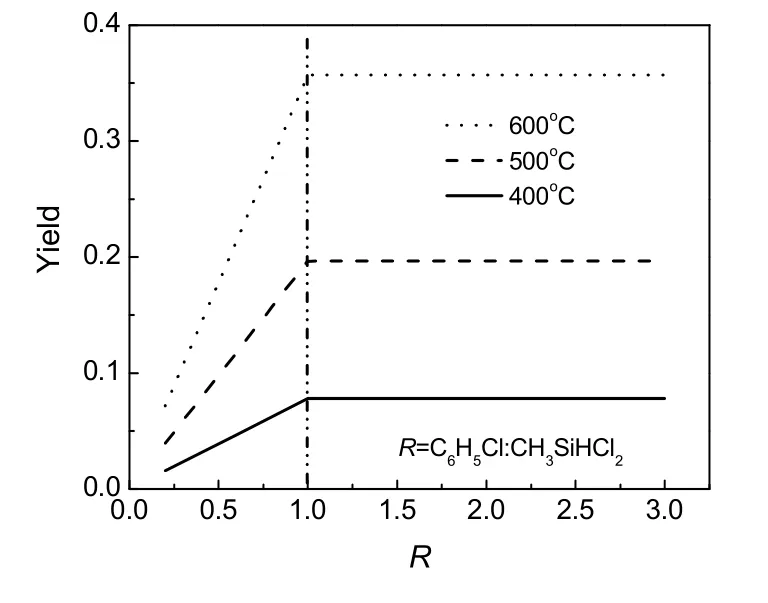
图3 配料比对平衡收率的影响Fig.3 Effect of feed ratio on equilibrium yield
3 结 论
在温度小于600 ℃时,缩合法合成甲基苯基二氯硅烷反应体系的主要反应有缩合反应(1)、生成甲基三氯硅烷和苯的副反应(2)和两分子苯生成联苯的反应(3)。其中反应(1)和(2)均为放热反应,反应(3)为吸热反应,反应体系为强放热体系。在原料配比R(C6H5Cl:CH3SiHCl2)为1时,按此反应体系作热力学计算求得反应(1)、(2)和(3)的平衡常数,以及基于甲基二氯硅烷的平衡转化率和产品甲基苯基二氯硅烷的平衡收率。计算表明,由于副反应的平衡移动,温度升高有利于提高甲基苯基二氯硅烷的平衡收率。通过平衡收率与实验收率的比较,明确了随着温度的升高,反应经历由动力学控制过渡到热力学控制,再过渡到裂解反应占主导的过程。实验得出最佳反应温度为600 ℃,计算得此温度下的反应热为-102 kJ/mol,产品平衡收率为36%。由于反应(1)的平衡常数大于107,故原料的平衡转化率大于99%。R<1时,原料的平衡转化率和甲基苯基二氯硅烷的平衡收率随原料配比R的增加而增加;R>1时,甲基苯基二氯硅烷的平衡收率不随原料配比R的增加而变化。
[1]杜作栋. 有机硅化学 [M]. 北京: 高等教育出版社, 1990:1-2.
[2]晨光化工研究院有机硅编写组. 有机硅单体及聚合物 [M]. 北京: 化学工业出版社, 1986:50-51.
[3]黄云龙, 刘 彤, 王光润, 等. 均相催化合成甲基苯基二氯硅烷 [J]. 精细化工, 2011, 28(9):927-929.Huang Yunlong, Liu Tong, Wang Guangrun, et al. Synthesis of methylphenyldichlorosilane with a homogeneous catalyst [J]. Fine Chemicals,2011, 28(9):927-929.
[4]Brooks C T, Peacock S J, Reuben B G. Pyrolysis of benzene [J]. Journal of the Chemical Society, Faraday Transactions 1:Physical Chemistry in Condensed Phases, 1979, 75(0):652-662.
[5]Davidson I M T, Dean C E. Kinetics and mechanism of pyrolysis of some methylchlorosilanes [J]. Organometallics, 1987, 6(5):966-969.
[6]Ring M A, O'Neal H E, Walker K L. Kinetics of dichlorosilylene trapping by methane and mechanism and kinetics of the methyldichlorosilane decomposition [J]. International Journal of Chemical Kinetics, 1998, 30(1):89-97.
[7]胡 英. 物理化学 [M]. 第5版. 北京: 高等教育出版社, 2007:181-202.
[8]张玉军. 物理化学 [M]. 北京: 化学工业出版社, 2008:119-140.
[9]Reynolds W C. The element potential method for chemical equilibrium analysis, implementation in the interactive program [D]. Stanford:Stanford University, 1986.
[10]Pope S B. Gibbs function continuation for the stable computation of chemical equilibrium [J]. Combustion and Flame, 2004, 139(3):222-226.
[11]Smith J M, Van Ness H C, Abbott M M. Introduction to chemical engineering thermodynamics [M]. 6th Edition. Boston: McGraw-Hill Book Company, 2001:509-515.
[12]Design Institute For Physical Properties, Sponsored by AIChE. DIPPR Project 801-Full Version [DB/OL]. [2011-05-13].http://www.aiche.org/dippr/.
Thermodynamic Research on Synthesis of Dichloromethylphenylsilane by Condensation Method
Liu Tong,Huang Yunlong,Wang Guangrun,Wang Jinfu
(Department of Chemical Engineering, Tsinghua University, Beijing 100084, China)
Synthesis of dichloromethylphenylsilane by gas phase condensation reaction, in which chlorobenzene reacts with methyldichlorosilane, was investigated in this paper. Below 600 ℃, the reaction system can be characterized by one main reaction and two side reactions, equilibrium constants and reaction heat of which were given. The equilibrium composition and yield of desired product were calculated by minimizing global Gibbs free energy. Because of equilibrium shifting of side reactions, an increase in temperature favors the yield of dichloromethylphenylsilane. It’s clear by comparing experimental and calculated results that reaction system undergoes a transition from dynamic to thermodynamic limit, and pyrolysis is dominant at higher temperature.Optimum temperature is 600 ℃, at which the heat of reaction system and equilibrium yield of desired product are-102 kJ/mol and 36%. Equilibrium conversion of reactant is greater than 99%, because the equilibrium constant is greater than 107. When feed ratioR(C6H5Cl:CH3SiHCl2)<1, equilibrium yield increases withR. But the yield stay constant whenR>1.
condensation method; dichloromethylphenylsilane; thermodynamics
TQ264.1;O642.1 文献标识码:A
1001—7631 ( 2011 ) 05—0454—06
2011-05-12;
2011-10-04
刘 彤(1987-),男,博士研究生;王金福(1957-),男,教授,通讯联系人。E-mail:wangjfu@tsinghua.edu.cn
