仿刺参生殖腺发生与早期分化的组织学观察*
2011-01-10邵明瑜胡景杰张志峰
晏 萌,隋 娟,邵明瑜,胡景杰,张志峰**
(1.中国海洋大学海洋生物遗传育种教育部重点实验室,山东青岛266003;2.中国科学院海洋研究所,山东青岛266003)
生殖腺由生殖细胞与体细胞共同形成,是配子形成的部位。对生殖腺的研究是遗传学、生殖生物学以及进化生物学等学科的重要内容之一。生殖腺常伴随着个体发生和性成熟过程而产生和分化,对生殖腺发生和分化的认识可以为人们更好地掌握该物种的生殖腺特性、人工繁育以及进一步地生殖调控、提高种质质量等等提供有用的基础数据[1]。
对于海参生殖腺的研究,目前已在组织学结构[2-3]、生殖腺发育周期[4-5]、生理生化[6]等方面有了一些报道。已知海参的生殖腺呈分枝管状,生殖腺管表面覆盖一层上皮细胞,其管壁细胞向内侧突出,形成褶皱。根据组织学特征,刺参生殖腺被划分为5个时期。Jennifer曾对海参(Synaptu la hydriform is)的原始生殖细胞及其分化进行了超微结构的观察[7],然而有关海参纲动物生殖腺的发生和分化,迄今未见报道。
仿刺参(A postichopus japonicus Selenka)是海参纲中具有最高营养价值的经济种类之一,近年来对其生物学特征以及繁殖生物学等领域有了较广泛的研究[8-9]。本研究运用组织学手段,开展其生殖腺的发生和早期分化的研究,旨在为深入研究仿刺参生殖生物学特性和生殖调控等提供基础资料。
1 材料与方法
1.1 实验动物
体长为0.1~3 cm的稚、幼参与3~5 cm的幼参分别于2007年7月和2008年12月取自辽宁省海洋水产科学研究院。
1.2 材料处理
使用饱和MgSO4对各期稚、幼参进行麻醉,待其口触手与身体充分伸展后,以游标卡尺测量其体长(头部石灰环至尾部的距离)[10],然后投入Bouin’s液中固定12~16 h(根据个体大小),固定期间于体壁处剪开若干小口,以便于固定液及时渗入。
1.3 组织学观察
体长0.1 cm的稚参采用琼脂-石蜡双重包埋,其他样品均采用石蜡包埋。Histostart 820型切片机(Reichert)上进行连续切片,厚度为5μm,H.E.染色,Nikon 80i显微镜下观察,使用N IS-Elements软件拍照并测量细胞直径(取切面中细胞边缘最大距离作为直径,n=5)。
2 结果
2.1 仿刺参生殖腺的发生部位
体长0.1 cm稚参体前部的背肠系膜(石管后方、消化管前端处的背侧肠系膜)中,可见原生殖细胞(Primordial germ cells,PGCs)分布。连续切片观察,此期PGCs数量约10个,夹杂于背肠系膜的结缔组织细胞之间,并与该处结缔组织共同构成仿刺参的原始性腺(Original gonad)或称为未分化性腺(Undifferentiated gonad)(见图版1-A,B)。显微镜下,原始生殖细胞直径为(3±0.17)μm,明显大于周围结缔组织细胞,其细胞核大而圆,核基质较透明,核仁明显,细胞质呈现弱嗜碱性,具有典型PGCs的形态特征(见图版1-B)。
2.2 仿刺参生殖腺早期发育的组织学特征
体长0.3 cm的稚参,原始性腺较前期稍有加长,其中生殖细胞数量增至40个左右,边缘的生殖细胞较中央的排列更紧密(见图版1-C),且前者的体积小于后者。体长0.4 cm的稚参中,原始生殖腺进一步拉长,性腺中出现狭窄腔隙(见图版1-D)。当稚参体长达到0.5 cm时,原始生殖腺中央产生1个明显的空腔结构,生殖腺初具雏形。此时位于生殖腺管壁最外层的细胞排列成上皮样,腔的周围由生殖干细胞和生殖腺体细胞包围(见图版1-E)。1 cm长的幼参,其生殖腺管腔扩大,局部管壁中生殖细胞排列成2层(见图版1-F)。2 cm体长的幼参与体长0.5 cm的稚参相比,其生殖腺管腔明显扩大,局部管壁中的生殖细胞出现3层(见图版1-G)。此阶段生殖细胞的形态未见明显变化。
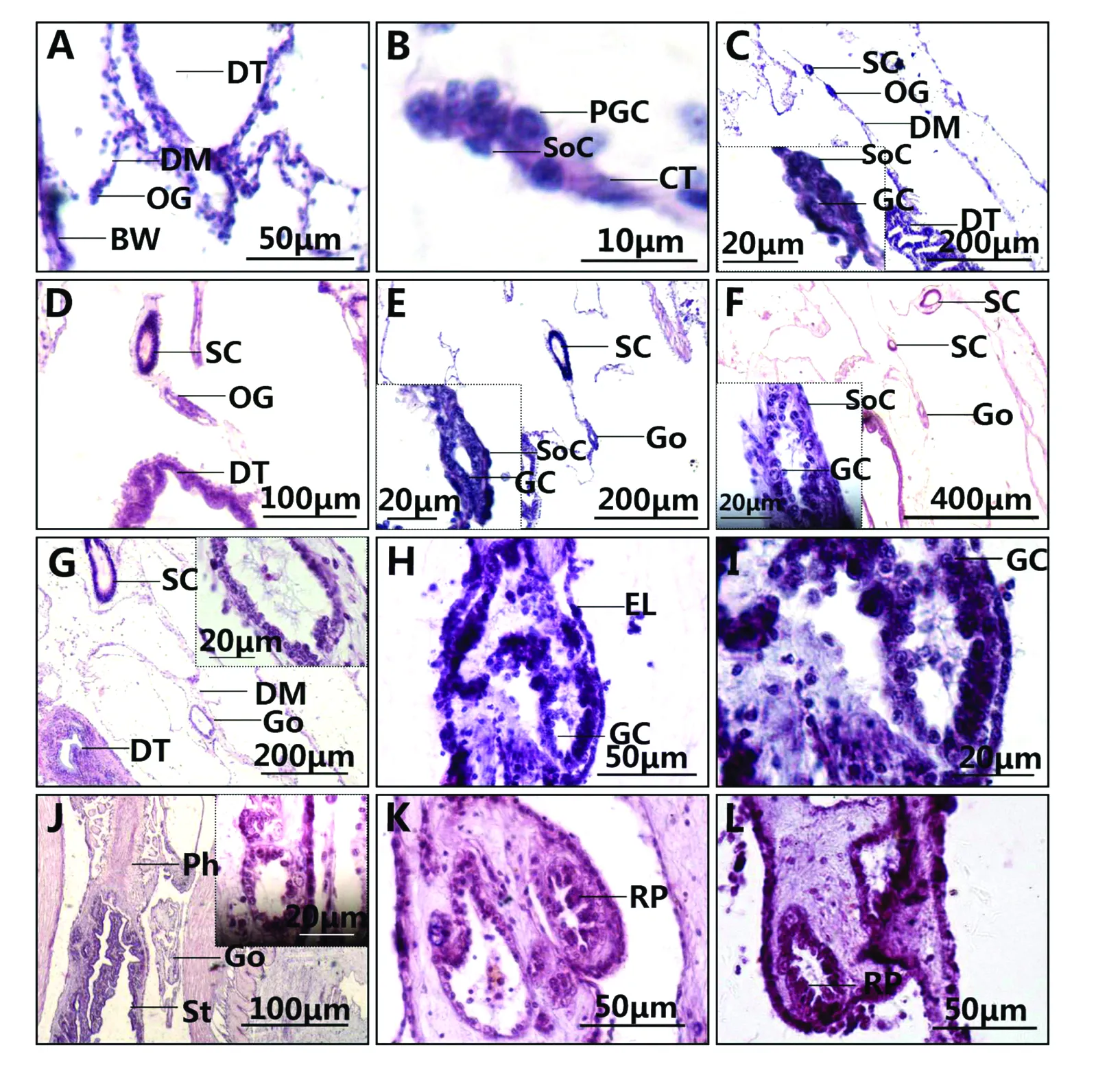
图版1 仿刺参生殖腺发生与早期分化Plate 1 Genesis and early differentiation of gonad in A.japonicus
体长3 cm幼参的生殖腺出现二分枝管状结构,每个腺管的管壁外层为排列紧密的单层上皮样细胞,内侧由多层生殖细胞构成(见图版1-Ⅰ),较贴近上皮样细胞的生殖细胞直径较大,可达到(4±0.72)μm。生殖细胞数量超过600个,生殖腺的基本结构已经具备。
体长3.5 cm幼参生殖腺中的生殖细胞仍较均匀分布,生殖管壁外层上皮样细胞排列更加紧密(见图版1-J)。4 cm长幼参的生殖腺中可见多分枝结构,在生殖腺的纵切面可见多个生殖腺管结构,并且在部分管腔内含生殖细胞的管壁的内层细胞向内发生褶皱,形成以生殖细胞为主的嵴状突起(见图版1-K),随着发育的进行,在体长5.3 cm的幼参生殖腺中生殖腺管腔内侧的嵴状突起更加密集(见图版1-L)。
3 讨论
3.1 仿刺参生殖腺发生的时空特征
Jennifer等报道[7],海参S.hydriform is的生殖腺最早在刚变态的稚参(体长约0.1 cm)中临近石管和环水管的背肠系膜处发现。本研究中,在体长为0.1 cm的仿刺参A.japonicus稚参的背肠系膜前端的位置出现由约10个原始生殖细胞形成的原始性腺。该结果与隋娟等报道的在稚参背肠系膜处发现vasa基因的集中表达的结果相符[11]。随着仿刺参体长的增长,生殖腺在肠系膜中不断延伸,然而在其早期发育过程中其相对位置变化不大,位于咽与胃过度部位的背侧。
生殖腺沿背系膜延伸的现象,在其他棘皮动物中也有发现,M argaret等[12]在对海胆生殖腺发生的研究中发现:当幼体发育到体长0.1 cm时,PGCs在原始生殖腺中成簇聚集,在直径1.5 mm的海胆中,生殖腺原基已经开始在背肠系膜中随PGCs数目的增多而加宽加长。在比较海参和海胆的生殖腺发生,发现二者的模式基本一致,即生殖腺的发生均为背肠系膜处,并且随着PGCs在其中增殖,生殖腺也在肠系膜中延伸。
3.2 仿刺参生殖腺发生的形态特征
仿刺参的生殖腺发生特点是先出现管腔,管腔不断加宽拉长,随后发生分枝。稚参体长达到0.3 cm时,原始生殖腺出现中央细胞排列松散的现象,在体长达到0.4 cm时,两端出现明显的腔隙,此时为生殖腺管腔形成的前期。稚参体长达到0.5 cm时,生殖腺中心处管腔扩大,发育至体长2 cm时,生殖腺管端部也发生扩大,形成膨大的立方体腔。幼参在体长3 cm时,生殖腺管出现二分枝,随着体长的增长,出现多重分枝。隋锡林等报道的成熟仿刺参,生殖腺呈多分枝状于肠系膜的两侧,可推测在体长达到5.3 cm之后,仿刺参幼体的生殖腺将会不断分枝拉长,对称地分布在背肠系膜两侧。
Jennifer对海参S.hydriform is幼体生殖腺的研究中发现,体长0.1 cm时,稚参的生殖腺已经由3层细胞构成且出现腔结构。M argerat的海胆实验中也发现了生殖腺变形与分枝的现象,从体长2 mm开始,海胆的PGCs延背系膜向两侧迁移,形成T形结构,5 mm的海胆中,生殖腺出现分枝。可见海参和海胆生殖腺的发育多存在先出现管腔再分枝变形的特点。
本研究中,稚参体长达到0.3 cm时,可见原始生殖腺体细胞增殖,紧密地排列在生殖细胞周围,当仿刺参生殖腺出现分枝后,生殖上皮的细胞分化更为明显,主要可分为2层,内层为排列较松散的生殖细胞,外层为排列紧密的较小的上皮样细胞。而海参S.hydriform is中,体细胞包围PGCs的时间似乎早于仿刺参,即在0.1 cm体长时,其生殖上皮的体细胞便形成了包围PGCs的不完整的细胞层;超微结构观察发现,S.hyd riform is生殖上皮外层有腹膜包被,腹膜与生殖上皮之间存在结缔组织;生殖上皮中生殖细胞是1种上皮样带鞭毛的领细胞,其中的体细胞形态不规则;尽管其生殖上皮细胞结构独特而复杂,但是其仍表现出典型的无脊椎动物性腺上皮细胞的所有特性[7]。
3.3 仿刺参生殖腺的性别分化
本实验中,幼参体长4 cm时,生殖腺的部分管壁内层细胞向内发生褶皱,形成以生殖细胞为主的嵴状突起,随着发育的进行,生殖腺管腔内侧的嵴状突起更加密集。常亚青等[13]报道,成体仿刺参精巢在增殖期起始阶段,其生殖上皮增长显著,向管腔内延伸,并于其中形成大小不一的褶皱;而在同时期的卵巢横切面中,随生殖上皮的生长,其在生殖管内形成大小不一的梅花瓣状褶皱。根据本实验对5.3 cm幼参的生殖腺横切面观察,某些个体的生殖腺管腔内有嵴状褶皱,而另外一些个体则无明显的褶皱。据此作者推测实验中生殖腺出现褶皱的个体可能为雄性。
[1] Belova G V,Viktorovskaya G I.Morphometric characteristic of sex cells and seasonal changesof female gonads of Cucumaria japonica(Semper,1868)(Echinodermata:Holothuroidea)from Peter the Great Bay,sea of Japan[J].Russian Journal of Marine Biology,2007,3(33):173-180.
[2] A twood David G.U ltrastructureof the Gonadalwallof the sea cucumber,Leptosynap ta clarki(Echinodermata:Holothuroidea)[J].Z.Zellforsch,1973,141:319-330.
[3] Thongkukiatkul A,Jungudomjaroen S,Ratanapahira C.Spermatogenesis and chromatin condensation in male germ cells of sea cucumber Holothuria leucospilota(Clark,1920)[J].Tissue and Cell,2008,40(3):167-175.
[4] 隋锡林,刘永襄,刘永峰,等.刺参生殖周期的研究[J].水产学报,1985,9(4):303-310.
[5] Kubota T.Rep roduction in the apodid sea cucumber Patinaptaoop lax:Semilunar spawning cycle and sex change[J].Zoology,2000,17(1):75-81.
[6] Hamel Jean-Francios,Becker Pierre,Eeckhaut Igor,et al.Exogonadal oogenesis in a temperate holothurian[J].Biological Bulletin,2007,213:101-109.
[7] Frick Jennifer E,Ruppert Edward E.Primordial germ cells of Synaptula hydriform is(Holothuoidea;Echinodermata)are epithelial flagellated-collar cells:Their apical-basal polarity becomes primary egg polarity[J].Biological Bulletin,1996,191:168-177.
[8] Katow H,Katow T,Moriyama A.Gonad-stimulating substancelikemolecule from the radial nerve of the sea cucumber[J].International Journal of Developmental Biology,2009,53(4):483-491.
[9] Kanno Manami,Suyama Yoshihisa,Li Qi,et al.Microsatellite analysis of Japanese sea cucumber,Stichopus(Apostichopus)japonicus,supports reproductive isolation in color variants[J].Mar Biotechnol(NY),2006,8(6):672-685.
[10] Sewell Mary A.Small Size,brooding,and protandry in the apodid sea cucumber,Leptosynata clarki[J].Biological Bulletin,1994,187:112-123.
[11] 隋娟.A j-vasa全长cDNA的克隆及其在仿刺参(Apostichopus japonicus)生殖系中的发育表达图示[D].青岛:中国海洋大学,2008.
[12] Houk Margaret S,Hingardner Ralph T.The formation and early differentiation of sea urchin gonads[J].Biological Bulletin,1980,159:280-294.
[13] 常亚青,丁君,宋坚,等.海参、海胆生物学研究与养殖[M].北京:海洋出版社,2004.
