六种大型藻浸提液对中肋骨条藻的抑制及活性成分分离*
2011-01-10别聪聪李锋民李媛媛赵雅菡王震宇
别聪聪,李锋民,李媛媛,赵雅菡,王震宇
(中国海洋大学环境科学与工程学院,山东青岛266100)
赤潮是1种全球性的海洋灾害[1],自2000年以来,我国近海赤潮带来约亿元的直接经济损失[2]。目前赤潮的防治主要有人工打捞、播撒絮凝剂以及利用食物链除藻[3],各种方法显示优点的同时也有过度依赖人工、二次污染等缺点[4]。而化感作用的发现为赤潮的防治提供了新思路。
化感作用是指植物通过分泌次生代谢产物(化感物质)对其周围的植物或微生物产生影响的现象[5-6]。化感作用在农业生态系统中的研究较为成熟,利用其进行作物轮作、间隙栽培等实现可持续发展已成为该领域的研究重点[7],但水生生态系统中的化感作用研究起步较晚,多处于实验模拟阶段。研究者验证了陆生、水生植物对微藻的化感抑制作用[8-11],其中大型藻对微藻的生长影响现象近来受到关注,王悠等[12]发现大型藻石莼和江蓠完全杀死共培养的赤潮异弯藻,雷光英[13]发现龙须菜对海洋原甲藻产生生长抑制,这些研究使得利用大型藻化感作用防治赤潮成为可能。但赤潮爆发突然、范围大,受大型藻培养周期长、作用范围有限等因素的影响,利用活体大型藻防治赤潮的可行性不大,因此从大型藻中分离提取化感物质成为理想的手段,其不仅解决了大型藻的利用问题,而且大型藻来自海洋不易引起二次污染。
中肋骨条藻是全世界分布广泛、我国近海发生频率高且危害严重的典型赤潮藻[2,14],目前利用大型藻化感作用抑制中肋骨条藻的研究还较少见。因此本文选取孔石莼、羊栖菜、长浒苔、蜈蚣藻、马尾藻和裙带菜6种常见大型藻,比较其干粉末的海水浸提液对中肋骨条藻的化感抑制效果,筛选出具高抑藻能力的大型藻,并进行初步的化感物质分离,为进一步提取抑藻化感物质奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 大型藻 实验采用的6种大型藻分别为孔石莼(Ulva pertusa)、羊栖菜(Sargassum fusiforme)、长浒苔(Enteromorpha clathrata)、马尾藻(Sargassum pathen)、蜈蚣藻(Grateloupia filicina)和裙带菜(Undaria pinnatifida),均购自浙江一泓藻业公司,自然风干。
1.1.2 中肋骨条藻 中肋骨条藻(Skeletonem a costatum)由中科院海洋所环境与生态实验室提供。采用f/2(+Si)培养基[15],培养于人工智能光照培养箱中(宁波,江南仪器公司),光照强度为4000 Lx,昼夜时间与温度分别为12/12 h和24/20℃。
1.2 实验方法
1.2.1 大型藻浸提液的制备 大型藻干燥(60℃,24 h)后,研钵研磨至粒径小于0.1 mm,粉末密封待用。取30 g海藻干粉末,浸泡于250 m L经0.45μm孔径的醋酸纤维膜过滤且灭菌(121℃,20 min)的海水中,于25℃恒温箱中避光浸提48 h。浸提液经200目筛绢过滤,滤液再经0.45μm孔径的醋酸纤维膜过滤,最终滤液即为大型藻浸提液母液。采用单位体积大型藻的干重表示浸提液中大型藻的浓度。
1.2.2 长浒苔化感组分的萃取分离 称取1 kg烘干(60℃,48 h)的长浒苔粉末于5 L无水乙醇中室温浸泡提取48 h后,经200目筛过滤获得的乙醇浸提液,用旋转蒸发仪(EYELA CCA-1110,Japan)在40℃下减压蒸发浓缩,得到浸膏,浸膏按图1所示步骤进行液液萃取分离,得到4个长浒苔的分离组分A、B、C和D。
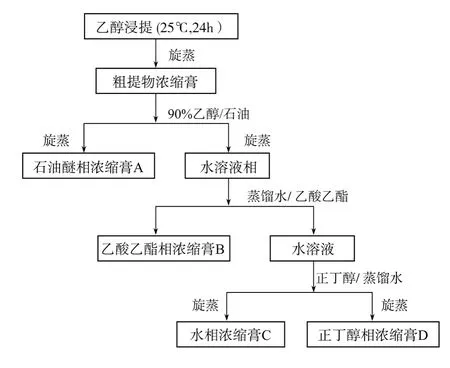
图1 长浒苔中化感物质的液液萃取分离步骤Fig.1 Extractive p roceduresof allelochemicals from E.clathrata
1.2.3 浸提液及化感组分抑藻活性检测 取生长状况良好、处于指数增长期的中肋骨条藻种液与已灭菌的海水f/2(+Si)培养基以1∶3(V/V)混合,充分摇匀。准确移取微藻培养液到体积为250 mL已高温灭菌(121℃,20 min)的锥形瓶中,并按照0,0.5,1,2,4,8 m L的体积分别移取大型藻浸提液母液于已上述藻液中,最终藻液体积为200 mL,且大型藻的浓度分别为0,0.3,0.6,1.2,2.4,4.8 g/L。实验设3个重复。每24 h测定中肋骨条藻的密度,根据藻的生长周期,实验持续7 d。
大型藻浸提液的萃取分离组分均按上述步骤进行抑制实验。
1.3 分析测试方法
1.3.1 数据分析 每24 h采样1 m L,经Lugol’s试剂固定后,用血球计数板在光学显微镜下(Nikon,YS-100)计数藻细胞数量的变化。通过比较6种大型藻对中肋骨条藻的抑制率IR(%)±SD和半效应浓度EC50±SD值来评价大型藻对中肋骨条藻抑制能力强弱。
抑制率计算公式:IR(%)=(1-N/N0)×100%,N0为微藻单独培养时细胞密度(对照组),N是投加大型藻后的微藻细胞密度(处理组)。
大型藻对微藻的半效应浓度EC50值采用内插直线法计算[16]。
数据统计分析使用PASW Statistics 18.0统计软件完成。
1.3.2 化感组分的结构分析 实验采用气相色谱-质谱联用仪(GC-MS)Aglient2006分析化感组分的结构,其中色谱柱型号为HP-5石英毛细管柱(30 m×0.25 mm×0.25μm),程序升温条件:60℃(5 min),60℃升温至280℃(5℃/min),280℃(2 min);注射口温度280℃。M S条件:离子源-70 ev,溶剂延迟时间4 min。
2 结果与讨论
2.1 大型藻浸提液对中肋骨条藻生长的影响
孔石莼、羊栖菜、长浒苔、马尾藻、蜈蚣藻和裙带菜6种大型藻浸提液均能影响中肋骨条藻的生长,其生长曲线的变化如图2。6种受试海藻浸提液对中肋骨条藻的抑制率随浓度的增大而提高,当浓度达到1.2 g/L时,长浒苔对中肋骨条藻的抑制率达到50%,孔石莼、羊栖菜、长浒苔、马尾藻和蜈蚣藻的浸提液在浓度达到2.4 g/L时可在实验周期内使中肋骨条藻全部致死,抑制率达到100%,全部致死所需时间分别为96、120、96、144和144 h。而在大型藻浓度达到4.8 g/L时,6种大型藻均可全部杀死中肋骨条藻,使微藻全部死亡的时间,孔石莼、羊栖菜、长浒苔、马尾藻、蜈蚣藻和裙带菜分别为72、96、72、96、96、120 h,可见随着大型藻浓度的增大,使中肋骨条藻全部死亡所需的时间变短。此外,在6种大型藻的低浓度(0.3 g/L)处理中,中肋骨条藻的生长被轻微的促进,如微藻培养至72 h时,长浒苔的0.3 g/L的浓度处理组,中肋骨条藻的抑制率为-18%,类似的促进中肋骨条藻生长的现象在马尾藻、蜈蚣藻和裙带菜低浓度(0.3 g/L)处理中也同时出现。
王悠等[12]研究了新鲜石莼组织及其培养液滤液对赤潮异弯藻的生长影响。石莼鲜组织的起始浓度愈高,其对赤潮异弯藻生长的抑制作用愈明显。而这种高浓度抑制微藻生长低浓度生长促进微藻生长的现象被成为“低促高抑”现象,其他研究者有类似的发现。南春容等[17]发现:孔石莼浸提液浓度为2 g/L时,赤潮异弯藻在2 d内能完全被杀死,至第7天,中肋骨条藻能完全致死。但是当处理浓度为0.25和0.50 g/L时,2种微藻细胞均从第5天起也出现迅速增殖,至实验结束藻细胞密度大于对照组,表现为促进效应。
本研究表明,6种大型藻浸提液能抑制中肋骨条藻的生长,且浓度越大抑制效果越显著,长浒苔的抑制能力最强,EC50值为1.0 g/L,结合抑制率曲线,2.4 g/L是其抑制中肋骨条藻赤潮的可选用的浓度。
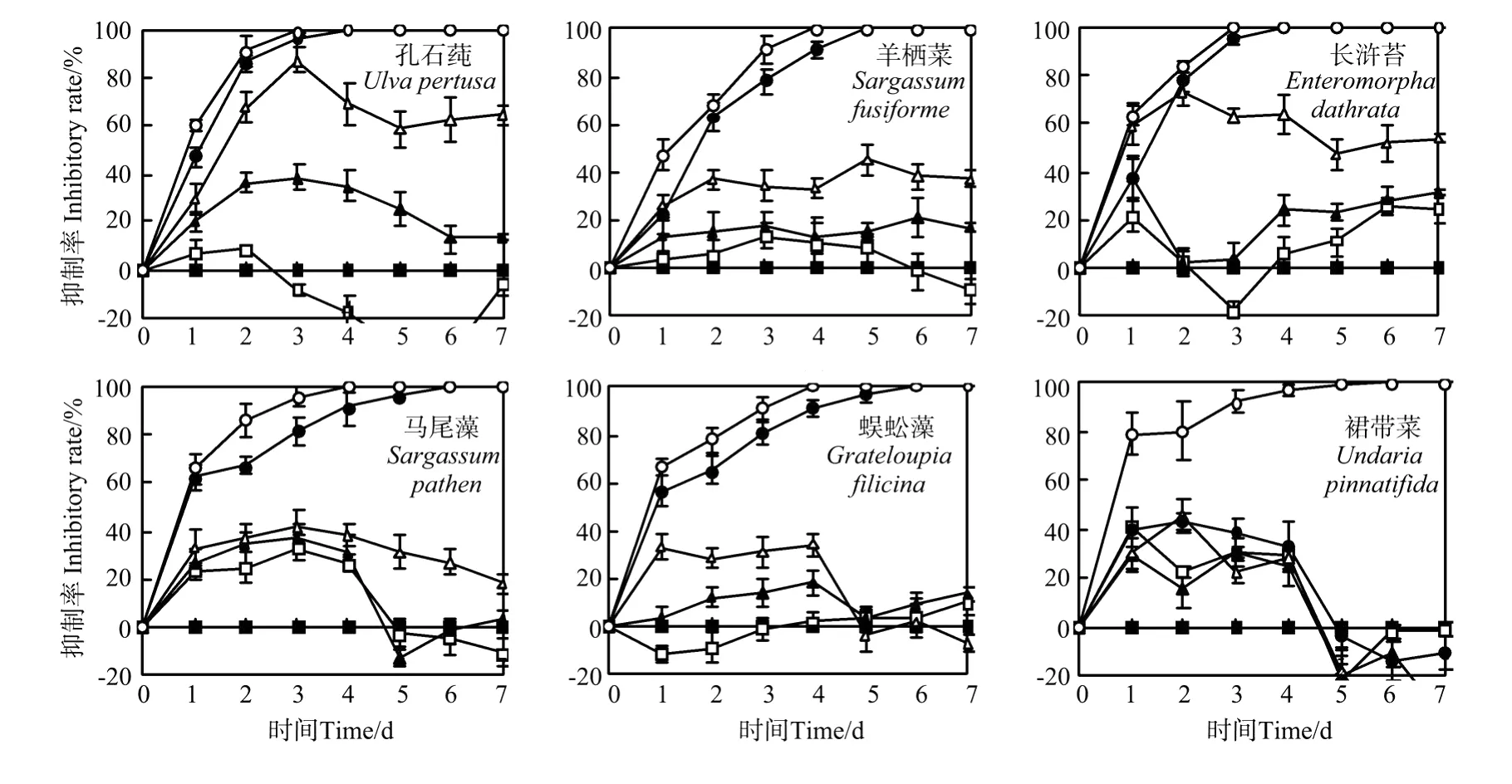
图2 6种大型藻浸提液对中肋骨条藻的抑制率曲线Fig.2 The inhibito ry rate curve of 6 speciesmacroalgal seawater extract on S.costatum grow th
2.2 大型藻浸取液对中肋骨条藻生长的EC50值比较
采用直线内插法计算长浒苔、孔石莼、羊栖菜、马尾藻、蜈蚣藻和裙带菜浸提液对中肋骨条藻的EC50,120h值分别为1.0、1.0、1.1、1.4、2.5和4.7 g/L(见图3)。裙带菜的EC50值最高,为4.7 g/L,其抑制中肋骨条藻生长的能力最弱。长浒苔和孔石莼的EC50最低,结合抑制率结果可以看出,长浒苔和孔石莼对中肋骨条藻的抑制能力最强。相比孔石莼,长浒苔对微藻的化感抑制作用研究相对较少,因此后续的研究中选取长浒苔进行进一步的化感组分的分离。
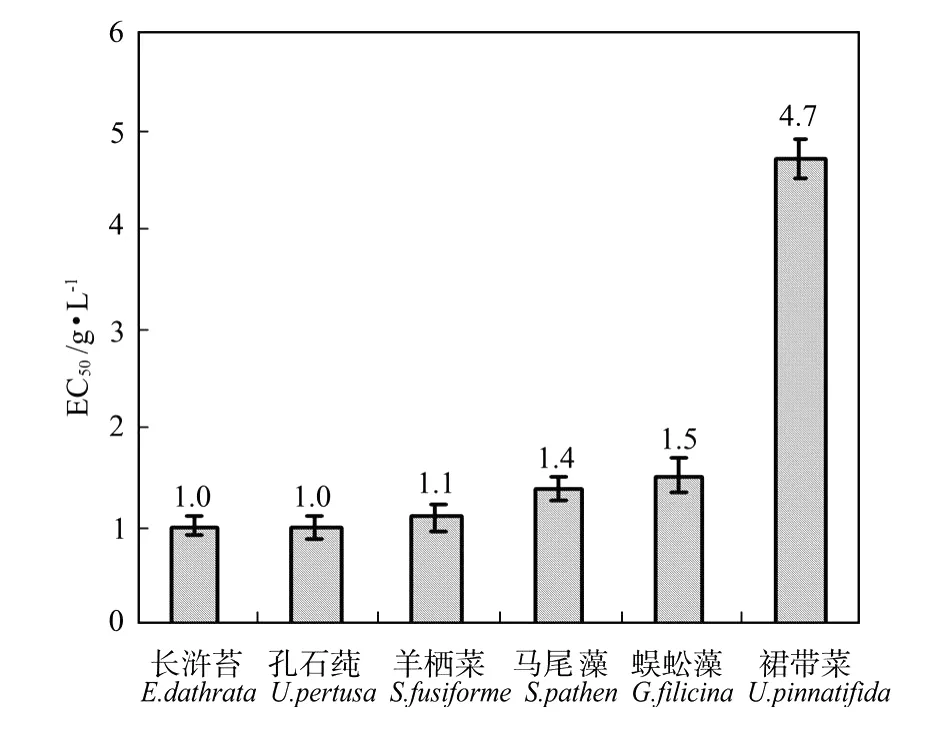
图3 6种大型藻对中肋骨条藻的半效应浓度EC50(g/L)Fig.3 The EC50(g/L)valuesof 6 speciesmacroalgae on S.costatum
半效应浓度EC50是表征抑制剂抑制目标生物能力的指标,EC50值越小,说明抑制剂的抑制作用越强。发表的研究结果显示不同的大型藻对不同的目标微藻抑制能力不同,如石莼干组织对中肋骨条藻的EC50值为0.5 g/L[17],孔石莼有性株干粉末对赤潮异弯藻和塔玛亚历山大藻的EC50值分别为1.0、0.8 g/L[18]。与本研究相比,长浒苔对中肋骨条藻的EC50值为1.0 g/L,显示了较强的抑制能力。本研究中不同的大型藻的干粉末浸提液对同种赤潮藻细胞表现出的不同的生长抑制作用(生长抑制率和半效应浓度)表明中肋骨条藻细胞对不同的大型藻有不同的敏感性。Sanna等[19]认为1种生物体的敏感性取决于该种生物对其所暴露的化感物质的自然属性,同一物种可能对来源不同的化感物质有不同的反应。
目前大部分的研究采用浸提液、滤液[17,20]或胞外分泌物[21]进行,但是能确定并分离到化感物质对于进一步研究化感作用的本质、化感物质的释放、对目标种生理生化的影响,以及化感物质在水体中的迁移都是至关重要的,有研究者试图进行这样的研究,有的能成功[22],有的却未果[23],这也是1个制约化感作用研究的难点。因此,长浒苔抑制中肋骨条藻的生长的作用机理的深入研究以及进一步的应用需要更进一步的化感物质的提取。
2.3 长浒苔化感组分对中肋骨条藻生长的影响
长浒苔浸提液经液液萃取分离后得到4个化感组分A、B、C和D,其对中肋骨条藻的生长影响如图4。在培养3 d内,组分A最大抑制率仅为39%。对于组分B,随浓度的增大对中肋骨条藻生长的抑制率增大,浓度为0.2 mg/L时,在第1天抑制率就几乎达到了60%,至第2天,0.1、0.2、0.4 m g/L浓度处理的抑制率分别为63%、73%和84%,在第3天,0.4 mg/L处理组的抑制率分别达到96%,几乎完全杀死了藻细胞。组分C和D在3 d培养中最大抑制不超过40%。可以看出,组分B的抑藻效果最好。
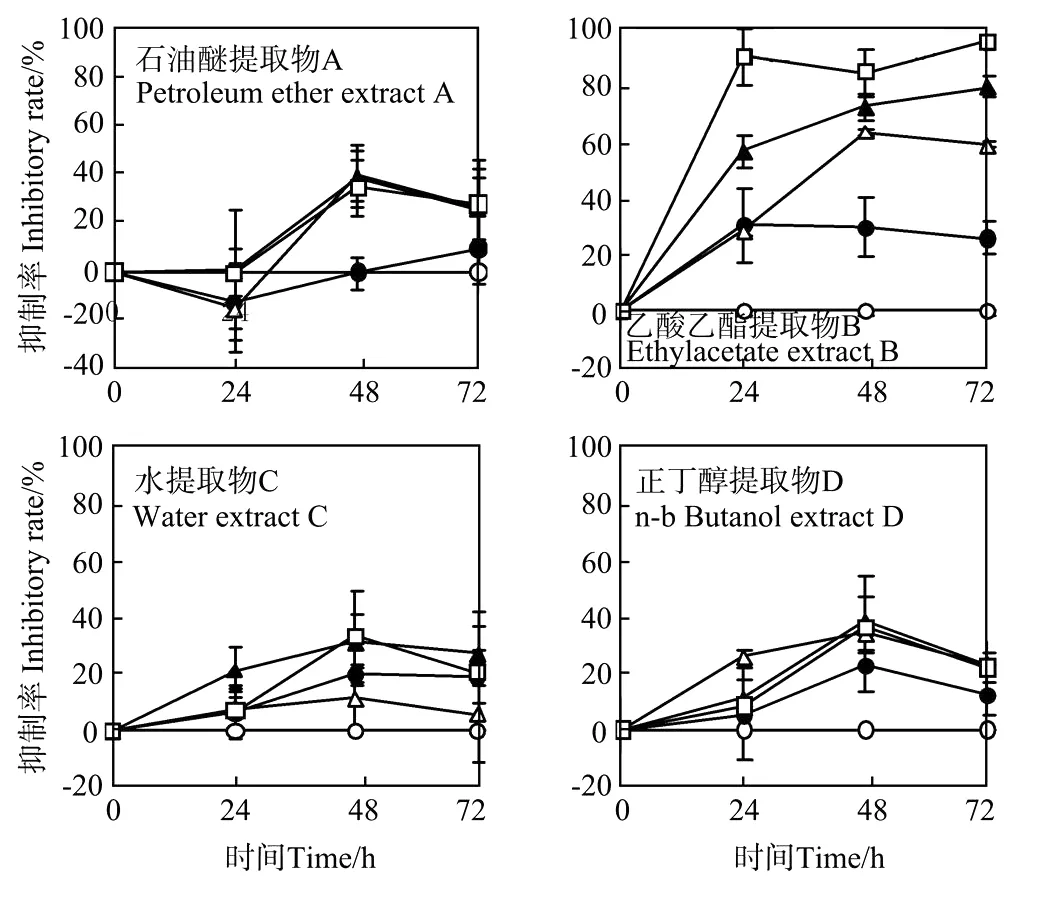
图4 4个液液萃取组分对中肋骨条藻生长72 h的抑制率Fig.4 Inhibito ry rate curve of 4 extractive parts on S.costatum in 72 hours
4个组分对中肋骨条藻的抑制率所得EC50·72h值如表3所示,组分B的EC50最小,为0.08 mg/L。半效应浓度值越低表明其抑制50%藻生长所需浓度越低,抑藻效果越好。该结果与抑制率结果相符,组分B具有最好的抑藻效果。
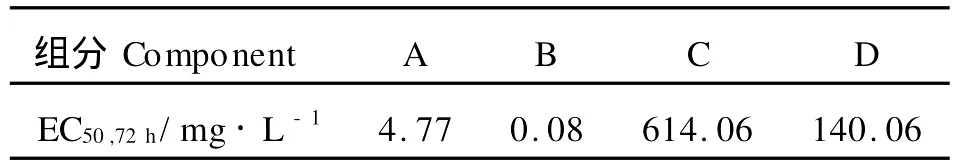
表3 长浒苔4个化感组分的EC50,72hTable 3 EC50,72h of 4 extractive parts on S.costatum
当前已报道的化感物质,槐糖酯、没食子酸抑制亚历山大藻的EC50值大约在10~20 m g/L间[24-25],儿茶酚、对苯二酚的抑藻效果较好,其对铜绿微囊藻的EC50值分别约为0.3、0.059 mg/L[26-27]。卢慧明研究发现大型藻龙须菜的乙醇浸出组分对中肋骨条藻的EC50值为42 mg/L[28],但是没有对其做进一步的分离。本研究中组分B对中肋骨条藻的EC50值为0.08 mg/L,显示了很强的抑藻活性。因此,在后续的研究中采用GC-M S分析组分B中所含物质的结构,找出可能的起作用的化感物质。
3.3.3 化感组分的结构分析 为确定长浒苔中抑藻化感物质的结构,对液液萃取所得4个组分中抑藻效果显著的组分B采用GC-M S分析其中的物质结构,所得色谱图如图5所示,利用M S得到各峰对应的化学物质名称如表5所示。组分B有9个色谱峰(见图5),其中含量最高的3个组分以名称(化学式,保留时间,含量)表示分别为:9-十八炔(C18H34,15.73 min,28.45%)、邻苯二甲酸二异丁酯(C16H22O4,16.34 min,18.58%)、17-烯/十八醛(C18H36O,16.57 min,11.18%)。但是,哪种或哪几种物质是有效的化感物质,仍需进一步研究。
图5 乙酸乙酯萃取组分B的气相峰谱图Fig.5 GC chromatogram of the part B
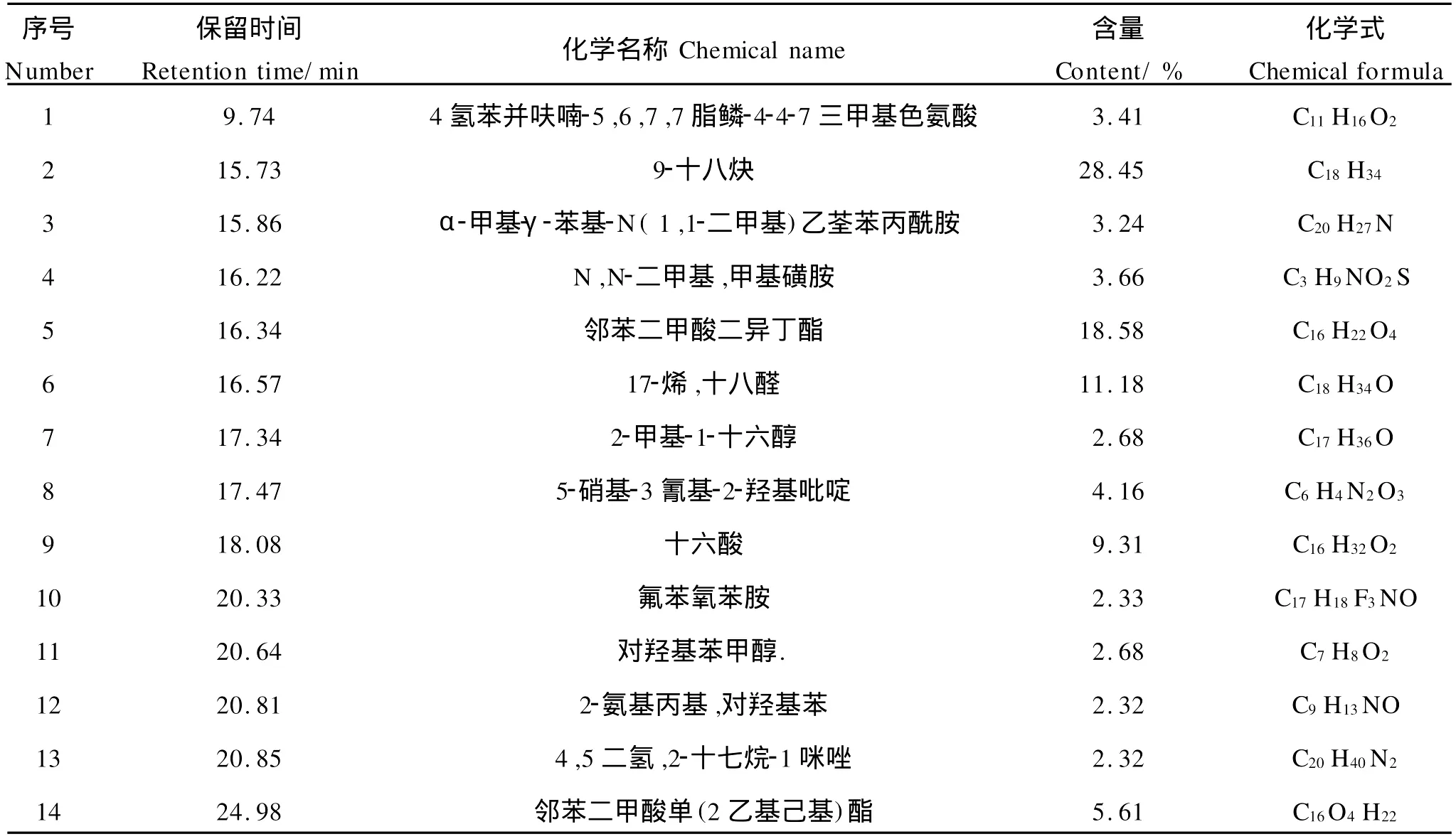
表5 乙酸乙酯萃取组分B的质谱结构分析结果Table 5 Mass results obtained from GC-MSanalysis of the fraction B
3 结语
6种大型藻抑制中肋骨条藻的EC50由小到大依次为:孔石莼1.0 g/L、长浒苔1.0 g/L、羊栖菜1.1 g/L、马尾藻1.4 g/L、蜈蚣藻1.5 g/L,裙带菜4.7 g/L。根据抑制率和半效应浓度2个评价指标,孔石莼和长浒苔对中肋骨条藻的抑制能力最强,其使中肋骨条藻全部致死的浸提液浓度为2.4 g/L。对长浒苔浸提液进行了液液萃取分离,得到具有强抑藻活性的组分即乙酸乙酯萃取相,采用GC-M S初步分析了物质结构,但其化感物质还需进一步分离和鉴定。本研究为长浒苔的开发利用和从中提取分离化感物质进行赤潮防治提供了科学基础。
[1] Sandra E Shumway,Steven M Allen,Boersma P Dee.Marine birds and harm ful algal bloom s,sporadic victims or under-reported events[J]?Harmful Algae,2003(2):1-17.
[2] 中国国家海洋局.2009年中国海洋环境质量公报[Z].北京:国家海洋局,2010.
[3] 赵玲,尹平河,李坤平,等.掺铜可溶玻璃微粒去除海洋原甲藻赤潮生物的研究[J].海洋环境科学,2001,20(1):7-11.
[4] 周名江,于仁成.有害赤潮的形成机制、危害效应与防治对策[J].自然杂志,2007,29(2):72-77.
[5] Molish H.Der Einfluss einer Pflanze die andere-A llelopathie[M].[s.l.]:Fischer Jena,1937.
[6] Rice E L.Allelopathy[M].2ndedition.London:Academic Press.1984.
[7] Harminder P Singh,Daizy R Batish,Ravinder K Kohli.Allelopathic effect of two volatile monoterpenes against bill goat weed(Ageratum conyzoides L.)[J].Crop Protection,2002,21:347-350.
[8] 徐永健,钱鲁闽,焦念志.添加大型海藻龙须菜对中肋骨条藻赤潮的影响[J].台湾海峡,2005,24(4):532-539.
[9] Wang Renjun,Xiao Hui,Wang You,et al.Effectsof threemacroalgae,U lva linza(Chlorophyta),Corallina pilulifera(Rhodophyta)and Sargassum thunbergii(Phaeophyta)on the grow th of the red tidemicroalga Prorocentrum donghaiense under laboratory conditions[J].Journal of Sea Research,2007(58):189-197.
[10] 张余霞,张玲,张阳阳,等.盐京九号水稻秸秆对铜绿微囊藻(Microcystis aeruginosa)的抑制作用[J].生态与农村环境学报,2008,24(3):60-63.
[11] 李锋民,胡洪营,种云霄,等.芦苇化感物质EMA对铜绿微囊藻生理特性的影响[J].中国环境科学,2007,27(3):377-381.
[12] 王悠,俞志明,宋秀贤,等.共培养体系中石莼和江蓠对赤潮异弯藻生长的影响[J].环境科学,2006,27(2):246-252.
[13] 雷光英,杨宇峰,李宵.龙须菜对赤潮异弯藻和海洋原甲藻的生长抑制效应[J].海洋环境科学,2010,29(2):27-31.
[14] 徐家声.近海虾池与赤潮[M].第1版.北京:海洋出版社,2003:27-28.
[15] Guillard R R L,Ryther J H.Studies on marine planktonic diatoms.I.Cyclotella nana(Hustedt)and Detonula confervacea(Cleve)[J].Can J Microbiol,1962,8:229-239.
[16] 周永欣,章宗涉.水生生物毒性试验方法[M].北京:农业出版社.1989:109-133.
[17] Nan Chunrong,Zhang Haizhi,Lin Shaozhen,et al.Allelopathic effects of Ulvalactuca on selected species of harmful bloom-forming microalgae in laboratory cultures[J].Aquatic Botany,2008,89:9-15.
[18] JIN Qiu,DONG Shuanglin.Comparative studies on the allelopathic effects of two different strains of Ulva pertusa on Heterosigma akashiwo and A lexandrium tamarense[J].Journal of Experimental Marine Biology and Ecology,2003,293:41-55.
[19] Sanna Suikkanen,Giovana O Fistarol,Edna Granéli.Allelopathic effects of the Baltic cyanobacteria Nodularia spum igena,A phanizomenon flos-aquae and Anabaena lemmermannii on algal monocultures[J].Journal of Experimental Marine Biology and Ecology,2004,308:85-101.
[20] Urban Tillmann,Uwe John,Allan Cembella.On the allelochemical potency of themarine dinoflagellate Alexandrium ostenfeldii against heterotrophic and autotrophic protists[J].Journal of Plankton Research.2007,29(6):527-543.
[21] Emily K Prince,Tracey L Myers.Effects of harmful algal bloomson competitors:allelopathic mechanisms of the red tide dinoflagellate Karenia brevis[J].Limnology and Oceanography,2008,53(2):531-541.
[22] Li Feng-Min,Hu Hong-Ying.Isolation and characterization of a novel antialgal allelochemical from Phragm ites communis[J].Applied and Environmental Microbiology,2005,71(11):6545-6553.
[23] Emily K Prince,Kelsey L Poulson,Tracey L Myers,et al.Characterization of allelopathic compounds from the red tide dinoflagellate Karenia brevis[J].Harmful Algae,2010,10:39-48.
[24] Sun Xiao-Xia,Choi Joong-Ki,Kim Eun-Ki.A preliminary study on the mechanism of harmful algal bloom mitigation by use of sophorolipid treatment[J].Journal of Experimental Marine Biology and Ecology,2004,304:35-49.
[25] 杨维东,张信连,刘洁生.酚酸类化感物质对塔玛亚历山大藻生长的影响[J].中国环境科学,2005,25(4):417-419.
[26] Francisco A Macías,Ascensión Torres,JoséL G Galindo,et al.Bioactive terpenoids from sunflower leaves cv.Peredovick?[J].Phytochemistry,2002,61:687-692.
[27] 丁惠君,张维昊,周伟斌,等.两种酚酸类化感物质对铜绿微囊藻生长的影响[J].环境科学与技术,2007,30(7):1-3.
[28] 卢慧明,廖小建,杨宇峰,等.大型海藻龙须菜浸出组分对中肋骨条藻的化感抑制作用[J].生态科学,2008,27(5):424-426.
