厚叶切氏海带多糖的提取分离及其结构表征*
2011-01-10吴建东于广利李苗苗王长云顾晨曦
吴建东,于广利**,李苗苗,赵 峡,王长云,刘 涛,顾晨曦
(中国海洋大学1.海洋药物教育部重点实验室;2.山东省糖科学与糖工程重点实验室;3.生命学院,山东青岛266003)
厚叶切氏海带(Kjellmaniella crassifolia)属于褐藻门、褐藻纲、海带目、切氏海带属,是日本海域一种重要的褐藻资源。虽然国外学者对该类海藻水提取物的抗氧化活性[1]、免疫活性、褐藻胶M/G比[2-3]以及岩藻糖硫酸酯降解酶[4]等进行了相关研究,但没有对其分离纯化以及深入的理化性质研究。本文首次以该海藻为原料,采用不同的提取、分离方法,从中得到4种结构不同的多糖,并对其理化性质和结构特征进行比较和分析。
1 材料与方法
1.1 材料与仪器
厚叶切氏海带(Kjellmaniella crassifolia),产地为日本。各种单糖标准品,标准牛血清白蛋白购于美国Sigma公司;葡聚糖系列分子量标准品(788,404,212,112,47.3,22.8,5.9 kD)购于日本Shodex公司;1-苯基-3-甲基-5-吡唑啉酮(PM P),购于美国Sigma-A ldrich公司;色谱级乙腈购于美国B&W公司;乙醇等其它试剂均为国产分析纯。
高效凝胶色谱柱(PL aquagel-OH mixed,30 cm×7.5 mm,8μm,美国Perkin Elmer公司);XDB-C18色谱柱(4.6 mm×150 mm,5μm,美国Agilent公司);高效液相色谱仪(LC-20AD,日本岛津公司);核磁共振波谱仪(JNM-ECP600,日本电子株式会社);紫外可见分光光度计(UV-2102 PCS,尤尼柯上海公司);冷冻干燥仪(ALPHA 1-4LD,德国CHRIST公司)。
1.2 实验方法
1.2.1 多糖的提取分离[5]厚叶切氏海带(40目)经甲醇和氯仿提取后40℃烘干备用。藻粉用15倍体积蒸馏水在80℃下搅拌提取3次(3 h/次),离心后合并上清液。上清液用稀盐酸调节至p H=1,离心,收集沉淀和上清液。沉淀以适量NaOH溶解,透析后冻干得多糖KW1。上清液中和后加入适量CaCl2,离心收集上清液,经浓缩、透析、醇沉和干燥得粗多糖。该粗多糖经DEAE-Cellulose柱(XK16/20cm)纯化后得到纯品多糖KW2。残余藻渣继续用10倍体积2%Na2CO3于80℃提取3 h,重复3次,离心合并上清液,稀盐酸中和后醇沉,经离心后分别收集沉淀和清液。沉淀经复溶后透析、浓缩和冻干,得多糖KA1;醇沉后上清液,经浓缩、透析、醇沉和干燥,得多糖KA2。
1.2.2 多糖醋酸纤维素膜电泳[6]采用王皓等报道的方法对多糖进行醋酸纤维素膜电泳分析,即以0.15 mol/L醋酸锌(p H=6.3)为缓冲液,电流8 m A,电泳时间35 min。
1.2.3 相对分子量测定[7]采用HPGPC法,使用PL aquagel-OH mixed色谱柱测定多糖分子量;流动相为0.1 mol/L NaNO3水溶液,柱温35℃,流速0.5 m L/min,示差检测器。将各葡聚糖系列标准品及多糖样品用流动相配成5 mg/m L水溶液,以标准葡聚糖分子量的对数(log M w)对色谱保留时间(tR)作图,得标准曲线(log M w=14.84-0.648 tR;R2=0.996 8),计算样品相对分子量。
1.2.4 多糖理化性质分析[5,8-10]用硫酸苯酚法以岩藻糖为标准品测定总糖含量;用硫酸钡比浊法测定硫酸根含量;用硫酸咔唑法测定糖醛酸含量;用Folin-酚法测定粗蛋白含量。
1.2.5 单糖组成分析[5,11]将多糖进行全水解,经PM P衍生后采用高效液相色谱分析。色谱条件为:色谱柱:Agilent XDB-C18色谱柱;流动相:磷酸盐缓冲液(p H=6.7)/CH3CN(83∶17,V/V);流速:1.0 m L/min;柱温:25℃;进样量:10μL;检测器:DAD(245 nm)。
1.2.6 核磁共振氢谱(1H-NM R)分析 参照Grasdalen[12-14]的方法,将KW1与KA1用稀酸解聚(p H=3,80℃,1 h)后,经中和、透析和冻干,再经D2O交换3次,超导核磁共振波谱仪(ECP600 M Hz)于80℃测定。
2 结果与讨论
2.1 多糖的提取
海藻经氯仿甲醇脱脂后40℃烘干,粉碎过40目筛备用。热水提取时提取液粘度很大,气味清香,KW1和KW2得率为13.4%和4.2%,而热碳酸钠水溶液提取多糖KA1和KA2得率分别为17.2%和1.2%。单糖组成分析表明,KW1和KA1为褐藻胶。KW2经DEA E-Cellulose弱阴离子交换柱0~2 mo l/L NaCl线性洗脱,在1.1 mol/L NaCl附近有单一峰,结果见图1。

图1 KW2在DEAE-Cellulose柱上的分离图谱Fig.1 Separation graph of KW 2 on DEAE-Cellulose column
2.2 醋酸纤维素膜电泳分析
经醋酸纤维素膜电泳分析,KW2显示单一条带,其Rf值小于硫酸软骨素A(CsA)、硫酸皮肤素(CsB)和硫酸软骨素C(CsC),但与肝素(Hep)和乙酰肝素(HS)相似。KA2显示为2条带,其Rf值分别和CsA合CsB相近。由于采用醋酸锌为缓冲液,KW1与KA1与锌离子络合形成沉淀,没有发生泳动。由于选取的电泳条件适合硫酸多糖,可以以此推定KW2和KA2为硫酸多糖,也进一步验证了KW1与KA1为不含硫酸根的褐藻胶。
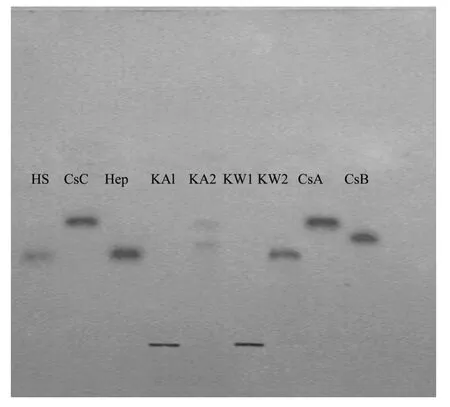
图2 4种多糖的醋酸纤维素膜电泳Fig.2 Cellulose acetatemembrane electrophoresis of four polysaccharides
2.3 多糖的基本理化性质分析
为了探讨不同提取方法所得多糖的理化性质,本文分别测定了它们的总糖含量、硫酸基含量、糖醛酸含量和粗蛋白含量,并用高效凝胶渗透色谱(HPGPC)测定了它们的相对分子量,结果见表1。从表中数据可知,KW2硫酸基含量高达30%,此外还含有5%糖醛酸以及少量蛋白,属于一种硫酸酯化的多糖;KA2含有21%硫酸根,但其粗蛋白含量高达17%,这与采用碱提方法有关,需要采用其它方法进一步纯化。
2.4 硫酸多糖的单糖组成分析
将KW2和KA2进行全水解后,采用PM P柱前衍生高效液相色谱法进行单糖组成测定。通过与10种单糖标准品比较确定其种类和含量。由于核磁共振氢谱可以精确地分析褐藻胶的结构,且褐藻胶样品酸水解时对G和M的破坏率存在显著差异,故不用高效液相色谱法分析2种褐藻胶样品的单糖组成。
从表2可知,KW2的单糖组成相对简单,以岩藻糖为主(82%),此外含有少量M an、GlcUA和Gal以及微量Glc和GlcN,是一种硫酸岩藻聚糖(Fucoidan),KW2与Sakai提取的SFGM单糖种类类似,但比例不同[4]。KA2与KW2单糖种类一致,但是比例显著不同,和KW2相比,KA2中Fuc含量明显减小,Gal含量显著增大,且粗蛋白含量也较高。表明二者结构不同,KW2属于Fucoidan,而KA2则属于硫酸化岩藻半乳甘露杂聚糖(SFGM)。由于KW2和KA2是采用不同工艺获得的2类结构不同的硫酸多糖,其生物活性的差别还有待于进一步研究。
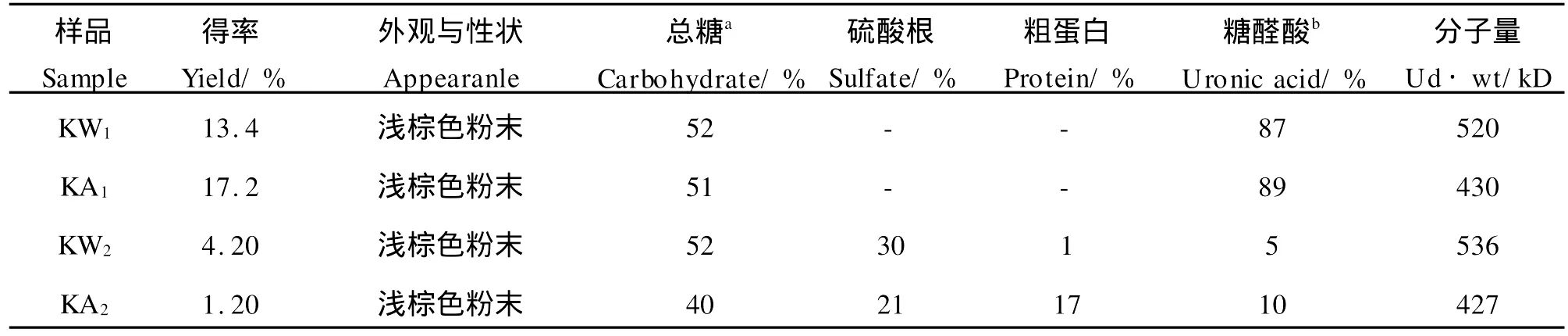
表1 4种多糖的基本理化性质比较Table 1 Comparison of physicochemical p roperties of four polysaccharides
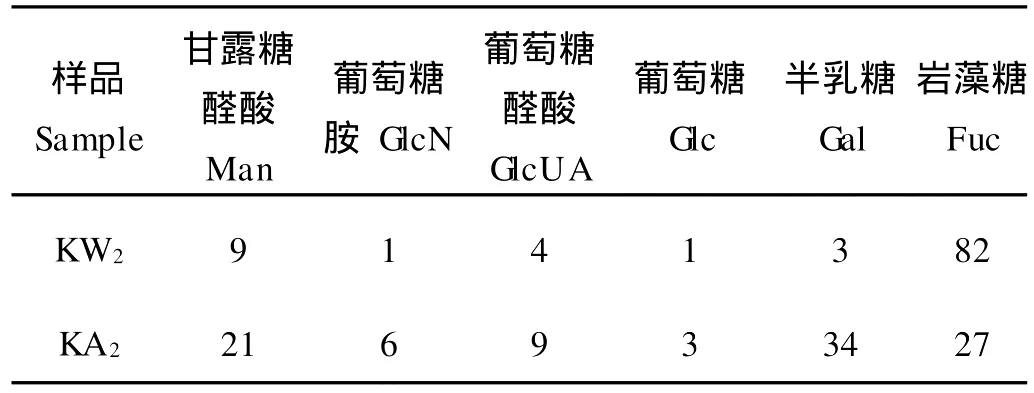
表2 2种硫酸多糖中单糖组成及其相对比例/%Table 2 Monosaccharide composition and ratio of KW2 and KA2

图3 KW2的核磁共振氢谱图Fig.3 1 H-NMR spectrum of KW2
2.5 KW 2的核磁共振氢谱(1 H-NM R)分析
1H-NM R谱可以初步分析岩藻聚糖硫酸酯的硫酸根位置以及岩藻糖化学环境[15]。KW2的岩藻糖异头氢(5.38,5.28,5.26 ppm)比标准品[16]向低场偏移0.2~0.3 ppm,说明KW2的岩藻糖2位被硫酸根取代,而H4也大幅向低场偏移,说明其C4位也存在硫酸根取代。结合文献[17],初步认为KW2的岩藻糖存在C2,4双硫酸酯基取代。高场区岩藻糖甲基(1.0~2.0 ppm)的多重信号,表明岩藻糖的化学环境复杂。
2.6 KW 1与KA1核磁共振氢谱(1 H-NMR)分析
文献表明,采用1H-NM R谱可以精确地表征褐藻胶的单糖组成、二糖组成(GG,GM,GM,MM)和三糖组成(GGG,GGM,M GM,M GG),进而反映出褐藻胶的嵌段分布,该细微结构的差别不仅影响其凝胶特性,也影响其生物活性。单体G的异头氢质子G1的信号为5.01 ppm,单体G的第五位碳上的质子与G相连时,其化学位移为4.40 ppm(记为G5);当两边与G和M连接时,其化学位移为4.70 ppm(记为GGM),当两边均与M相邻时,其化学位移为4.67 ppm(记为M GM)。单体M的异头质子当与M相邻时,其化学位移为4.62 ppm(记为MM),当与单体G相连时,其化学位移为4.65 ppm(记为M G)。根据该技术,可以将不同来源和不同提取工艺获得的褐藻胶进行比较。参照Grasdalen[12-14]的方法,褐藻胶KW1与KA1的结构表征如图4和表3。从图4可知,KW1无G5峰,表明该组分没有均聚G片段,而是以均聚M为主的褐藻胶,但是萱藻中的褐藻胶M SA(见图4D)则是以均聚G为主。KA1和多肋藻褐藻胶ALG(见图4E)结构类似。

图4 不同来源褐藻胶1 H-NMR谱图Fig.4 1 H-NM R spectra of alginates f rom different o rigin
表3数据显示,热水提取褐藻胶组分KW1中M/G高达6.14,而热碳酸钠水溶液提取得到的褐藻胶组分KA1中M/G只有1.90,表明它们在藻体细胞壁中处于不同状态,后者G含量高,结合钙镁离子能力强,处于水不溶状态,必须用热碳酸钠才能提取;前者M含量高,和金属离子结合能力弱,采用热水即可提取。该结果具有一定普遍性,本实验室采用类似工艺分别从其它褐藻中提取得到了不同结构的褐藻胶[18-20],热水提取的褐藻胶M含量较高,而热碳酸钠提取的褐藻胶G含量较高,这为从不同褐藻中提取结构不同的褐藻胶提供了参考。

表3 不同来源褐藻胶的细微结构比较Table 3 Fine structure comparison of alginates from different o rigin
3 结语
本文采用热水和热碳酸钠工艺,从厚叶切氏海带(Kjellm aniella crassifolia)中提取分离获得了4种结构不同的多糖,并采用各种方法(如HPLC、HPGPC、电泳和核磁共振波谱等)分析了它们的结构特征。其中2种属于含有不同岩藻糖含量的硫酸多糖,另外2种属于含有不同甘露糖醛酸与古罗糖醛酸含量的褐藻胶。值得提出的是,水提取和碳酸钠提取的褐藻胶以及褐藻糖胶的结构均显著不同。这些资源丰富且结构特殊的多糖,为深入开展其构效关系研究提供了基础。
[1] Kim B M,Jun J Y,Park YB.Antioxidative activity of methanolic extracts from seaweeds[J].J Korean Soc Food Sci Nutr,2006,35(8):1097-1101.
[2] Nishid E,Obraba N,Anazai H.Effects of extracting conditions on the properties of alginic acid from a brow n alga Kjellmaniella crassifolia[J].Bull Coll Agr&Vet Med,1992,49:133-136.
[3] Nishid E,Anazai H,Uchida N,et al.Extraction of alginic acid from a Brazillian brow n alga,Lam inaria brasiliensis[J].Hydrobiologia,1987,151/152(1):551-555.
[4] Sakai T,Kawai T,Kato I,et al.Isolation and characterization of a fucoidan-degrading marine bacterial strain and its fucoidanase[J].Mar Biotechnol,2004,6:335-346.
[5] Yu Guangli,Yang Bo,Zhao Xia,et al.A Comparative Analysis of Four Kinds of Polysaccharides Purified from Furcellaria lumbricalis[J].JOcean Univ China,2007,6(1):16-20.
[6] Wang Hao,Yu Guangli,Zhao Xia,et al.Two steps cellulose acetatemembrane electrophoresis analysis of oversulfated chondroitin sulfate in contaminated heparin[J].Chinese J Anal Chem,2009,37(8):1147-1151.
[7] 于广利,胡艳南,杨波,等.海萝藻多糖的提取分离及其结构表征[J].中国海洋大学学报:自然科学版,2009,39(5):925-929.
[8] 王培培,于广利,杨波,等.选育羊栖菜与野生羊栖菜中褐藻胶与褐藻糖胶组成分析[J].中国海洋药物,2009,28(3):39-43.
[9] 嵇国利,于广利,吴建东,等.爆发期条浒苔多糖的提取分离及其理化性质研究[J].中国海洋药物,2009,28(3):7-12.
[10] 张维杰.糖复合物生化研究技术[M].第2版.杭州:浙江大学出版社,1999:36.
[11] 付海宁,赵峡,于广利,等.盐藻多糖单糖组成分析的四种色谱方法比较[J].中国海洋药物,2008,27(4):30-34.
[12] Grasdalen H A PM R.Study of the composition and sequence of urinate residues in alginates[J].Carbohydr Res,1979,68:23-31.
[13] Grasdalen H.13C-n.m.r.studies of monomeric composition and sequence in alginate[J].Carbohydr Res,1981,2:179-191.
[14] Grasdalen H.High-field 1H-n.m.r.spectroscopy of alginate:sequential structure and linkage conformations[J].Carbohydr Res,1983,118:244-260.
[15] Pomin V H,Valente A P,Pereira M S,et al.Mild acid hydrolysis of sulfated fucans:a selective 2-desulfation reaction and an alternative app roach for preparing tailored sulfated oligosaccharides[J].Glycobiology,2005,15(12):1376-1385.
[16] Ribeiro A,Vieera R,Mourao P,et al.A sulfated a-L-fucan from sea cucumber[J].Carbohydr Res,1994,255:225-240.
[17] Bilan,Grachev,Ustuzhanina,et al.A highly regular fraction of a fucoidan from the brown seaweed Fucus distichus L.[J].Carbohydr Res,2004,339:511-517.
[18] 吴建东,于广利,王培培,等.高古罗糖醛酸含量萱藻(Scytosiphon lomentarius)多糖细微结构研究[J].海洋科学,2011,35(1):40-43.
[19] 王培培,于广利,赵峡,等.海茸(Durvillaea Antarctica)多糖的分离纯化与结构表征[J].中国海洋药物,2010,29(5):1-5.
[20] 李苗苗,于广利,吴建东,等.多肋藻(Costaria costata)多糖的提取分离及理化性质分析[J].中国海洋药物,2011,30(1):1-5.
