栉孔扇贝血细胞数量变化与生长的关系*
2011-01-10林听听蒋经伟战文斌
林听听,邢 婧,蒋经伟,战文斌
(中国海洋大学海水养殖教育部重点实验室,山东青岛266003)
贝类缺乏免疫球蛋白和淋巴系细胞,其免疫防御功能主要依赖于与天然免疫有关的细胞免疫和体液因子免疫[1]。参与细胞免疫的细胞为血细胞,它是贝类抵御外来病原和环境刺激的主要“屏障”。血细胞主要通过吞噬、氧化杀伤、结节形成、细胞凝块、黑化等过程起到免疫防御作用;此外其还通过释放各种活性因子辅助调理体液因子免疫;以及参与贝类的营养运输、伤口修复、贝壳矿化、消化排泄等各项生理活动[2-4]。因此,血细胞在贝类的免疫防御和生理功能中起着关键作用。
国内外众多研究表明贝类受外来病原和环境刺激时,其血细胞总数会发生显著变化[5]。如贻贝(Mytilus edulis)经Cu2+[6]、浪蛤(Mactra veneriform is)经低温[7]、扇贝(Chlamys farreri)经盐度[8]和饥饿[9]等外来胁迫时,其血细胞总数均会骤减。此外,还有研究表明贝类的血细胞总数会因食物丰度、生长和繁殖周期等呈现出节律性变化。如Duchemin等[10]发现牡蛎(Crassostrea gigas)在繁殖前期血细胞总数大、吞噬力强、死亡率低;而在繁殖期,血细胞总数特别低、吞噬力弱、死亡率高;Carballal等[11]研究发现贻贝(Mytilus galloprovincialis)在食物丰度高的季节,生长旺盛,对应的血细胞总数较高;在适宜的水温,其血细胞总数明显高于过低和过高的水温。综合以上的研究,血细胞数量变化与贝类生理和免疫防御反应密切相关。
栉孔扇贝(C.farreri)是我国北方沿海重要的经济贝类之一,形成规模化养殖已有将近30 a的历史,然而近10 a来由于养殖环境的老化,病原体的侵袭以及扇贝种质及抗病力的衰退,栉孔扇贝夏季大规模死亡现象时有发生[12-16]。本文对不同地区、不同品种间的栉孔扇贝在生长过程中血细胞数量的变化进行监测,以期为了解血细胞在扇贝生长发育中的作用以及扇贝健康养殖提供理论依据。
1 材料与方法
1.1 栉孔扇贝的采集
于2009年3月至2010年1月,每月中旬从青岛和威海2地分别采集人工养殖和野生的栉孔扇贝(Chlamys farreri)样品。各采样点、各时期的扇贝分别随机采样100只,清除壳上的污泥和寄生物后,用游标卡尺测量壳长,记录数据。
1.2 血细胞样品的制备
从采集的扇贝中随机抽取10只,现场取血。用灭菌的、内含抗凝剂(0.02 mol/L EDTA,0.14 mol/L NaCl,3 mmol/L KCl,8 mmol/L Na2HPO4,1.5 mmol/L KH2PO4,p H=7.4)的注射器从扇贝闭壳肌血窦中按体积比1∶1抽血,每只扇贝抽取1 mL血淋巴;血淋巴与抗凝剂混合液于4℃、700 r/min、离心10 min;所得沉淀用1 m L抗凝剂重悬;重悬液经超声波细胞破碎仪破碎后,分装,-80℃冻存。
1.3 抗栉孔扇贝血细胞特异性单克隆抗体的筛选
从抗栉孔扇贝血细胞的单克隆抗体(以下简称单抗;由中国海洋大学水产动物病害与免疫学研究室研制)库中,通过间接免疫荧光法[17]和western blotting法[17]鉴定单抗与栉孔扇贝血细胞的反应特性,筛选出能与颗粒血细胞和透明血细胞特异性结合,并能与多个血细胞蛋白结合的抗栉孔扇贝血细胞特异性单抗。
1.4 酶联免疫吸附法(EL ISA)检测血细胞样品
将1.2节中的冻存样品在4℃下融化并包被于96孔酶标板孔内,每孔100μL,4℃过夜;弃去孔内液体,每孔加200μL含1.0%吐温-20的PBS(简称:PBST)洗涤3次,5 min/次,洗完后每孔加200μL 3.0%牛血清白蛋白溶液,37℃封闭1 h;弃去孔内液体,PBST洗涤3次后,每孔加100μL筛选出的一抗,37℃孵育1.5 h;弃去孔内液体,PBST洗涤3次后,每孔加100μL碱性磷酸酶(简称:AP)标记的羊抗小鼠二抗稀释液,37℃孵育1 h;弃去孔内液体,PBST洗涤3次后,每孔加100μL新配的、以mpNPP为底物的AP显色液,室温反应20 min;每孔加50mmμL 2 mol/LNaOH终止显色反应;于酶标仪405 nm波长下读数,记录数据。
1.5 数据分析
每样品重复检测5次,用O rigin 8.0软件处理数据并作图,用Duncan多重比较分析各值间的差异性(P<0.05表示差异显著)。
2 结果
2.1 抗栉孔扇贝血细胞特异性单抗的筛选
经间接免疫荧光法和western blotting法从抗栉孔扇贝血细胞的单抗库中成功筛选到了1株符合以上2点要求的单抗1F7。该单抗阳性率高,并能与颗粒血细胞和透明血细胞特异性结合(见图1);且能与血细胞蛋白成分中的多个蛋白(蛋白带>8条)特异性结合(见图2)。
2.2 壳长
青岛地区的人工养殖扇贝,3月份时的壳长一般为(2.5±0.28)cm;3~8月这一时段增长迅速,其中8月的壳长已达(6.0±0.26)cm;8月之后,壳长虽继续增加,但增加幅度明显减缓,次年1月的壳长为(7.3±0.28)cm,较8月份仅增长1.3 cm左右(见图3A)。野生扇贝的壳长虽在各时段均小于人工养殖扇贝,但增长趋势与人工养殖扇贝基本相同,即3月的壳长为(2.4±0.25)cm,3~8月份增长迅速,其中8月份的壳长已达(5.5±0.22)cm;8月之后,壳长虽继续增加但幅度明显减缓,次年1月的壳长为(6.9±0.22)cm,较8月份仅增长1.4 cm左右(见图3A)。
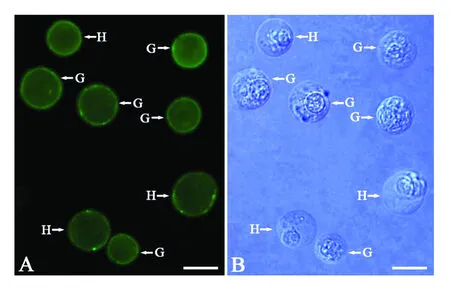
图1 单抗1F7与栉孔扇贝血细胞反应的间接免疫荧光法检测结果Fig.1 MAb 1F7 reacted with haemocytes of C.farreri detected by indirect immun of luoresence assay
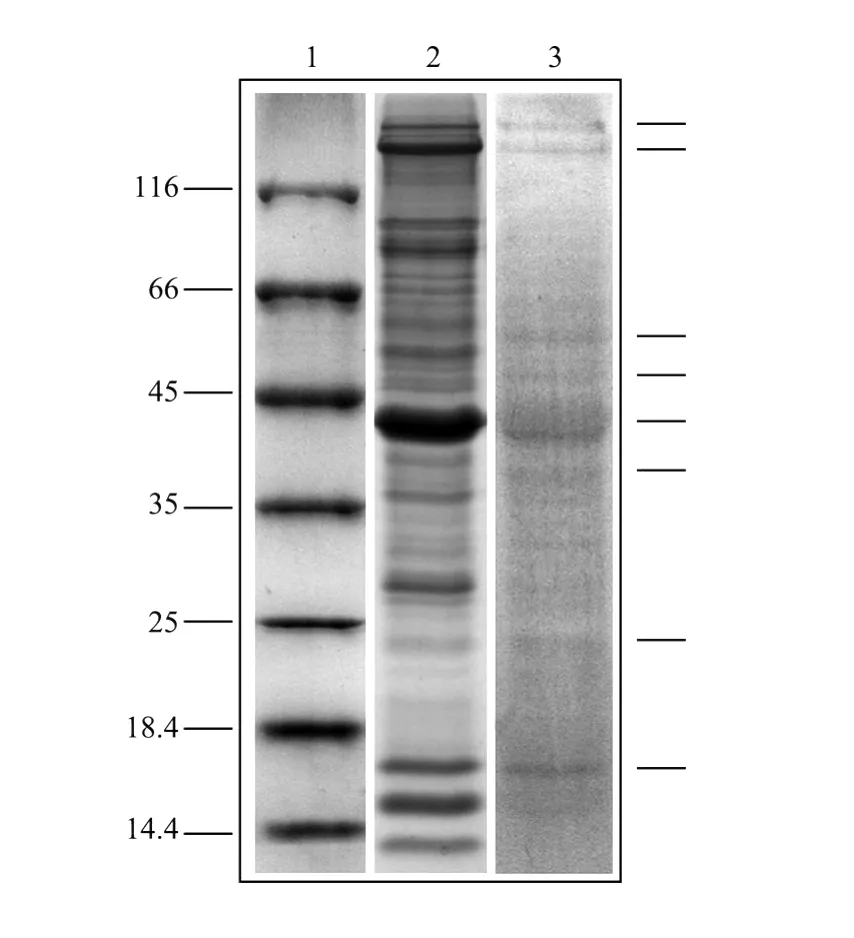
图2 单抗1F7与栉孔扇贝血细胞反应的western blotting检测结果Fig.2 MAb 1F7 reacted with haemocytes of C.farreri tested by western blotting
威海地区的人工养殖扇贝3、4月的壳长分别为(2.4±0.24)和(2.6±0.31)cm;4~8月增长迅速,其中8月份的壳长已达(6.2±0.28)cm;8月之后,壳长虽继续增加,但增加幅度明显减缓,次年1月份的壳长为(7.3±0.24)cm,较8月仅增长1.1 cm左右(见图3B)。野生扇贝的壳长虽在各时段均小于人工养殖扇贝,但增长趋势与人工养殖扇贝基本相同,即3,4月的壳长分别为(2.2±0.24)和(2.5±0.31)cm;4~8月这一时段同样增长迅速,其中8月的壳长已达(5.8±0.22)cm;8月份之后,壳长虽继续增加但幅度明显减缓,次年1月的壳长为(7.2±0.24)cm,较8月仅增长1.4 cm左右(见图3B)。

图3 青岛(A)和威海(B)两地区人工养殖的和野生的栉孔扇贝壳长Fig.3 Shell height of artificial breeding and wild species of C.farreri in Qingdao(A)and Weihai(B)
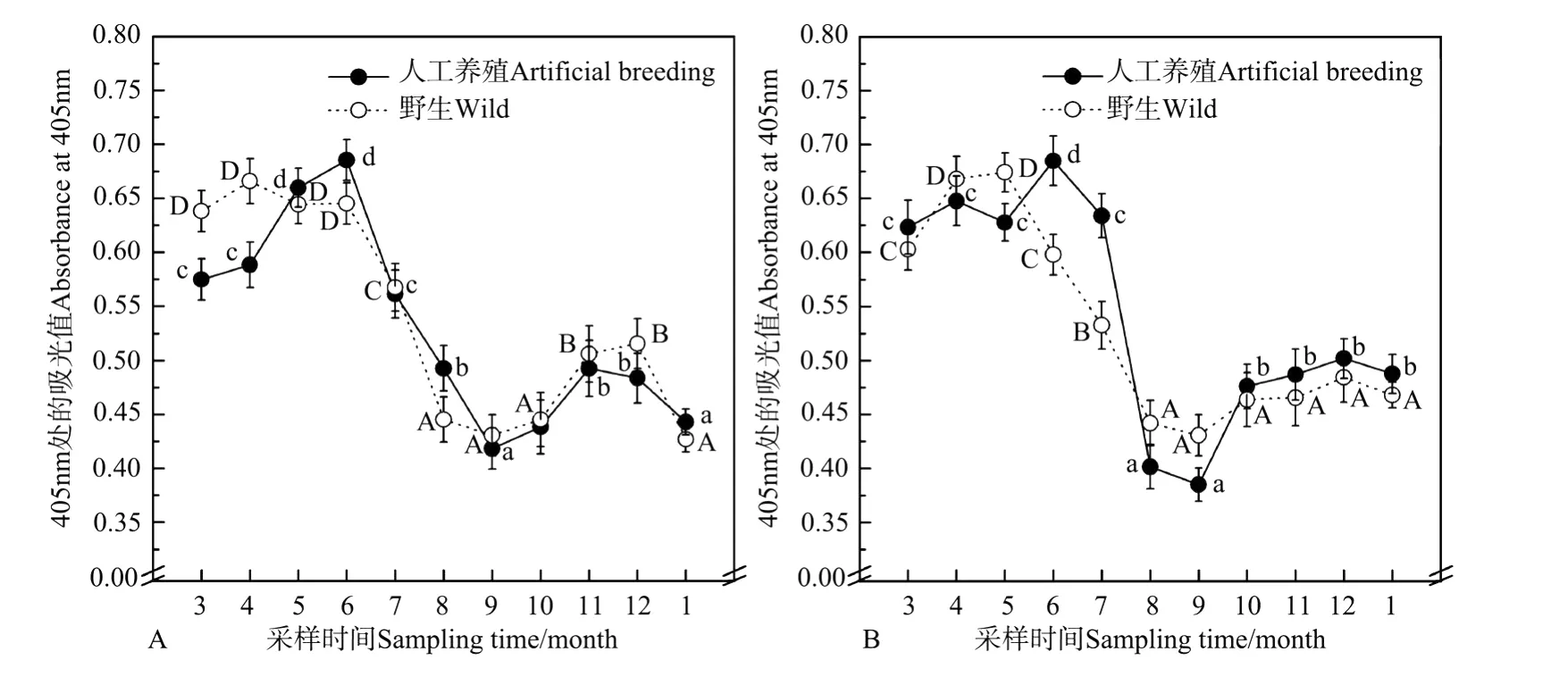
图4 青岛(A)和威海(B)两地区人工养殖的和野生的栉孔扇贝血细胞数量的季节性变化Fig.4 Seasonal variation on haemocyte count of artificial breeding and wild species of C.farreri in Qingdao(A)and Weihai(B)detected by EL ISA
2.3 酶联免疫吸附法(EL ISA)检测血细胞样品
青岛地区人工养殖扇贝3、4月份的ELISA检测OD405nm值分别为(0.575±0.019)和(0.588±0.021),从4月份开始显著升高(P<0.05),于6月份达到峰值(0.685±0.019)。7、8、9月份急剧下降(P<0.05),其中9月仅为(0.418±0.019);从9月开始稍有回升,11月的值为(0.493±0.026),但仍显著低于3~6月的各值(P<0.05);11月后又开始回落,次年1月的值仅为(0.443±0.012)(见图4A)。野生扇贝OD405nm值一开始(3~6月)就维持在0.63之上的高水平,从6月开始急剧下降(P<0.05),其中9月份的值仅为(0.431±0.021),10~12月又有回升,12月的值为(0.516±0.023),但仍显著低于年初水平(P<0.05);此后1月又有回落,其值为(0.427±0.012)(见图4A)。
威海地区人工养殖扇贝OD405nm值一开始(3~7月)就维持在0.62之上的高水平,其中6月达到峰值(0.684±0.023),显著高于其他4个月份(P<0.05);从7月开始急剧下降(P<0.05),于9月达到最低值(0.385±0.016);从9月开始有所回升,其中10~1月基本维持一个稳定的水平,其值基本位于0.48左右,但仍显著低于年初水平(P<0.05)(见图4B)。野生扇贝3月的OD405nm值为(0.603±0.019);从3月开始显著升高,于5月达到峰值(0.674±0.018);此后6,7,8,9月急剧下降(P<0.05),于9月达到最低值(0.431±0.019);此后的时段内基本维持1个稳定水平,其值基本位于0.46左右(见图4B)。
3 讨论
目前常见的用于检测血细胞数量的方法有血球计数板法和流式细胞仪法。尽管这2种方法操作均较简便,但血球计数板法主观性强,误差大;流式细胞术则易将粘连细胞或杂质碎片误计为单个细胞。而基于抗原抗体反应的EL ISA法经过20多年的不断完善,如抗原的包被,酶标抗体的制备和纯化,以及酶底物显色系统的改进,具有特异性强、灵敏度高、可准确定量出抗原含量等特点;更重要的是,EL ISA法可使取自不同时点的大批样品达到同一时间检测的效果[18-19]。
用基于单抗的EL ISA法来检测全血细胞数量的精确与否,与第一抗体(即血细胞单抗)的特性密切相关。一方面既要保证该单抗与各种类型的血细胞均能特异性反应,且阳性率极高;另一方面又要保证该单抗的抗原决定簇极其丰富,即western blotting检测结果为与血细胞成分的多个蛋白特异性结合,因为某一单抗虽具有抗各种类型血细胞的特性,但其抗原决定簇单一的话,在抗原包被中由于血细胞破碎液蛋白极其丰富,很有可能造成目标蛋白未能完全吸附,进而造成检测的不准确性。本文通过间接免疫荧光法和western blo tting法从抗栉孔扇贝血细胞的单抗库中成功筛选到了1株符合以上2点要求的单抗1F7,故将其作为本实验EL ISA检测中的第一抗体。此外本文还通过预实验验证了单抗1F7作为第一抗体的可行性:将血细胞破碎液作20,2-1,2-2,2-3,2-4,2-5,2-6,2-7,2-8梯度稀释后包被,经一抗,二抗,显色液孵育后,发现20,2-1,2-2,2-3,2-4,2-5的OD405nm值存在显著差异,2-6和2-7差异不是很大,而2-8基本接近于阴性对照,表明单抗1F7确实可用于定量血细胞的含量。
本文EL ISA检测结果发现,4、5、6月扇贝的血细胞数量维持一个较高的水平,而这一时段恰逢水温(12~18℃)适宜,饵料(浮游生物)丰富,扇贝性腺饱满,生长快速,表明该时段扇贝处于1种生长旺盛的状态。而接下来的7、8、9月,虽然饵料更为丰富,但其血细胞数量却骤减,究其原因可能与高温和繁殖耗能有关。栉孔扇贝性腺成熟主要集中在5、6月,6月中旬开始产卵、排精直至8月中旬[20],之后性腺干瘪,水温明显升高,扇贝处于1种生长缓慢的状态;加之病原[14]的侵染,导致了该时段扇贝血细胞数量的骤减。而血细胞数量的骤减则意味着扇贝免疫能力下降,是引起夏季大规模死亡的重要原因。Duchemin等[10]报道牡蛎(Crassostrea gigas)在繁殖期时的血细胞数量和吞噬力明显低于繁殖前的各个时段;Lemaire等[21]也表明贻贝(My tilus spp.)在夏秋季时,其血细胞的数量和吞噬力低,死亡率高,主要因为贻贝恰处繁殖期,过多的耗能、过高的水温以及病原增殖侵染所致。而Pipe和Coles[6],Carballal等[11],以及Matozzo等[22]则将繁殖期减少的那部分血细胞归因于造血作用的耗竭亦或是血细胞从开放式循环系统迁移入各组织,尤其是性腺和外套膜等部位。9月份以后,随着水温的回落,以及扇贝的自身调节,血细胞数量有所回升,但仍远远低于春季水平,表明该时段扇贝仍处于恢复期;而年末的12、1月份血细胞数量仍未见明显提升,主要受该时段水温过低,饵料缺乏这些环境因子胁迫所致。
本研究认为:栉孔扇贝春季时由于水温适宜,饵料丰富,其生长旺盛,血细胞数量高;而夏秋季因繁殖耗能,水温过高和病原侵染等,生长缓慢,血细胞数量低。由此,适当提前或推迟扇贝的繁殖期,避过夏秋季高温和病原的刺激,可能会一定程度上减少扇贝的死亡。此外,青岛和威海地区的人工养殖的和野生的栉孔扇贝,其血细胞数量和生长变化趋势基本相仿。
致谢:黄海水产研究所王崇明研究员在扇贝样品采集和提供方面给予了的大力支持;李子牛、张冬冬同学在扇贝清洗和壳长测量方面给予了帮助;在此一并致以衷心的感谢!
[1] Cheng T C.Hemocytes:forms and functions[M].∥Kennedy VS,Newell R I E,Eble A F(Eds).The Eastern Oyster Crassostrea virginica.MD,USA:Maryland Sea Grant,College Park,MD,USA,1996:299-333.
[2] Cheng T C.A classification of molluscan hemocytes based on functional evidences[J].Comp Pathobiol,1984,6:111-146.
[3] Hégaret H,Wikfors G H,Soudant P.Flow cytometric analysis of haemocytes from eastern oysters,Crassostrea virginica,subjected to a sudden temperature elevation II.Haemocyte functions:aggregation,viability,phagocytosis,and respiratory burst[J].J Exp Mar Biol Ecol,2003,293(2):249-265.
[4] Mount A S,Wheeler A P,Paradkar R P,et al.Hemocyte-mediated shellmineralization in the eastern oyster[J].Science,2004,304(5668):297-300.
[5] Matozzo V,Rova G,Marin M G.Haemocytes of the cockle Cerastodermag laucum:morphological characterisation and involvement in immune responses[J].Fish Shellfish Immunol,2007,23(4):732-746.
[6] Pipe R K,Coles J A.Environmental contaminants influencing immune function in marine bivalve molluscs[J].Fish Shellfish Immunol,1995,5(8):581-595.
[7] Yu J H,Song J H,Choi M C,et al.Effects of water temperature change on immune function in surf clams,Mactra veneriform is(Bivalvia:Mactridae)[J].J Invertebr Pathol,2009,102(1):30-35.
[8] 马洪明,刘晓伟,麦康森,等.盐度突降对栉孔扇贝(Chlam ys farreri)抗病力指标的影响[J].高技术通讯,2006,16(7):746-751.
[9] Xu B,Chen M Y,Yang H S,et al.Starvation-induced changes of hemocyte parameters in the zhikong scallop Chlamys farreri[J].J Shellfish Res,2008,27(5):1195-1200.
[10] Duchemin M B,Fournier M,Auffret M.Seasonal variations of immune parameters in diploid and triploid Pacific oysters,Crassostrea gigas(Thunberg)[J].Aquaculture,2007,264(1-4):73-81.
[11] Carballal M J,Villalba A,L pez C.Seasonal variation and effects of age,food availability,size,gonadal development,and parasitism on the hemogram of Mytilus galloprovincialis[J].J Invertebr Pathol,1998,72(3):304-312.
[12] 于瑞海,王如才,田传远,等.栉孔扇贝大面积死亡的原因分析及预防探讨[J].海洋湖沼通报,1998(3):69-72.
[13] 王运涛,相建海.栉孔扇贝大规模死亡的原因探讨[J].海洋与湖沼,1999,30(6):770-774.
[14] 王崇明,王秀华,艾海新,等.栉孔扇贝大规模死亡致病病原的研究[J].水产学报,2004,28(5):547-553.
[15] Xiao J,Ford S E,Yang H S,et al.Studies on mass summer mortality of cultured zhikong scallops(Chlam ys farreri Jones et Preston)in China[J].Aquaculture,2005,250(3-4):602-615.
[16] Xing J,Lin T T,Zhan W B.Variations of enzyme activities in the haemocytes of scallop Chlam ys farreri after infection with the acute virus necrobiotic virus(AVNV)[J].Fish Shellfish Immunol,2008,25(6):847-852.
[17] Xing J,Zhan W B.Characterisation of monoclonal antibodies to haemocyte typesof scallop(Chlam ys farreri)[J].Fish Shellfish Immunology,2005,19(1):17-25.
[18] Smith J L,Allen SJ,Cherrington J M.A rapid antiviral in situ enzyme-linked immunosorbent assay for feline immunodeficiency virus[J].JVirol Methods,1995,54(1):29-38.
[19] 方平,李英文.酶联免疫吸附法在水产养殖中的应用[J].水利渔业,2004,24(1):12-14.
[20] 王如才,王昭萍,张建中.海水贝类养殖学[M].青岛:青岛海洋大学出版社,1993.
[21] Lemaire N,Pellerin J,Fournier M,et al.Seasonal variations of physiological parameters in the blue mussel M ytilus spp.from farm sites of eastern Quebec[J].Aquaculture,2006,261(2):729-751.
[22] Matozzo V,Marin M G,Cima F,et al.First evidence of cell division in circulating haemocytes from the Manila clam Tapes philippinarum[J].Cell Biol Int,2008,32(7):865-868.
