胶州湾沉积物表面酸碱性质及对铜的吸附*
2011-01-10曹晓燕葛成凤杨桂朋
曹晓燕,葛成凤,杨桂朋
(中国海洋大学海洋化学理论与工程技术教育部重点实验室,化学与化工学院,山东青岛266100)
随着工业的迅速发展,排入海洋的重金属污染物质总量不断增加,其产生的危害也日益引起人们的关注。海水中极微量的重金属对海洋生物常常是无害的,有些还是其生长繁殖所必需的,但是过多的重金属会对海洋生物产生毒性[1],并且还会通过它们的富集作用和食物链的传递最终影响人类健康[2]。海水中的重金属可在海水、沉积物、固体悬浮颗粒和海洋生命物质中循环迁移[3]。作为金属元素地球化学行为中的一个重要控制环节,重金属离子在沉积物上的交换吸附行为研究是很有必要的。
国内外对于重金属离子在天然水体沉积物上的交换吸附作用研究多针对河湖沉积物[4-5],而对海洋沉积物的研究报道相对较少[6-7],从沉积物的表面性质角度进行研究的则更为少见[8-9]。Gulmini等[8]针对铜离子存在下的湖泊沉积物进行了电位滴定实验,计算了沉积物表面固有酸度常数和铜络合常数;汤鸿霄等[10-13]利用酸碱电位滴定和表面络合模式拟合相结合的方法,得到了沉积物中对吸附起主要作用的活性组分的零电点、表面电荷、表面位密度、表面固有酸度常数等表面性质,并评估了它们对吸附能力的影响。除了沉积物的固有性质外,介质溶液的离子强度、温度等[14-17]也对吸附行为有重要的影响。本研究以胶州湾沉积物为对象,研究了人工海水介质中Cu2+在沉积物上的吸附行为,考察了温度、盐度等因素对吸附能力的影响,并从表面酸碱性质角度对吸附能力的差异进行解释,以期了解Cu2+在海洋中的迁移转化规律,为综合治理海洋的铜污染问题提供理论依据。
1 材料与方法
1.1 沉积物样品
样品在2008年11月采集于山东省青岛市胶州湾,冷冻保存。陈静生等[18]论证表明,对水体颗粒物结合重金属的研究,以小于63μm粒级作为研究粒级是合理和必要的,因此室温解冻后,湿筛处理沉积物,取小于63μm的组分作为研究对象。对样品进行理化性质测定,其中矿物组成采用X射线粉末衍射法,阳离子交换容量(CEC)采用ED TA-醋酸铵法,比表面和孔径采用N2-BET法。本实验选取理化性质差异较大的两个站点的沉积物作为研究对象,记为1#、2#,就其对Cu2+的吸附能力进行对比研究。2站位沉积物样品的理化性质列于表1。
1.2 表面酸碱电位滴定实验
准确称取沉积物样品(0.100 0±0.000 1)g于滴定杯中,用1 mol·L-1NaNO3溶液调整到一定离子强度(0.1,0.5 mol·L-1),且总体积为50 mL。用自动电位滴定仪先滴加HNO3至p H<3,搅拌使样品与介质中H+交换完全,然后用NaOH滴定至p H>10.5。实验过程中始终通氮气以排除空气中二氧化碳的影响。空白实验为与样品实验相同离子强度时的酸量滴定上清液[12]。
1.3 吸附动力学实验
一系列50 m L塑料离心管中,各加入(0.200 0±0.000 1)g沉积物和20 m L 200 mg·L-1的Cu2+溶液,于恒温空气振荡器中平衡振荡,每隔一定时间分别取样,于4 500 r·min-1离心分离,上清液用阶梯扫描溶出伏安法测定Cu2+残余浓度。根据起始浓度和残余浓度之差计算Cu2+在沉积物上的即时吸附量,绘制吸附动力学曲线。实验研究了在人工海水(ASW)、稀释人工海水(DASW)、蒸馏水(DW)介质中的动力学曲线,人工海水的配制参照Martin[19]的方法,组成为:24.7 g NaCl,13.0 g MgCl2·6H2O,9.0 g Na2SO4·10H2O溶于954 g H2O中,稀释人工海水是将等体积的人工海水和蒸馏水混合之后得到的。
1.4 等温吸附实验
一系列50 mL塑料离心管中,各加入(0.200 0±0.000 1)g沉积物和20mL不同浓度(0~500mg·L-1)的Cu2+溶液,于恒温空气振荡器中振荡平衡后,于4 500 r·min-1离心分离,测定上清液中Cu2+残余浓度,计算Cu2+在沉积物上的吸附量,绘制吸附等温线。实验研究了不同温度(20,25,30,35℃)和介质(ASW、DASW、DW)中的吸附等温线。
1.5 Cu2+浓度的测定方法
本实验采用阶梯扫描溶出伏安法测定Cu2+的浓度[20]。所用参比电极为饱和甘汞电极,对电极为铂片电极,工作电极为银基汞膜电极。镀汞膜前先将电极浸入1∶1 HNO3中清洗后用蒸馏水冲洗,再浸入氨水(2 mol·L-1)中5 m in,反复数次后在其表面均匀涂1层汞膜,在氨水中浸泡4~5 h后即可使用。经测试该方法的相对标准偏差为4%,重现性较好。
2 结果与讨论
2.1 沉积物部分理化性质
实验中以湿筛处理沉积物得到的<63μm的组分作为研究对象,其部分理化性质测定结果列于表1。

表1 胶州湾沉积物<63μm组分部分理化性质Table 1 Physical and chemical p roperties of the Jiaozhou Bay sediments
2.2 沉积物表面酸碱性质
人工海水中的离子强度约为0.7 mol·L-1,稀释人工海水中的离子强度约为0.35 mol·L-1,蒸馏水中的离子强度近似为零,因此表面酸碱性质测定中选用离子强度为0.5和0.1 mol·L-1NaNO3的背景电解质进行对比。
沉积物颗粒的表面净电荷定义为永久结构电荷和可变电荷之和,可变电荷与溶液p H有关,又叫质子电荷,可由电位滴定实验获得[21]:
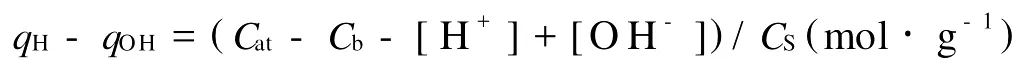
式中,qH和qOH分别为滴定过程中颗粒表面吸附的H+和OH-(mol·g-1),Cat、Cb分别为加入的酸和碱的浓度(mol·L-1),[H+]和[OH-]分别为由p H测定所得的H+和OH-浓度,CS为实验体系中沉积物的含量(g·L-1)。
图1a为1#站点沉积物在0.5 mol·L-1NaNO3介质中样品和空白的滴定曲线,可以看出,空白也显示出p H缓冲容量,说明液相中存在消耗OH-的反应,譬如沉积物中可能溶出的硅酸等的水解反应[22]。图1b为0.5 mol·L-1NaNO3介质中,滴定实验得到的1#和2#站点沉积物的qH-qOH~p H的关系曲线。由图1b可以看出,2个站点沉积物的表面质子电荷qH-qOH随p H值的变化规律一致,在低p H值时由于沉积物表面基团的质子化作用qH-qOH为正值,随p H值升高,去质子作用使表面的H+逐渐减少,OH-逐渐增多。由2条曲线的相对位置及坡度可以看出,在实验滴定p H值范围内,1#曲线整体位于2#之上,且1#曲线的坡度比2#陡,表示1#站点沉积物表面质子电荷在相同p H值下比2#多,1#质子电荷的变化范围比2#也大,因此可以推断1#沉积物表面可发生质子化和去质子反应的表面位多于2#。
可利用Gran作图法确定等价点处滴定剂加入的体积(Ve),进而推算表面位浓度HS。其中,Gran函数(G)按文献[22]中的方法计算。HS(mol·L-1)是利用Gran图中2个等当点值扣除空白后计算得到的,相应的公式如下:

其中Ve1、Ve2为样品滴定Gran图确定的滴定终点起始和终止体积,Ve1′、Ve2′为空白滴定Gran图确定的滴定终点起始和终止体积,V0是悬浮液初始体积,Cb为加入的碱的浓度(mol·L-1)。
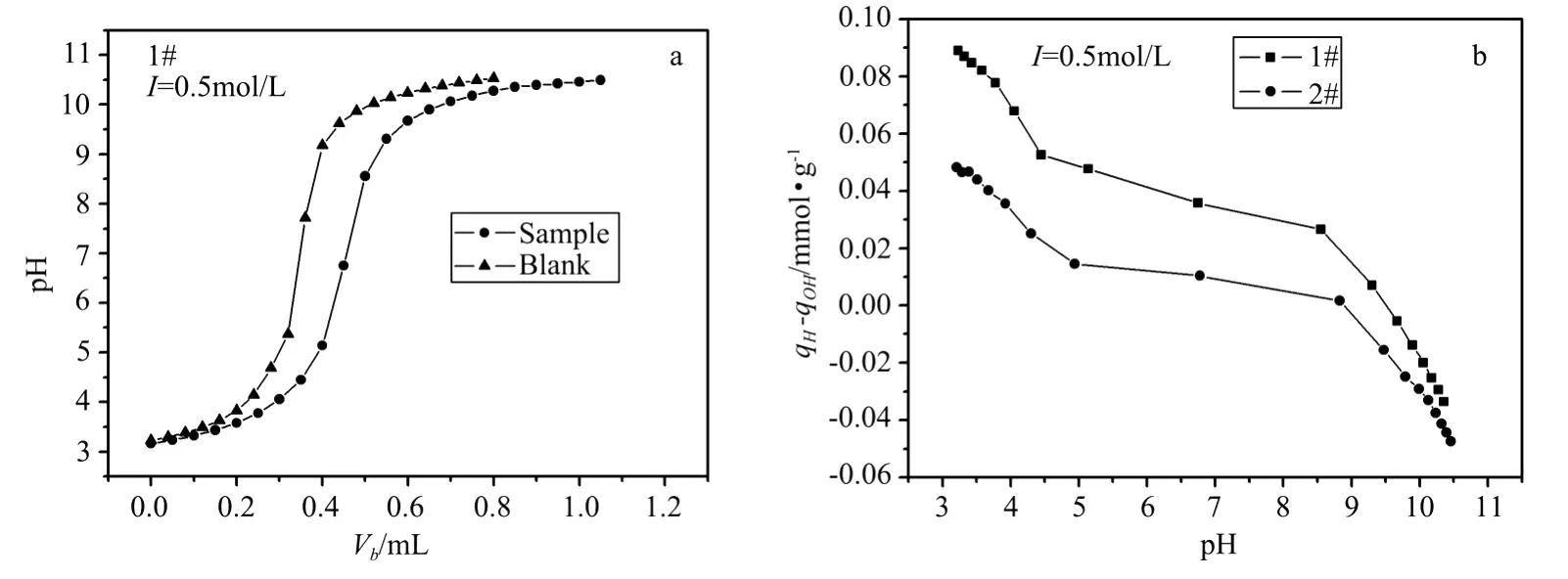
图1 胶州湾1#站点沉积物的滴定曲线a和2个站点沉积物q H-q OH~p H的关系曲线bFig.1 Batch titration curves a and plots of q H-q OH vs.p H b of Jiaozhou Bay sediments

图2 胶州湾1#站点沉积物的实时Gran图a和2个站点沉积物的TOTH~p H图bFig.2 In situ Gran p lots a and p lo ts of TOTH vs.p H b of Jiaozhou Bay sediments
以1#站点沉积物为例,其在0.5 mol·L-1NaNO3介质中样品和空白碱量反滴定数据的Gran图见图2a。由于在Ve1之前除酸碱中和反应外,没有明显的消耗OH-的表面反应,故该点被视为滴定零点(ZPT)[22],在各滴定点上,总反应H+浓度TOTH为:

得到的胶州湾2个站点沉积物的TOTH~p H图见图2b,其中TOTH为0时对应的p H为零净质子电荷点(p HPZNPC),表示滴定时从p HPZNPC开始由质子化反应转为去质子反应。图2b中显示,2个站点沉积物的p HPZNPC均在4.0~4.5之间,1#沉积物的p HPZNPC略低于2#。
1#和2#样品2种不同离子强度下的HS结果列于表2。1#站点沉积物的平均HS大于2#站点;对同一站点沉积物在0.5 mo l·L-1NaNO3介质中的HS要稍大于0.1 mol·L-1NaNO3介质中的HS。有研究证明,NO3-等阴离子的存在会影响无定型铝硅酸盐中硅、铝的局部结构,并改变其表面电荷性质[23]。本实验的结果说明NaNO3介质的存在促进了氢离子在样品表面的吸附,孙中溪等[24]过对纳米四氧化三铁表面酸碱性质进行研究,得到了类似的结果,认为可能是由于硝酸根通过与表面羟基生成氢键而吸附,表面硝酸根的负电性引起氢离子的进一步吸附。

表2 胶州湾1#和2#站点沉积物的表面位浓度Table 2 H S values for Jiaozhou Bay sediments in differentmedia
2.3 沉积物对Cu2+的动力学吸附行为
1#站点沉积物在不同介质中对Cu2+的动力学吸附曲线见图3。由图可以看出,吸附在2 h左右基本达到平衡。
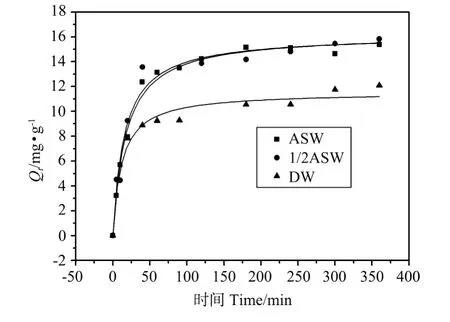
图3 胶州湾1#站点沉积物在不同介质中对Cu2+的吸附动力学曲线(25℃)Fig.3 Adsorption kinetics of copper onto Jiaozhou Bay sediment(1#)in different media(25℃)
分别用Lagergren伪一级动力学方程Qt=Qe(1-ek1t)、Ho-M c Kay伪二级动力学方程Elovich方程Qt=A+B lnt(A=1/βln(αβ),B=1/β)、抛物线扩散方程Qt=C+ktt1/2、幂函数速率方程Qt=atks[25]对动力学曲线进行非线性拟合,以上各式中:Qt为t时刻吸附量(mg·g-1),Qe为平衡吸附量(m g·g-1);k1为一级吸附速率常数(min-1);k2为二级吸附速率常数(g·mg-1·min-1);A、B为模型参数,α可作为表观吸附速率常数,β是反映吸附剂表面覆盖率的增加,吸附活化能Ea随之增加的比例系数;kt(mmol·g-1·m in-1/2)为颗粒内扩散速率常数,C为常数,如果C=0,代表此吸附过程中粒内扩散作用是唯一速度控制步骤;ks为吸附速率系数,a为常数。拟合结果见表3。其中用抛物线扩散方程拟合得到的r2值均低于0.8,拟合效果较差,因此没有列于表中。
由表3中相关系数r2的大小可以看出,1#站点沉积物在ASW、DASW和DW中的动力学吸附曲线用伪一级、伪二级动力学方程、Elovich方程拟合效果较好,而幂函数速率方程仅对DW中的动力学吸附拟合度高。进一步对比平衡吸附量实验值Qe(exp)和计算值Qe(cal)之间的差异可以得出,伪二级动力学方程能够更好地描述该过程,这也是与文献[4,26]中关于重金属吸附动力学的实验结果相一致的。不同介质中吸附速率大小为ASW 表3 胶州湾1#站点沉积物在不同介质中的吸附动力学拟合结果(25℃)Table 3 Rate constants and regression coefficients for adsorption of copper onto Jiaozhou Bay sediment(1#)in differentmedia(25℃) 2.4.1 不同介质中沉积物对Cu2+的吸附等温线 批量平衡实验中取同量沉积物置于Cu2+浓度为0 mg·L-1的介质溶液中进行的空白实验证实,沉积物中可能含有的微量铜对实验造成的影响可以忽略。不同介质中1#和2#站点沉积物对Cu2+的等温吸附曲线见图4。用Langmuir等温式和Frendlich等温式拟合的结果见表4。 表4 胶州湾1#和2#站点沉积物在不同介质中对Cu2+的等温吸附拟合结果(25℃)Table 4 Langmuir and Freundlich constants for adsorption of copper onto Jiaozhou Bay sediments(1#、2#)in different media(25℃) 由表4中的相关系数r2对比可以看出,沉积物对Cu2+的等温吸附曲线与Langmuir模型拟合度较高,与文献[5,15]中的结果一致。电解质浓度的大小对重金属在沉积物的吸附有很大影响。表4中不同浓度电解质中的沉积物对Cu2+的吸附实验数据显示,在DASW中的吸附能力稍大于ASW,两者均大于在DW中的吸附能力。研究[27-31]证明,电解质浓度主要通过两个方面的因素影响吸附剂对金属离子的吸附能力:一方面是电解质浓度增大引起固-液界面双电层压缩,加大了吸附剂表面Stern层电势差,从而提高对金属离子的吸附能力;另一方面是电解质浓度增大引起金属离子活度的迅速减小,并且还存在介质阳离子的竞争吸附,降低了对金属离子的吸附能力。对于淡水,典型的双电层的厚度是在5~20 nm范围内,在海水中,双电层的厚度是在0.4 nm数量级,类似于1个水合离子的半径,因此在海水中双电层是非扩散型的[32]。由此可以推测,相对于DW而言,ASW和DASW中电解质离子的存在引起的双电层压缩和电势差增大,导致DW中的吸附能力小于ASW和DASW中的吸附能力;但当电解质浓度继续增大时,双电层压缩作用不再是主要因素,而由电解质浓度增大引起的抑制作用占主导地位,因此ASW中的吸附能力要小于DASW中的吸附能力。 用2#站点沉积物做了对比实验,见图4(b),用Langmuir等温式拟合的结果见表4。相同条件下,2#站点沉积物对铜的饱和吸附量低于1#。 沉积物吸附Cu2+能力的大小主要与沉积物中活性吸附组分如有机碳、粘土矿物及活性金属氧化物的含量有关[7]。有机质可以与一系列金属离子形成简单络合物及混合配位络合物,使得吸附能力大大增强[33]。粘土矿物对于沉积物吸持重金属通常具有双重贡献,即它们既能直接吸持重金属(因其具有大的比表面),又可作为沉积物中铁、锰氧化物和有机碳等的机械基质,从而间接地影响沉积物对重金属的吸持[34],虽然粘土矿物单位重量吸附值远比其他组分低,但因其含量高,故可成为吸附作用中的主要贡献者[35]。已有的研究证明,较大的阳离子交换容量[10,36-37]、较大的HS[10]、较低的零净质子电荷点p HPZNPC[9]的吸附剂,其吸附能力越强。由理化性质及表面性质的结果得出,粘土矿物含量、有机碳含量、阳离子交换容量(CEC)(见表1)以及HS(见表2)的大小均为1#>2#,且1#p HPZNPC略低于2#,与同一介质中饱和吸附量的顺序1#>2#相一致,这说明沉积物对Cu2+的吸附能力与沉积物的组成和表面性质密切相关。 图4 胶州湾1#和2#站点沉积物在不同介质中对Cu2+的等温吸附曲线(25℃)Fig.4 Adsorption isotherms of copper onto Jiaozhou Bay sediments(1#、2#)in different media(25℃) 2.4.2 不同温度下1#站点沉积物对Cu2+的吸附等温线 1#站点沉积物ASW介质中20、25、30和35℃下对Cu2+的吸附等温线见图5,用Langmuir等温式拟合后的结果列于表5。3条曲线可以用Langmuir等温式较好的拟合。随温度的升高,最大吸附量呈增大趋势,说明表面活性吸附位随温度升高而增大[4]。 图5 胶州湾1#站点沉积物ASW介质中不同温度下对Cu2+的等温吸附曲线Fig.5 Adsorption isotherms of copper onto Jiaozhou Bay sediment(1#)at different temperatures(in ASW) 表5 胶州湾1#站点沉积物ASW介质中不同温度下对Cu2+的等温吸附曲线以Langmuir等温式拟合结果Table 5 Langmuir constants for adsorption of copper onto Jiaozhou Bay sediment(1#)at different temperatures(in ASW) 吸附过程的标准吉布斯自由能通过吉布斯方程得到: 其中Kd为热力学平衡常数,本实验用KL来代替K d[38]。 利用Van’t Hoff方程可以计算各热力学函数: 式中:ΔG0为标准吸附吉布斯自由能变,kJ·mol-1;R为理想气体常数,8.314 J·mol-1·K-1;T为绝对温度,K;ΔH0为标准吸附焓变,kJ·mol-1;ΔS0为标准吸附熵变,J·mol-1·K-1。 在本实验研究的温度范围内,不考虑温度对ΔH0和ΔS0的影响,将式中的ln KL对T-1作图(见图6),得到线性方程ln KL=-3154/T+15.35(r=0.968 7)。计算得到的ΔG0、标准吸附焓变ΔH0、标准吸熵变ΔS0的值列于表6。可见Cu2+在胶州湾沉积物上的吸附是自发、吸热、熵增加的过程。 图6 ln K L对1/T作图Fig.6 Van’t Hoff plot for adsorption of copper onto Jiaozhou Bay sediment(1#) 表6 胶州湾1#站点沉积物ASW介质中不同温度下对Cu2+的等温吸附热力学计算结果Table 6 Thermodynamic parameters for adsorption of copper onto Jiaozhou Bay sediment(1#)in ASW (1)胶州湾2个站点沉积物随p H值由3增大到10表面质子电荷密度的值由正转负,零净质子电荷点p HPZNPC均在4.0~4.5之间。 (2)铜离子在胶州湾沉积物上的动力学吸附行为与伪二级动力学方程和Elovich方程符合较好,ASW、DASW、DW中的吸附速率依次增大。 (3)铜离子在胶州湾沉积物上的等温吸附行为可用Langmuir方程描述,是自发、吸热、熵增加的过程。饱和吸附量与沉积物组成和表面酸碱性质密切相关,表面位浓度大、零净质子电荷点低的样品其饱和吸附量大。不同介质中饱和吸附量顺序为DW [1] 曲克明,袁有宪,张渡溪,等.金藻培养液中铜锌离子的最佳活度[J].中国水产科学,1995,2(3):8-14. [2] 丁天明,王飞,严世强.我国沿岸海域环境污染对渔业可持续发展的影响及对策探讨[J].水产科技情报,2001,28(1):44-48. [3] 贺志鹏,宋金明,张乃星,等.南黄海表层海水重金属的变化特征及影响因素[J].环境科学,2008,29(5):1153-1162. [4] Dali-youcef N,Ouddane B,Derriche Z.Adsorption of zinc on natural sediment of Tafna River(Algeria)[J].Journal of Hazardous Materials,2006,137(3):1263-1270. [5] 庄云龙,石秀春.铜、锌、铅、镉在淀山湖沉积物上的吸附特性[J].上海大学学报:自然科学版,2002,8(6):526-529. [6] Sanghwa O,Moon Y K,Won S S.Competitive so rp tion of lead and cadmium onto sediments[J].Chemical Engineering Journal,2009,152(2-3):376-388. [7] 田玉红,张正斌,刘莲生.南沙群岛海区表层沉积物吸附铜离子的实验研究[J].热带海洋,1999,18(4):69-74. [8] Gulmini M,Zelano V,Daniele P G,et al.Acid-base and copper(II)sorption properties of a natural lake sediment:potentiometric and atomic absorption spectrometric characterization[J].Analytica Chimica Acta,1998,358(2):195-204. [9] Sako A,Lopes L,Roychoudhury A N.Adsorption and surface complexation modeling of palladium,rhodium and platinum in surficial semi-arid soils and sediment[J].Applied Geochemistry,2009,24(1):86-95. [10] Zhou Y M,Liu R X,Tang H X.Sorption interaction of phenanthrene with soil and sediment of different particle sizes and in various CaCl2solutions[J].Journal of Colloid and Interface Science,2004,270(1):37-46. [11] 文湘华,杜青,汤鸿霄.乐安江沉积物对重金属的吸附模式研究[J].环境科学学报,1996,16(1):13-22. [12] 刘文新,汤鸿霄.不同地域天然伊利石表面酸碱特性的比较[J].环境科学学报,2001,21(6):695-700. [13] 王向天,黄君礼,汤鸿霄.高岭土和二氧化硅的表面酸碱性质定量模式计算[J].哈尔滨建筑大学学报,2001,34(3):56-59. [14] 邹献中,徐建民,赵安珍,等.离子强度和p H对可变电荷土壤与铜离子相互作用的影响[J].土壤学报,2003,40(6):845-851. [15] 路永正,阎百兴.重金属在松花江沉积物中的竞争吸附行为及p H的影响[J].环境科学研究,2010,23(1):20-25. [16] 徐仁扣,肖双成,蒋新,等.p H对Cu(II)和Pb(II)在可变电荷土壤表面竞争吸附的影响[J].土壤学报,2006,43(5):871-874. [17] 金相灿.黄河中游悬浮物对铜、铅和锌的吸附与释放的研究[J].中国环境科学,1984,4(4):54-57. [18] 陈静生,王飞越,陈江麟.论小于63μm粒级作为水体颗粒物重金属研究介质的合理性及有关粒级转换模型研究[J].环境科学学报,1994,14(4):419-425. [19] Martin D F.Marine Chemistry,vol.1:Analyticalmethods(2nd ed.)[M].New Yo rk:Marcel Dekker,Inc,1972:143-158. [20] 陈培榕,李景虹,邓勃.现代仪器分析实验与技术(第2版)[M].北京:清华大学出版社,2006. [21] 文湘华,杜青,李莉莉,等.天然水体沉积物的表面特征[J].环境化学,1996,15(2):97-106. [22] 刘文新,储昭生,汤鸿霄.黄土表面酸碱性质的研究[J].环境科学学报,2003,23(1):6-10. [23] Miyazaki A,Yokoyama T.Effects of anionson local structure of Al and Si in aluminosilicates[J].Journal of Colloid and Interface Science,1999,214(2):395-399. [24] 孙中溪,郭淑云.纳米四氧化三铁表面酸碱性质研究[J].高等学校化学学报,2006,27(7):1351-1354. [25] 涂从.土壤体系中的化学动力学方程及其应用[J].热带亚热带土壤科学,1994,3(3):175-182. [26] Ijagbemi C O,Baek M-H,Kim D-S.Montmorillonite surface properties and sorption characteristics for heavy metal removal from aqueous solutions[J].Journal of Hazardous Materials,2009,166(1):538-546. [27] 吴大清,彭金莲,刁桂仪,等.淡-咸水界面切换中矿物表面吸附性变化研究[J].地球化学,1999,28(2):155-162. [28] 薛红喜,何江,樊庆云,等.黄河包头段常见离子对重金属在沉积物上吸附影响机制研究[J].地理科学,2008,28(3):407-411. [29] Ravat C,Dumonceau J,Monteil-Rivera F.Acid/base and Cu(II)binding properties of natural organic matter extracted from w heat bran:modeling by the surface complexation model[J].Water Research,2000,34(4):1327-1339. [30] 侯涛,徐仁扣.胶体颗粒表面双电层之间的相互作用研究进展[J].土壤(soils),2008,40(3):377-381. [31] 李素珍,徐仁扣.可变电荷土壤中胶粒双电层的相互作用与阴阳离子同时吸附[J].土壤学报,2009,46(5):948-952. [32] W.斯塔姆,J.J.摩尔根.水化学:天然水体化学平衡导论[M].汤鸿霄等译.北京:科学出版社,1987:457. [33] Bertin C,Boury A CM.Trends in the heavy metal content(Cd,Pb,Zn)of river sedimentsin the drainage basin of smelting activities[J].Water Research,1995,29(7):1729-1736. [34] 陈静生,王飞越,宋吉杰,等.中国东部河流沉积物中重金属含量与沉积物主要性质的关系[J].环境化学,1996,15(1):8-14. [35] 陈静生,周家义.中国水环境重金属研究[M].北京:中国环境科学出版社,1992:53-98. [36] 赵振国主编.吸附作用应用机理(第1版)[M].北京:化学工业出版社,2005:436. [37] Suraj G,Iyer C S P,Lalithambika M.Adsorption of cadmium and copper by modified kaolinites[J].Apllied Clay Science,1998,13(4):293-306. [38] Kul A R,Koyuncu H.Adsorption of Pb(II)ions from aqueous solution by native and activated bentonite:Kinetic,equilibrium and thermodynamic study[J].Journal of Hazardous Materials,2010,179(1-3):332-339.
2.4 沉积物对Cu2+的等温吸附行为



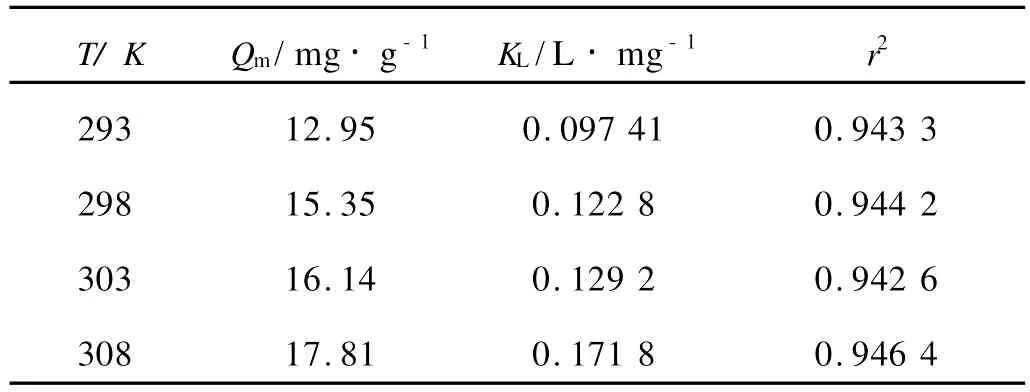




3 结论
